11 வது வேதியியல் : அலகு 5 : கார மற்றும் காரமண் உலோகங்கள்
கார உலோகச்சேர்மங்களின் பொதுப் பண்புகள்
கார உலோகச்சேர்மங்களின் பொதுப் பண்புகள்
கார உலோகங்களின் அனைத்து பொதுவான சேர்மங்களும் அயனித்தன்மை கொண்டவை. அவற்றின் சேர்மங்களின் பொதுப்பண்புகள் கீழே விவாதிக்கப்பட்டுள்ளன.
ஆக்சைடுகள் மற்றும் ஹைட்ராக்சைடுகள்
கார உலோகங்களை அதிகளவு காற்றில் எரிக்கும்போது M2O என்ற மூலக்கூறு வாய்ப்பாடு கொண்ட சாதாரண ஆக்சைடுகளை உருவாக்குகின்றன. அவை நீருடன் வினைப்பட்டு அவற்றின் காரத்தன்மையுள்ள ஹைட்ராக்சைடுகளை உருவாக்குகின்றன.
M2O + H2O → 2 MOH
லித்தியத்தை தவிர மற்ற கார உலோகங்களை அதிகளவு காற்றில் எரிக்கும்போது சாதாரண ஆக்சைடுகளுடன் சேர்த்து பெராக்சைடுகளையும் உருவாக்குகின்றன. இந்த பெராக்சைடுகள் நீருடன் வினைபுரியும்போது ஹைட்ராக்சைடுகள் மற்றும் H2O2 ஐ உருவாக்குகின்றன.
M2O2 + 2 H2O → 2 MOH + H2O2
(M = Na, K, Rb, Cs)
லித்தியம் மற்றும் சோடியம் தவிர மற்ற கார உலோகங்கள் சூப்பர் ஆக்சைடுகளையும் உருவாக்குகின்றன. இந்த சூப்பர் ஆக்சைடுகளும் நீருடன் வினைபுரியும்போது காரத் தன்மை கொண்ட ஹைட்ராக்சைடுகளை உருவாக்குகின்றன.
2 MO2 + 2 H2O → 2 MOH + H2O2 + O2
(M = K, Rb, Cs)
உரிய நிபந்தனைகளின் கீழ் M2O, M2O2, அல்லது MO2, ஆகிய சேர்மங்களை தூய நிலையில் தயாரிக்கலாம்.
ஆக்சைடுகள் மற்றும் ஹைட்ராக்சைடுகளின் பண்புகள்
தூய நிலையில் ஆக்சைடுகள் மற்றும் பெராக்சைடுகள் நிறமற்றவை. ஆனால் சூப்பர் ஆக்சைடுகள் மஞ்சள் அல்லது ஆரஞ்சு நிறத்தில் இருக்கின்றன. பெராக்சைடுகள் டையா காந்தத்தன்மை கொண்டவை, ஆனால் சூப்பர் ஆக்சைடுகள் பாரா காந்தத்தன்மை கொண்டவை. சோடியம் பெராக்சைடு ஆனது ஆக்ஸிஜனேற்றியாக பரவலாகப் பயன்படுகிறது. ஆக்சைடுகளை நீருடன் வினைப்படுத்தி பெறப்படும் ஹைட்ராக்சைடுகள் அனைத்தும் வெண்ணிற திண்ம படிகங்களாகும். கார உலோக ஹைட்ராக்சைடுகள் வலிமைமிகு காரங்களாகும். அவை தீவிரமாக நீரேற்றம் அடைவதால், வெப்பத்தை வெளியேற்றி நீரில் கரைகின்றன.
ஹேலைடுகள்:
கார உலோக ஹேலைடுகள் MX (X = F, Cl, Br, I) ஆனவை நிறமற்ற, அதிக உருகுநிலைகளைக் கொண்ட படிக திண்மங்கள் ஆகும். அவைகள் தகுந்த ஆக்சைடு, ஹைட்ராக்சைடு அல்லது கார்பனேட்டை நீர்த்த ஹைட்ரோஹேலிக் அமிலத்துடன் (HX) வினைப்படுத்தி பெறப்படுகின்றன. Li லிருந்து Cs வரை கார உலோகங்களின் நேர்மின்தன்மை அதிகரிப்பதால், உலோகங்களின் ஹேலைடுகள் உருவாக்கும் தன்மை Li லிருந்து Cs வரை அதிகரிக்கிறது. LiBr மற்றும் LiI ஆகியவை தவிர்த்து மற்ற எல்லா ஹேலைடுகளும் அயனித்தன்மை கொண்டவை. LiF தவிர்த்து மற்ற எல்லா ஹேலைடுகளும் நீரில் கரைகின்றன. நீரில் LiF இன் மிகக்குறைந்த கரையும் திறனுக்கு காரணம் அதன் படிக கூடு என் தால்பி அதிகம் (மற்றும் Li+ மற்றும் F- ஆகியவற்றின் சிறிய உருவளேவயாகும்). LiBr மற்றும் LiI ஆகியவை சகப்பிணைப்புத் தன்மையை கொண்டிருப்பதால் கரிம கரைப்பான்களில் கரைகின்றன.
ஆக்சோ அமில உப்புகள்
கார உலோகங்கள் அனைத்து ஆக்சோ-அமிலங்களுடனும் உப்புகளை உருவாக்குகின்றன. இந்த உப்புகளில் பெரும்பாலானவை நீரில் கரைகின்றன மேலும் வெப்ப நிலைப்புத் தன்மையைக் கொண்டுள்ளன. தொகுதியில் மேலிருந்து கீழாக செல்லச் செல்ல நேர்மின்தன்மை அதிகரிப்பதால், கார்பனேட்டுகள் மற்றும் பைகார்பனேட்டுகளின் நிலைப்புத்தன்மை அதிகரிக்கின்றன. இதற்குக் காரணம் கார உலோக நேரயனிகளின் முனைவாக்கும் திறன் குறைவதே ஆகும். கார உலோகங்களின் கார்பனேட்டுகள் (M2CO3) 1273K வெப்பநிலை வரை குறிப்பிடத்தக்க நிலைப்புத்தன்மை கொண்டுள்ளன, இந்த வெப்பநிலைக்கு மேல் முதலில் உருகி பின்னர் இறுதியாக சிதைவடைந்து ஆக்சைடுகளை உருவாக்குகின்றன. எனினும் Li2CO3 நிலைப்புத்தன்மை குறைந்து மேலும் உடனடியாக சிதைவடைகிறது.
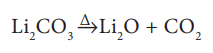
இதற்கு முழுமுதற் காரணம் Li+ மற்றும் CO3-2 அயனிகளுக்கிடையேயான அதிக உருவளவு வேறுபாடு படிக கூட்டை நிலைப்புத் தன்மையற்றதாக்குவதே ஆகும். மிக அதிக காரத்தன்மை கொண்டிருப்பதால் லித்தியம் தவிர்த்து மற்ற கார உலோகங்கள் திண்ம பைகார்பனேட்டுகளை உருவாக்குகின்றன. வேறு எந்த உலோகமும் திண்ம பைகார்பனேட்டுகளை உருவாக்குவதில்லை.
M2CO3 + CO2 + H2O → 2 MHCO3
(M = Na, K, Rb, Cs)
அனைத்து கார்பனேட்டுகளும், பைகார்பனேட்டுகளும் நீரில் கரைகின்றன. மேலும் தொகுதியில் மேலிருந்து கிழாகச் செல்லும்போது அவற்றின் கரைதிறன்கள் வேகமாக அதிகரிக்கின்றன. தொகுதியில் கீழாக செல்லச் செல்ல படிக கூடு ஆற்றல்கள், நீரேற்று ஆற்றல்களை விட மிக வேகமாகக் குறைவதே இதற்குக் காரணம் ஆகும்.