11 வது வேதியியல் : அலகு 5 : கார மற்றும் காரமண் உலோகங்கள்
காரமண் உலோகச் சேர்மங்களின் பொதுப் பண்புகள்
காரமண் உலோகச் சேர்மங்களின் பொதுப் பண்புகள்
இரண்டாம் தொகுதி தனிமங்களிள் முதன்மையான ஆக்சிஜனேற்ற நிலை +2 ஆகும். காரமண் உலோகங்கள் உருவாக்கும் சேர்மங்கள் பெரும்பாலும் அயனித்தன்மை உடையவை. காரஉலோக சேர்மங்களைக் காட்டிலும் குறைவான அயனித்தன்மையினைப் பெற்றுள்ளது. ஏனெனில் இவைகள் சிறிய உருவளவு மற்றும் அதிக உட்கரு மின்சுமையைப் பெற்றுள்ளன. காரமண் உலோகங்களின் சில சேர்மங்களின் பொதுப்பண்புகள் கீழே விவரிக்கப்படுகிறது.
(அ) ஆக்சைடுகள்
காரமண் உலோகங்கள் பொதுவாக மோனாக்சைடுகளையும், பெராக்ஸைடுகளையும் தருகின்றன.
மோனாக்சைடு
உலோகங்களை ஆக்சிஜனுடன் வெப்பப்படுத்தி மோனாக்சைடுகள் பெறப்படுகின்றன. BeO மற்றும் MgO ஆனது நீரில் ஏறத்தாழ கரைவதில்லை. மாறாக மற்ற தனிமங்களின் ஆக்சைடுகள் ஹைட்ராக்சைடுகளைத் தருகின்றன. BeO ஈரியல்புத் தன்மை உடையது. MgO வலிமை குறைந்த காரம், CaO, SrO மற்றும் BaO ஆகியவை வலிமைமிக்க காரங்களாகும். Be2+ அயனியானது சிறிய உருவளவைப் பெற்றிருப்பதால், BeO ஆனது சகப்பிணைப்புத் தன்மையைப் பெற்றுள்ளது. மற்ற தனிமங்களின் ஆக்சைடுகள் அயனித் தன்மை உடையவை.
பெராக்சைடுகள்
பெரிலியத்தினைத் தவிர்த்து, பிற உலோகங்கள் பெராக்சைடுகளைத் தருகின்றன. அதிக வெப்ப நிலையில் மோனாக்சைடுகளை ஆக்ஸிஜனுடன் வினைப்படுத்தி இவைகள் பெறப்படுகின்றன.
2 BaO + O2 → 2 BaO2
ஆ) ஹைட்ராக்சைடுகள்
BeO தவிர்த்து பிற ஆக்சைடுகள் அனைத்தும் காரத்தன்மை உடையவை. அவை நீருடன் வினைபுரிந்து பகுதியளவு கரையக்கூடிய ஹைட்ராக்சைடுகளைத் தருகின்றன.
MO + H2O → M(OH)2
ஒரு தொகுதியில் மேலிருந்து கீழாக, காரமண் உலோக ஹைட்ராக்சைடுகளின் கரைதிறன், வெப்ப நிலைப்புத் தன்மை மற்றும் காரத்தன்மை ஆகியவை அதிகரிக்கின்றன. எனினும் கார உலோக ஹைட்ராக்சைடுகளைக் காட்டிலும் காரமண் உலோக ஹைட்ராக்சைடுகள் குறைவான காரத்தன்மையினைப் பெற்றுள்ளன. பெரிலியம் ஹைட்ராக்சைடு ஈரியல்புத் தன்மை உடையது. இது அமிலம் மற்றும் காரம் ஆகிய இரண்டுடனும் வினைபுரிகிறது.
Be(OH)2 + 2 NaOH → Na2BeO2 + 2 H2O
Be(OH)2 + 2 HCl → BeCl2 + 2 H2O
இ) ஹேலைடுகள்
காரமண் உலோகங்கள் MX2 என்ற பொதுவான வாய்ப்பாடுடைய ஹேலைடுகளை உருவாக்குகின்றன. உலோகங்களை, ஹேலஜனுடன் வெப்பப்படுத்தி இவைகளைத் தயாரிக்க முடியும்.
M + X2 → MX2
Be2+ அயனியானது சிறிய உருவளவைப் பெற்றிருப்பதால் பெரிலியம் ஹேலைடு சகப்பிணைப்புத் தன்மையினைப் பெற்றுள்ளது. பெரிலியம் ஹேலைடுகள் நீர் உறிஞ்சும் தன்மையுடையவை, ஈரக்காற்றில் புகையும் மற்றும் கரிமக்கரைப்பானில் கரையும். படம் 5.9 [வடிவம் (அ)] ல் கண்டுள்ளவாறு பெரிலியம் குளோரைடு திட நிலையில் சங்கிலி வடிவத்தினைப் பெற்றுள்ளது. ஆவி நிலைமையில் BeCl2, குளோரினை இணைப்பு பாலமாக கொண்டுள்ள இருபடி வடிவமைப்பினை (வடிவம் - இ) பெற்றுள்ளது. இது 1200K அளவிலான அதிக வெப்பநிலையில் நேர்கோட்டு ஒருபடியாக சிதைவுறுகிறது (வடிவம் - ஆ).
பெரிலியம் ஹேலைடைத் தவிர்த்து, காரமண் உலோகங்களின் அனைத்து ஹேலைடுகளும் அயனித்தன்மை உடையவை. பிற உலோகங்களின் குளோரைடுகள் மற்றும் புளுரைடுகள் அயனிப்படிகங்களாகும். உருகிய நிலை மற்றும் நீர்க் கரைசல்களில் இவை மின்சாரத்தினை நன்கு கடத்துகின்றன. ஹேலைடு, ஹைட்ரேட்டுகள் உருவாக்கும் தன்மை தொகுதியில் மேலிருந்து கீழாக குறைகிறது. (எடுத்துக்காட்டாக MgCl2.8H2O, CaCl2.6H2O, SrCl2.6H2O மற்றும் BaCl2.2H2O).
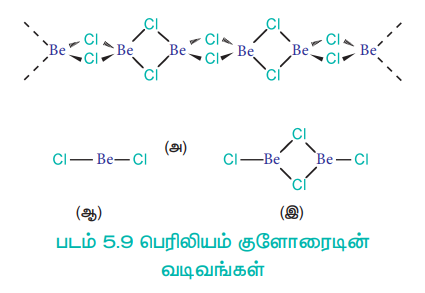
படம் 5.9 பெரிலியம் குளோரைடின் வடிவங்கள்
ஆக்சோஅமில உப்புகள்
காரமண் உலோகங்கள் ஆக்சோ அமிலங்களின் உப்புகளை உருவாக்குகின்றன. அவற்றுள் சில கீழே கொடுக்கப்பட்டுள்ளன.
கார்பனேட்டுகள்
எல்லா கார்பனேட்டுகளும் வெப்பப்படுத்தும் போது சிதைந்து கார்பன்டையாக்சைடு மற்றும் ஆக்சைடைத் தருகின்றன
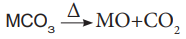
தொகுதியில் மேலிருந்து கீழாக, கார்பனேட்டுகளின் கரைதிறன் குறைகிறது. தொகுதியில் கீழிறங்கும்போது, நேர் அயனிகளின் உருவளவு அதிகரிக்க, அவற்றின் வெப்பநிலைப்புத் தன்மை அதிகரிக்கிறது.
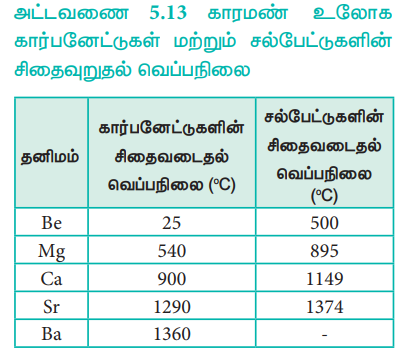
அட்டவணை 5.13 காரமண் உலோக கார்பனேட்டுகள் மற்றும் சல்பேட்டுகளின் சிதைவுறுதல் வெப்பநிலை
சல்பேட்டுகள்
காரமண் உலோகங்களின் சல்பேட்டுகள் வெண்மை நிற திண்மங்களாகும். மற்றும் இவைகள் வெப்ப நிலைப்புத் தன்மை உடையவை. BeSO4 மற்றும் MgSO4 ஆகியவை நீரில் கரைகின்றன. CaSO4 லிருந்து BaSO4 க்குச் செல்லும்போது கரைதிறன் குறைகிறது. Be2+ மற்றும் Mg2+ அயனிகளின் நீரேற்ற என்தால்பி மதிப்புகள் அவற்றின் படிகக்கூடு ஆற்றலை விட அதிகமாக இருப்பதால் அவைகளின் சல்பேட்டுகள் நீரில் கரைகின்றன.
நைட்ரேட்டுகள்
கார்பனேட்டுகளை நீர்த்த நைட்ரிக் அமிலத்தில் கரைத்து நைட்ரேட்டுகள் பெறப்படுகின்றன. மெக்னீசியம் நைட்ரேட் ஆறு நீர் மூலக்கூறுகளுடன் படிகமாகின்றது. பேரியம் நைட்ரேட் நீரற்ற உப்பாக படிகமாகிறது. உருவளவு அதிகரிக்கும் போது ஹைட்ரேட்டுகள் உருவாகும் இயல்பு குறைகிறது. அனைத்து நைட்ரேட்டுகளும் வெப்பப்படுத்தும் போது ஆக்சைடுகளைத் தருகின்றன.