11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
கிராம் சமான நிறை கோட்பாடு
கிராம் சமான நிறை கோட்பாடு
வேதியியலில் குறிப்பாக பகுப்பாய்வு வேதியியலில், மோல் கோட்பாட்டினைப் போன்றே கிராம் சமானநிறை கோட்பாடும் பரவலாக பயன்படுத்தப்படுகிறது. முந்தைய பாடப்பகுதியில் மோல் கோட்பாடு, மூலக்கூறு நிறையின் அடிப்படையில் அமைந்துள்ளது என நாம் அறிந்து கொண்டோம். அதைப்போலவே கிராம் சமான நிறை கோட்பாடும் சமான நிறையினை அடிப்படையாகக் கொண்டது.
வரையறை
1.008g ஹைட்ரஜன் அல்லது 8g ஆக்சிஜன் அல்லது 35.45g குளோரின் இவற்றோடு சேரக்கூடிய அல்லது இவற்றை இடப்பெயர்ச்சி செய்யக்கூடிய ஒரு தனிமம் அல்லது சேர்மம் அல்லது அயனியின் நிறையே, அதன் கிராம் சமான நிறை என வரையறுக்கப்படுகிறது.
பின்வரும் வினையினைக் கருதுக.
Zn + H2SO4 → ZnSO4 + H2 ↑
இவ்வினையில் 1மோல் துத்தநாகம் (zinc) (65.38 g), 1 மோல் ஹைட்ரஜன் மூலக்கூறினை (2.016 g) இடப்பெயர்ச்சி செய்கிறது.
ஃ 1.008g ஹைட்ரஜனை இடப்பெயர்ச்சி செய்யத் தேவையான துத்தநாகத்தின் நிறை
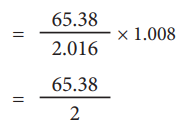
= (65.38 / 2.016) × 1.008
= 65.38 / 2
துத்தநாகத்தின் சமான நிறை = 32.69
துத்தநாகத்தின் கிராம் சமான நிறை = 32.69 g eq-1
சமான நிறைக்கு அலகு இல்லை. ஆனால், கிராம் சமான நிறை g eq-1 என்ற அலகால் குறிப்பிடப்படுகிறது.
ஹைட்ரஜன், ஆக்சிஜன், குளோரின் ஆகிய மூன்றின் அடிப்படையில் அமைந்துள்ள மேலே குறிப்பிடப்பட்டுள்ள வரையறையினை எப்போதும் பயன்படுத்த இயலாது. ஏனெனில், இந்த மூன்றுடன் வினைகள் நடைபெற வாய்ப்பில்லாத நேர்வுகளை நாம் அறிவோம். எனவே, கிராம் சமான நிறையினை கணக்கிட பின்வரும் வாய்பாடு பயனுள்ளதாக அமையும்.
கிராம் சமான நிறை (E) = மோலார் நிறை (g mol-1) / சமான காரணி (eq mol-1)
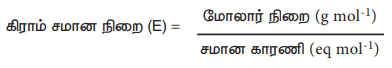
மேற்கண்டுள்ள கூற்றினைப் பயன்படுத்தி, வேதி உட்பொருட்களை நாம் வகைப்படுத்துவதுடன், பின்வரும் அட்டவணையில் அவற்றின் சமான நிறையினைக் கண்டறிய உதவும் வாய்ப்பாட்டினைக் கண்டறிவோம்.
1. அமிலம், காரம், ஆக்சிஜனேற்றி மற்றும் ஆக்சிஜன் ஒடுக்கியின் சமான நிறையினை கணக்கிடுதல்.
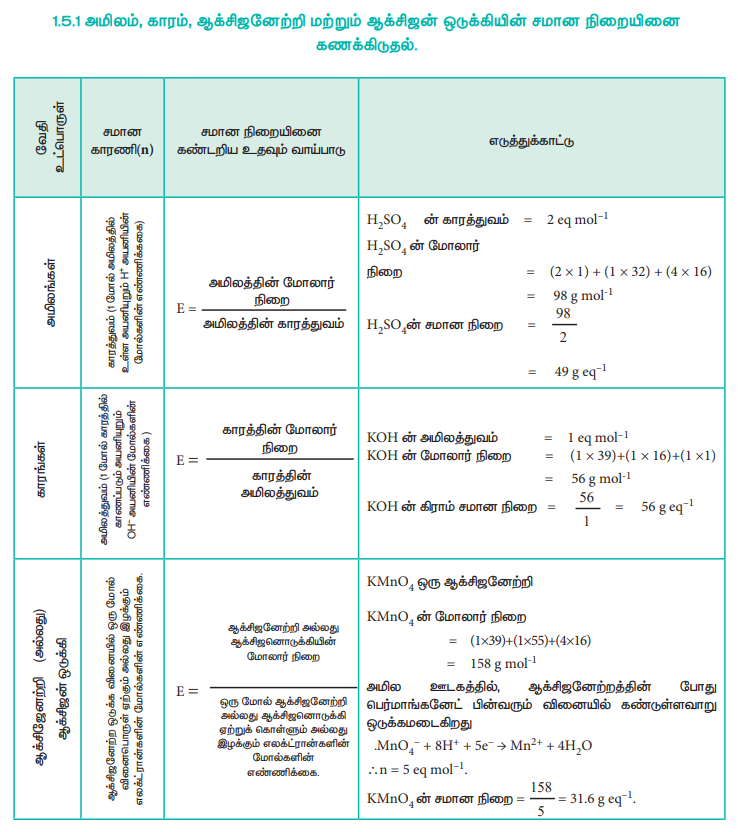
மோல் கோட்பாட்டினை பயன்படுத்தி ஒரு வேதிவினையில் ஈடுபடும் வினைப்பொருட்களின் அளவினைக் கண்டறிய அவ்வினையின் சமன்படுத்தப்பட்ட சமன்பாடு தேவைப்படுகிறது. ஆனால், கிராம் சமான நிறை கோட்பாட்டிற்கு இது தேவையில்லை. ஆக்சிஜனேற்ற – ஒடுக்க வினைகளுக்கு, கிராம் சமான நிறை கோட்பாட்டினையும் அதனை தவிர்த்த பிற வினைகளுக்கு மோல் கோட்பாட்டினையும் நாம் பயன்படுத்துகிறோம்.
எடுத்துக்காட்டாக,
KMnO4 மற்றும் நீரற்ற பெர்ரஸ் சல்பேட்டின் சமானநிறை நமக்குக் தெரிந்திருப்பின்,அவ்விரண்டும் வினைபுரியும் வேதிவினைக்கான சமன்படுத்தப்பட்ட சமன்பாட்டினை எழுதாமலேயே, நேரடியாக 31.6 g KMnO4 ஆனது 152 g FeSO4 உடன் வினைபுரியும் என கிராம் சமான நிறை கோட்பாட்டினை பயன்படுத்தி கூற இயலும்
இதே வினையினை நாம் மோல் கோட்பாட்டினை பயன்படுத்தியும் விளக்கலாம். மேலே குறிப்பிடப்பட்டுள்ள வினைக்கான சமன்படுத்தப்பட்ட சமன்பாடு
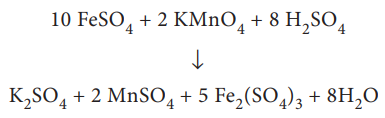
அதாவது, 2 மோல்கள் (2 × 158 = 316 g) பொட்டாசியம் பெர்மாங்கனேட், 10 மோல்கள் (10 × 152 = 1520 g) மோல்கள் நீரற்ற பெர்ரஸ்சல்பேட்டுடன் வினைபுரிகிறது.
ஃ 31.6 g KMnO4 ஆனது (1520 / 316) × 31.6
= 152 g of FeSO4 உடன் வினைபுரிகிறது.
தன்மதிப்பீடு
4. அ) 0.456g உலோகமானது 0.606g அதன் உலோகக் குளோரைடினைத் தருகிறது. உலோகத்தின் சமான நிறையைக் கணக்கிடுக.
தீர்வு
அ) உலோகத்தின் நிறை = 0.456g
உலோக குளோரைடின் நிறை = 0.606g
0.456g உலோகமானது 0.15g குளோரினுடன் இணைந்துள்ளது.
35.5 g குளோரினும் இணையும் உலோகத்தின் நிறை (0.456 / 0.15) × 35.5 = 107.92g eq−1
4. ஆ) பொட்டாசியம் டை குரோமேட்டின் சமான நிறையினைக் கணக்கிடுக. அமில ஊடகத்தில் ஒடுக்க அரைவினை
Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O
தீர்வு
ஆ) ஆக்ஸிஜனேற்ற வினைப்பொருளின் சமான நிறை
= மோலார் நிறை / 1 மோல் ஆக்சிஜனேற்றியால் ஏற்கப்பட்ட எலக்ட்ரான்களின் மோல்களின் எண்ணிக்கை.
= 292.2g mol−1 /6eq mol−1 = 48.7g eq−1
