எடுத்துக்காட்டு, தீர்வு, வகைகள், சமன்பாடுகளை சமன் செய்தல் - ஆக்சிஜனேற்ற - ஒடுக்க வினைகள் | 11th Chemistry : UNIT 1 : Basic Concepts of Chemistry and Chemical Calculations
11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
ஆக்சிஜனேற்ற - ஒடுக்க வினைகள்
ஆக்சிஜனேற்ற - ஒடுக்க வினைகள்
ஒரு ஆப்பிளை நறுக்கி வைத்த சிறிது நேரத்தில், அதன் நிறம் பழுப்பாக மாறும் இந்த நிறமாற்றத்திற்கான காரணம் உங்களுக்குத் தெரியுமா? ஆக்சிஜனேற்றம் என்றழைக்கப்படும் வேதிவினை நிகழ்வதே இதற்கான காரணமாக அமைகிறது. நம் அன்றாட வாழ்வில், இந்தகைய பல ஆக்சிஜனேற்ற வினைகள் நிகழ்வதை நாம் காண்கிறோம்.
எடுத்துக்காட்டாக,
1) LPG வாயு எரிதல், 2) இரும்பு துருப்பிடித்தல், 3) வாழும் உயிரினங்களில், கார்போஹைட்ரேட்டுகள் ஆக்சிஜனேற்றம் அடைந்து கார்பன் டைஆக்ஸைடு, நீர் மற்றும் ஆற்றலைத் தரும் வினைகள் போன்றவற்றைக் கூறலாம்.
ஆக்சிஜனேற்ற வினைகள் நிகழும் போதெல்லாம், ஆக்சிஜனொடுக்க வினைகளும் உடன் நிகழ்கின்றன எனவே இத்தகைய வினைகள் ஆக்சிஜனேற்ற - ஒடுக்க வினைகள் என அழைக்கப்படுகின்றன. ஆக்சிஜனை சேர்த்தல் அல்லது ஹைட்ரஜனை நீக்குதல் ஆக்சிஜனேற்றம் எனவும், ஹைட்ரஜனை சேர்த்தல் அல்லது ஆக்சிஜனை நீக்குதல் நிகழும் வினைகள் ஆக்சிஜனொடுக்க வினைகள் எனவும் முந்தைய மரபு கொள்கையின் அடிப்படையில் அழைக்கப்பட்டன.

படம் : 1.3 அன்றாட வாழ்வில் ஆக்ஸிஜனேற்ற வினைகள்
பின்வரும் இருவினைகளைக் கருதுக.
வினை 1 : 4 Fe + 3 O2 → 2 Fe2 O3
வினை 2 : H2S + Cl2 → 2 HCl + S
இந்த இருவினைகளும் ஆக்சிஜனேற்ற - வினைகளாகும்.
இரும்பு துருப்பிடித்தலுக்கு காரணமாக அமையும் முதலாவது வினையில் உலோக இரும்புடன் ஆக்சிஜன் சேர்கிறது. இரண்டாவது வினையில், ஹைட்ரஜன் சல்பைடிலிருந்து ஹைட்ரஜன் நீக்கப்படுகிறது. எந்த வினைபொருள் ஒடுக்கமடைகிறது என்பதைக் கண்டறிக?
பின்வரும் இரு வினைகளைக் கருதுக, இவற்றில் முறையே ஆக்சிஜன் நீக்கமும், ஹைட்ரஜன் சேர்க்கையும் நடைபெறுகிறது. இத்தகைய வினைகள் ஒடுக்க வினைகள் எனப்படும்.
CuO + C → Cu + CO (குப்ரிக் ஆக்ஸைடில் இருந்து ஆக்சிஜன் நீக்கம்)
S + H2 → H2S (சல்பருடன் ஹைட்ரஜன் சேர்க்கப்படுதல்).
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளில், ஹைட்ரஜனோ அல்லது ஆக்ஸிஜனோ எப்போதும் வினைப்பொருளாக இருப்பதில்லை. இது போன்ற நிகழ்வுகளில் எலக்ட்ரான்களின் அடிப்படையில் இவ்வினைகளை விளக்கலாம். எலக்ட்ரானை இழத்தல் ஆக்சிஜனேற்றம் எனவும், எலக்ட்ரானை ஏற்றுக் கொள்ளுதல் ஆக்சிஜனொடுக்கம் எனவும் அழைக்கப்படுகிறது.
எடுத்துக்காட்டு,
Fe2+ → Fe3+ + e- (எலக்ட்ரான் இழத்தல் - ஆக்சிஜனேற்றம்).
Cu2+ + 2e- → Cu (எலக்ட்ரான் ஏற்றுக் கொள்ளுதல் – ஆக்சிஜனொடுக்கம்)
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளை ஆக்சிஜனேற்ற எண்ணைப் பயன்படுத்தி நன்கு விளக்க முடியும்.
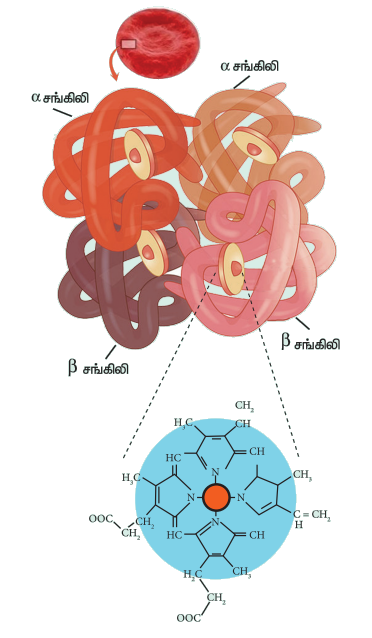
தங்களுக்குத் தெரியுமா?
ஹீமோகுளோபின் மற்றும் ஆக்சிஜன் கடத்தல்
காற்றில் சிறிதளவு ஆக்சிஜன் இருந்தாலும் அது இரும்பை துருப்பிடிக்கச் செய்கிறது அதாவது இரும்பானது Fe3+ ஆக ஆக்சிஜனேற்றமடைகிறது. ஆனால், நுரையீரலிலிருந்து ஆக்சிஜனை Fe2+ மூலம் பிணைத்து உடலின் அனைத்து திசுக்களுக்கும் ஆக்சிஜனை கொண்டு செல்லும் ஹீமோகுளோபினில் உள்ள Fe2+ துருபிடிப்பதில்லை இதற்கு காரணம் என்னவென்று தங்களுக்குத் தெரியுமா?
இதற்கான பதில், ஹிமோகுளோபினின் வடிவமைப்பில் உள்ளது. இதில் நான்கு துணை அலகுகள் உள்ளன. ஒவ்வொரு அலகும் பார்பைரின் வளையத்தை (ஹீம்) உள்ளடக்கியது. ஹீம் ஆனது புரோட்டீன் சங்கிலியுடன் (குளோபின்) இணைக்கப்பட்டுள்ளது. இந்த வடிவமைப்பானது Fe2+ஐ மையத்தில் கொண்ட எண்முகி வடிவமைப்பாகும். இதன் நான்கு நிலைகள் பார்பைரின் வளையத்துடனும், ஐந்தாவது நிலை ஹிஸ்டிடினின் இமிடசோல் வளையத்துடனும் இணைக்கப்பட்டுள்ளது. ஆறாவது நிலையானது ஆக்சிஜனை பிணைக்கப் பயன்படுகிறது. பொதுவாக, ஹீமில் உள்ள Fe2+ ஆனது எளிதில் ஆக்சிஜனேற்றம் அடையக்கூடியது. Fe2+ஐ சூழ்ந்துள்ள குளோபின் புரோட்டீன் சங்கிலியானது நீர் வெறுக்கும் சூழலைத் தருவதால், Fe2+ ஆச்சிஜனேற்றம் அடைவது கடினமானதாகிறது. எனினும் நாள்தோறும் 3% ஹீமோகுளோபின் மெத்திமோ குளோபினாக (ஹீமோகுளோபினில் உள்ள இரும்பு Fe3+ ஆக காணப்படுகிறது) ஆக்சிஜனேற்றம் அடைகிறது. மெத்திமோ குளோபின் ரிடெக்டேஸ் நொதி அதனை மீண்டும். ஹீமோகுளோபினாக ஒடுக்கமடைய செய்கிறது.
சயனைடு நச்சுத்தன்மை:
ஆக்சிஜன் ஹீமோகுளோபினுடன் மீள் முறையில் பிணைக்கப்படுகிறது. ஆனால் சயனைடு ஆனது மீளா முறையில் பிணைந்து ஹீமோகுளோபினுடன் ஆக்சிஜன் பிணைக்கப்படுதலை தடுக்கிறது. இதனால் நுரையீரலிலிருந்து, திசுக்களுக்கு, ஆக்சிஜன் கடத்தப்படுவது நிறுத்தப்படுகிறது. இதன் காரணமாக சயனைடு உட்கொண்டவர் விரைவாக மரணமடைகிறார்.
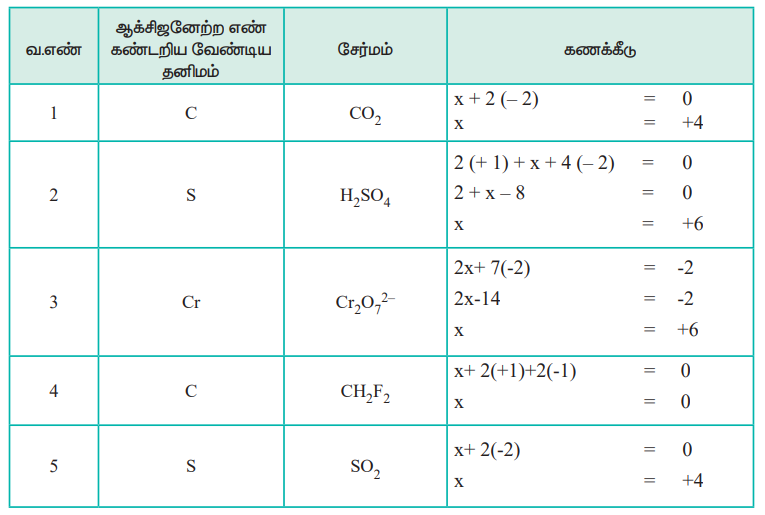
1. ஆக்சிஜனேற்ற எண்
ஒரு சேர்மத்தில் உள்ள ஒரு குறிப்பிட்ட அணுவின் ஆக்ஸிஜனேற்ற எண் என்பது, அவ்வணுவினைத் தவிர்த்து, பிற அணுக்களை, ஆக்சிஜனேற்ற எண்ணைக் கண்டறிவதற்கான விதிகளின்படி நிர்ணயம் செய்யப்பட்ட, அவற்றின் வழக்கமான ஆக்சிஜனேற்ற நிலையில், அயனிகளாக நீக்கிய பின்னர், அக்குறிப்பிட்ட அணுவின் மீது எஞ்சியிருப்பதாகக் கருதப்படும் கற்பனையான மின்சுமை என வரையறுக்கப்படுகிறது.
ஆக்சிஜனேற்ற எண்ணிற்கு மாற்றாக ஆக்சிஜனேற்ற நிலை என்ற வார்த்தையும் பயன்படுத்தப்படுகிறது.
ஆக்சிஜனேற்ற எண்ணைக் கண்டறிவதற்கான விதிகள்
1) ஒரு தனித்த தனிமத்தின் (அதாவது வேறெந்த தனிமத்துடனும் பிணைந்திருக்காத நிலையில்) ஆக்சிஜனேற்ற எண் பூஜ்யமாகும்.
எடுத்துக்காட்டு :
H2, Cl2, Na, S8 ஆகியனவற்றில் காணப்படும் அணுக்களின் ஆக்சிஜனேற்ற எண் பூஜ்யமாகும்.
2) ஓரணு அயனியின் ஆக்சிஜனேற்ற நிலை என்பது அந்த அயனியின் மீதுள்ள நிகர மின்சுமைக்குச் சமம்.
எடுத்துக்காட்டு :
Na+ அயனியில் உள்ள சோடியத்தின் ஆக்சிஜனேற்ற எண் +1 ஆகும்.
Cl- அயனியில் உள்ள குளோரினின் ஆக்சிஜனேற்ற எண் -1
3) ஒரு மூலக்கூறிலுள்ள அனைத்து அணுக்களின் ஆக்சிஜனேற்ற எண்களின் கூடுதல் பூஜ்யமாகும், அயனிகளைப் பொருத்தவரையில் இக்கூடுதலானது அயனியின் மீதுள்ள நிகர மின்சுமைக்குச் சமம்.
எடுத்துக்காட்டு :
H2SO4 ல், (2 × H - ன் ஆச்சிஜனேற்ற எண்) + (S - ன் ஆக்சிஜனேற்ற எண்) + (4 × ஆக்சிஜனின் ஆக்சிஜனேற்ற எண்) = 0
SO42- ல் (1 × S-ன் ஆக்சிஜனேற்ற எண்) + (4 × O-ன் ஆக்சிஜனேற்ற எண்) = -2
4) உலோக ஹைட்ரைடுகளைத் தவிர பிற அனைத்துச் சேர்மங்களிலும் ஹைட்ரஜனின் ஆக்சிஜனேற்ற எண் +1, உலோக ஹைட்ரைடுகளில் ஹைட்ரஜன் -1 ஆக்சிஜனேற்ற நிலையைக் கொண்டுள்ளது.
எடுத்துக்காட்டு :
ஹைட்ரஜன் குளோரைடில் (HCl), ஹைட்ரஜனின் ஆக்சிஜனேற்ற எண் +1
சோடியம் ஹைட்ரைடில் (NaH), ஹைட்ரஜனின் ஆக்சிஜனேற்ற எண் -1
5) அனைத்தச் சேர்மங்களிலும் புளூரினானது -1 ஆக்சிஜனேற்ற நிலையினைக் கொண்டுள்ளது.
6) பெரும்பாலான சேர்மங்களில் ஆக்சிஜன்-2 ஆக்சிஜனேற்ற நிலையினைப் பெற்றுள்ளது. பெராக்ஸைடுகள், சூப்பர் ஆக்ஸைடுகள், புளூரினின் சேர்மங்கள் ஆகியன இதற்கு விதிவிலக்காக அமைகின்றன.
எடுத்துக்காட்டுகள் :
ஆக்சிஜனின் ஆக்சிஜனேற்ற எண்
i) நீரில் (H2O) - 2 [ 2 (+1) + x = 0; x = -2 ]
ii) ஹைட்ரஜன் பெராக்ஸைடில் (H2O2)
H2O2
2 (+1) + 2x = 0;
⇒ 2x = −2 ;
⇒ x = -1
iii) KO2 போன்ற சூப்பர் ஆக்ஸைடுகளில்
- (1/2)
+1 + 2x = 0;
2x = − 1 ; x = - (1/2)
iv) ஆக்சிஜன் டைபுளூரைடில் (OF2) + 2.
x + 2 (-1) = 0; x = + 2
7) அனைத்துச் சேர்மங்களிலும், கார உலோகங்கள் +1 ஆக்சிஜனேற்ற நிலையினையும், காரமண் உலோகங்கள் +2 ஆக்சிஜனேற்ற நிலையினையும் பெற்றுள்ளன.
மேற்க்கண்டுள்ள விதிகளைப் பயன்படுத்தி ஆக்சிஜனேற்ற எண்ணைக் கணக்கிடுதல்
ஆக்சிஜனேற்ற எண் அடிப்படையில் ஆக்சிஜனேற்ற - ஒடுக்க வினைகள்.
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் போது, தனிமங்களின் ஆக்சிஜனேற்ற எண் மாற்றமடைகிறது. ஒருவினையில் ஒரு தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரிக்குமாயின் அவ்வினை ஆக்சிஜனேற்ற வினை எனப்படும். ஆக்சிஜனேற்ற எண் குறையுமாயின் அவ்வினை ஆக்சிஜன் ஒடுக்க வினை எனப்படும்.
பின்வரும் வினையினைக் கருதுக.
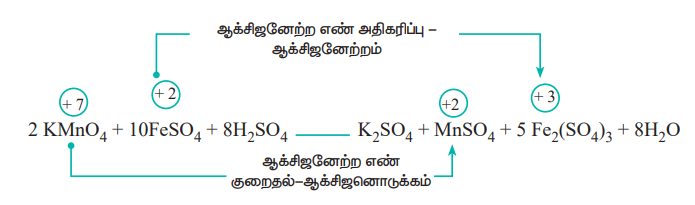
இவ்வினையில், பொட்டாசியம் பெர்மாங்கனேட்டில் (KMnO4) உள்ள மாங்கனீஸ் (Mn), பெர்ரஸ் சல்பேட்டை, (FeSO4) பெர்ரிக் சல்பேட்டாக (Fe2(SO4)3) ஆக்சிஜனேற்றம் அடையச் செய்வதற்கு காரணமாக அமைகிறது. இவ்வினையில் மாங்கனீஸ் ஐந்து எலக்ட்ரான்களை ஏற்றுக் கொண்டு ஒடுக்கமடைகிறது. இத்தகைய வினைப்பொருட்கள் ஆக்சிஜனேற்றிகள் என அழைக்கப்படுகின்றன. இதைப்போலவே, எலக்ட்ரான்களை இழந்து ஆக்சிஜன் ஒடுக்கத்திற்கு துணை புரியும் வினைப்பொருட்கள் ஆக்சிஜன் ஓடுக்கிகள் என அழைக்கப்படுகின்றன.
2. ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் வகைகள்
ஆக்சிஜனேற்ற – ஒடுக்க வினைகளை பின்வருமாறு வகைப்படுத்தலாம்.
1. இணையும் வினைகள்: (Combination reactions) :
இரண்டு வினைப் பொருட்கள் வினைபுரிந்து ஒரு சேர்மத்தினைத் தரும் ஆக்சிஜனேற்ற - ஒடுக்கவினைகள், இணையும் வினைகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டு:
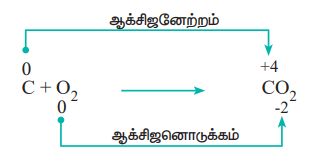
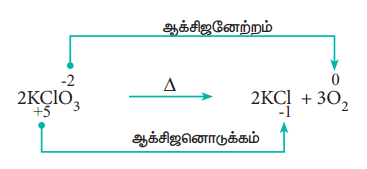
2. சிதைவடையும் வினைகள் : (Decomposition reactions)
ஒரு சேர்மம், இரண்டு அல்லது அதற்கு மேற்பட்ட கூறுகளாக சிதைவடையும், ஆக்சிஜனேற்ற ஒடுக்க வினைகள் சிதைவடையும் வினைகள் என அழைக்கப்படுகின்றன. இவ்வினைகள் இணையும் வினைகளுக்கு நேர்மாறானவை. இவ்வகை வினைகளில், ஒரு சேர்மத்தில் உள்ள இரண்டு வெவ்வேறான தனிமங்களின் ஆக்சிஜனேற்ற எண்களில் மாற்றம் ஏற்படுகிறது.
எடுத்துக்காட்டு:
3. இடப்பெயர்ச்சி வினைகள் (Displacement reactions)
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் போது, ஒரு சேர்மத்தில் உள்ள ஒரு அணு அல்லது அயனி மற்றொரு அணு அல்லது அயனியால் பதிலீடு செய்யப்பட்டால் அத்தகைய வினைகள் இடப்பெயர்ச்சி வினைகள் எனப்படுகின்றன. இவ்வினைகளை மேலும்
i) உலோக இடப்பெயர்ச்சி வினைகள்
ii) அலோக இடப்பெயர்ச்சி வினைகள் என வகைப்படுத்தலாம்.
(i) உலோக இடப்பெயர்ச்சி வினைகள்:
ஒரு கண்ணாடி கலனில் நீர்த்த தாமிர சல்பேட் (Copper Sulphate) கரைசலை எடுத்துக் கொண்டு, அதில் துத்தநாக (Zinc) உலோக தகட்டினை வைக்கவும். கரைசலை உற்று நோக்கவும். கரைசலின் அடர் நீல நிறத்தின் செறிவு மெதுவாக குறையத்துவங்கும். இறுதியில் நிறம் முற்றிலும் மறைந்துவிடும். துத்தநாக உலோகத் தகட்டின் மீது பழுப்பு நிற தாமிர உலோகம் படிந்திருப்பதைக் காணலாம். இந்நிகழ்வு நடைபெற பின்வரும் உலோக இடப்பெயர்ச்சி வினை காரணமாக அமைகிறது.

ii) அலோக இடப்பெயர்ச்சி வினைகள்:
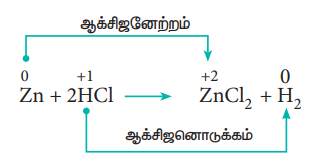
நீர்த்த HCl கரைசலுடன் துத்தநாக துகள்களை சேர்க்கும்போது HCl ல் இருந்து துத்தநாகம் ஹைட்ரஜனை இடப்பெயர்ச்சி செய்கிறது.
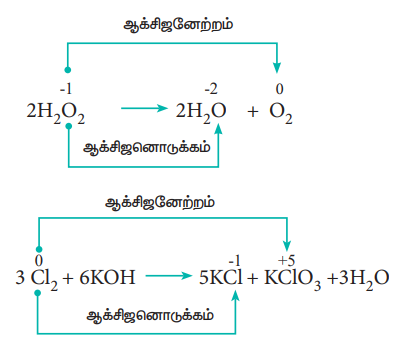
4. விகிதச்சிதைவு வினைகள் (Disproportionation reactions)
சில ஆக்சிஜனேற்ற – ஒடுக்க வினைகளில், ஒரே சேர்மம், ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜனொடுக்கம் இரண்டிற்கும் உட்படுகிறது. இத்தகைய வினைகளில், ஒரே தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரிக்கவும், குறையவும் செய்கிறது. இத்தகைய வினைகள் விகிதச்சிதைவு வினைகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டு :
5. எலக்ட்ரான் பரிமாற்றத் திறன் வினைகள் (Competitive electron transfer reactions)
தாமிர சல்பேட் கரைசலிலிருந்து, தாமிரத்தை, துத்தநாகம் இடப்பெயர்ச்சி செய்வதை உலோக இடப்பெயர்ச்சி வினைகளில் நாம் கற்றறிந்தோம். இதன் எதிர்வினை நிகழ வாய்ப்புள்ளதா? என்பதை நாம் சோதித்து அறிவோம். முன்னரே விளக்கிய செயல்முறைப்படி, துத்தநாக சல்பேட் கரைசலை ஒரு கலனில் எடுத்துக் கொண்டு, தாமிர தகட்டினை அக்கரைசலில் வைக்கவும். தாமிரமானது, துத்தநாக சல்பேட் கரைசலிலிருந்து, துத்தநாகத்தை இடப்பெயர்ச்சி செய்திருக்குமாயின், Cu2+ அயனிகள் கரைசலில் இருந்திருக்க வேண்டும். இதன் விளைவாக கரைசல் நீல நிறமாக மாற்றமடைந்திருக்க வேண்டும். ஆனால், இத்தகைய மாற்றங்கள் ஏதும் நிகழ்வதில்லை. எனவே, தாமிரம் மற்றும் துத்தநாகம் ஆகிய இரண்டினையும் ஒப்பிடும்போது, துத்தநாகமானது எலக்ட்ரானை இழக்கும் தன்மையினையும், தாமிரமானது எலக்ட்ரானை ஏற்கும் தன்மையினையும் பெற்றுள்ளது என்று நாம் முடிவு செய்யலாம்.
மேற்கண்டுள்ளவாறு வெள்ளி நைட்ரேட் (Silver Nitrate) கரைசலில், தாமிர தகட்டினை வைத்து வினை ஏதேனும் நிகழ்கிறதா என பார்ப்போம். சிறிது நேரம் கழித்த பின்னர், கரைசல் மெதுவாக நீல நிறமாக மாறத்துவங்கும். Cu2+ அயனிகள் உருவாவதே இதற்கு காரணமாகும்.
அதாவது, வெள்ளி நைட்ரேட் கரைசலில் உள்ள வெள்ளியை, தாமிரம் இடப்பெயர்ச்சி செய்கிறது.
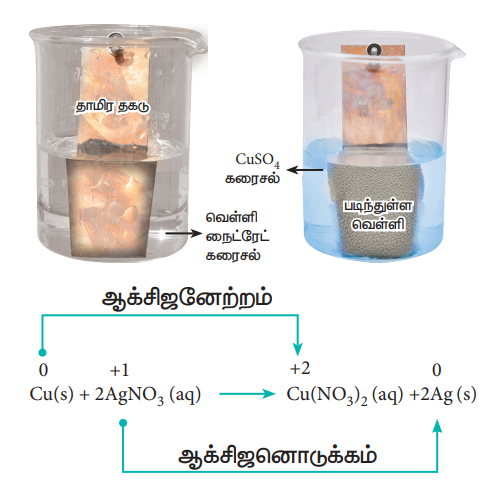
தாமிரம் மற்றும் வெள்ளி ஆகியவற்றிக்கு இடையே வினைத்திறனை ஒப்பிடும்போது, தாமிரம் எலக்ட்ரானை இழக்கும் தன்மையினையும், வெள்ளி எலக்ட்ரானை ஏற்கும் தன்மையினையும் பெற்றுள்ளதை மேற்கண்டுள்ள வினை உணர்த்துகிறது.
மேற்கண்டுள்ள சோதனை முடிவுகளிலிருந்து, துத்தநாகம், தாமிரம் மற்றும் வெள்ளி ஆகிய உலோகங்களுக்கிடையே ஒப்பிடும் போது எலக்ட்ரானை வெளியிடும் திறன் பின்வரும் வரிசையில் அமைந்துள்ளது என நாம் முடிவு செய்யலாம்.
துத்தநாகம் > தாமிரம் > வெள்ளி
உலோகங்களுக்கு இடையேயான, எலக்ட்ரான்களை பெறுவதில் உள்ள மேற்கண்டுள்ள தன்மையானது, கால்வானிக் மின் கலன்களை வடிவமைப்பதில் நமக்கு பயனுள்ளதாக உள்ளது. கால்வானிக் மின்கலன்களைப் பற்றி XII ம் வகுப்பில் விரிவாக கற்போம்.
3. ஆக்சிஜனேற்ற – ஒடுக்க வினைக்கான சமன்பாடுகளை சமன் செய்தல்:
ஆக்சிஜனேற்ற - ஒடுக்க வினைக்கான வேதிச் சமன்பாடுகளை சமன் செய்யும் இருமுறைகள் பின்வருமாறு.
i) ஆக்சிஜனேற்ற எண் முறை
ii) அயனி - எலக்ட்ரான் முறை / அரை வினை முறை
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளில், ஆக்சிஜனொடுக்கியால் இழக்கப்படும் எலக்ட்ரான்களின் மொத்த எண்ணிக்கை, ஆக்சிஜனேற்றியால் ஏற்றுக் கொள்ளப்படும் எலக்ட்ரான்களின் மொத்த எண்ணிக்கைக்கு சமமாகும். மேற்கண்டுள்ள இரு முறைகளும் இத்தத்துவத்தின் அடிப்படையில் அமைந்து உள்ளன.
ஆக்சிஜனேற்ற எண் முறை:
இம்முறையில், வினைபுரிவதற்கு முன்னரும், வினை நிகழ்ந்த பிறகும், தனிமங்களின் ஆக்சிஜனேற்ற எண் கண்டறியப்படுகிறது. இதன் மூலம் வினையில், ஏற்றுக்கொள்ளப்பட்ட அல்லது இழந்த எலக்ட்ரான்களின் எண்ணிக்கையினை கணக்கிடலாம். அமில ஊடகத்தில் பொட்டாசியம் பெர்மாங்கனேட்டால் பெர்ரஸ்சல்பேட் ஆக்சிஜனேற்றம் அடையும் வினையினைக் கருதுவோம். இவ்வினைக்கான சமன் செய்யப்படாத சமன்பாடு,
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
படி: 1
ஆக்சிஜனேற்ற எண்ணைப் பயன்படுத்தி, ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜனொடுக்கம் அடையும் வினைபொருட்களை (அணுக்கள்) கண்டறிக.
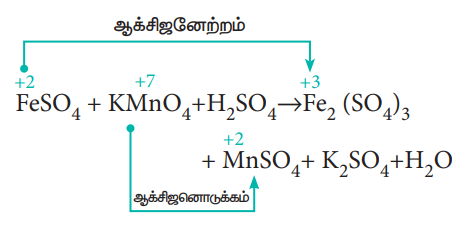
a) ஐந்து எலக்ட்ரான்களை ஏற்பதால், KMnO4 ல் உள்ள Mn ன் ஆக்சிஜனேற்ற எண் +7லிருந்து +2 ஆகக், குறைகிறது.
b) ஒரு எலக்ட்ரானை இழப்பதால், FeSO4 ல் உள்ள Fe ன் ஆக்சிஜனேற்ற எண் +2லிருந்து +3ஆகக் அதிகரிக்கிறது.
படி: 2
ஏற்கப்படும் எலட்ரான்களின் எண்ணிக்கை, இழக்கப்படும் எலக்ட்ரான்களின் எண்ணிக்கைக்குச் சமம் என்பதால், பின்வருமாறு தொடர்புடைய சேர்மத்தின் வாய்ப்பாட்டினை தகுந்த எண்ணால் குறுக்கு பெருக்கம் செய்து எலக்ட்ரான்களை சமப்படுத்துக. வினைவிளைபொருள் Fe2 (SO4)3 ஆனது இரு மோல் இரும்பைக் கொண்டுள்ளதால், 1e- மற்றும் 5e- களை இரண்டால் பெருக்கவும்
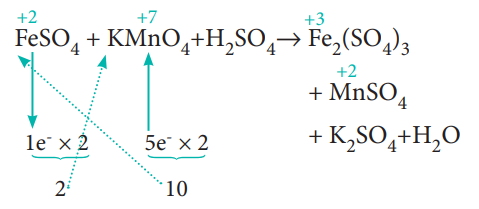
10 FeSO4 + 2 KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
படி: 3
ஆக்சிஜனேற்றம் / ஆக்சிஜனொடுக்கம் அடைந்த / வினைவிளைபொருளை சமன் செய்தல்.
குறுக்கு பெருக்கம் செய்த பின், வினைபடு பொருட்களின் அடிப்படையில் வினைவிளை பொருளை (ஆக்சிஜனேற்றம் / ஆக்சிஜனொடுக்கம் அடைந்தவை) சமன் செய்யவும். மேற்கண்டுள்ள சமன்பாடு பின்வருமாறு மாற்றமடைகிறது.
10 FeSO4 + 2 KMnO4 + H2SO4 → 5 Fe2 (SO4)3 + 2 MnSO4 + K2SO4 + H2O
படி: 4
H மற்றும் O வைத் தவிர்த்து பிற தனிமங்களை சமன் செய்க. இந்த தேர்வில், நாம் K மற்றும் S ஐ சமன் செய்ய வேண்டும். ஆனால் K மேற்கண்டுள்ளவாறு தானாகவே சமன் செய்யப்பட்டுள்ளது.
வினைபடு பொருள் : 10 'S' அணுக்கள் (10 FeSO4)
வினைவிளை பொருள்: 18 'S' அணுக்கள்
5 Fe2 (SO4)3 + 2 MnSO4 + K2SO4
15S + 2S + 1S = 18S
எனவே, வினைபடு பொருள் பகுதியில் 8-S அணுக்கள் குறைவாக உள்ளது. எனவே, H2SO4 ஐ '8' ஆல் பெருக்குக.
10 FeSO4 + 2 KMnO4 + 8 H2SO4 → 5 Fe2(SO4)3 + 2 MnSO4 + K2SO4 + H2O
படி : 5
'H' மற்றும் 'O' அணுக்களை சமன் செய்தல்.
வினைபடு பொருள் பகுதி '16' - H அணுக்கள் (8 H2SO4 i.e. 8 × 2H = 16 'H')
வினைவிளை பொருள் பகுதி '2' - H அணுக்கள் (H2O i.e. 1 × 2H = 2 'H')
எனவே விளைபொருள் H2O வை '8' ஆல் பெருக்கு
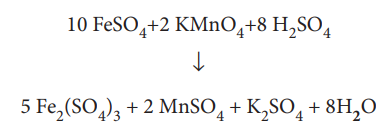
ஆக்சிஜன் அணு தானாகவே சமன் செய்யப்பட்டுவிட்டது. இதுவே சமன்படுத்தப்பட்ட சமன்பாடாகும்.
அயனி - எலக்ட்ரான் முறை
அயனிகள் இடம்பெறும் ஆக்சிஜனேற்ற - ஒடுக்க வினைகளுக்கு இம்முறை பயன்படுத்தப்படுகிறது.
படி : 1
ஆக்சிஜனேற்ற எண் கோட்பாட்டினைப் பயன்படுத்தி, ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜன் ஒடுக்கம் அடையும் வினைப் பொருட்களைக் கண்டறிக.
படி : 2
ஆக்சிஜனேற்றம் மற்றும் ஒடுக்கத்திற்கு, தனித்தனியே இரு அரைவினைகளை எழுதுக.
ஆக்சிஜனேற்ற எண் முறையினைப் பயன்படுத்தி சமன் செய்ய எடுத்துக்கொண்ட அதே வினையைக் கருதுவோம்.
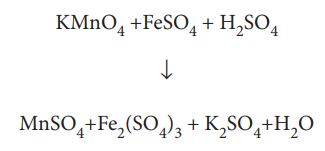
இவ்வினையின் அயனி வடிவம்
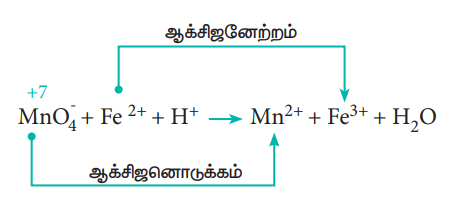
இரு அரைவினைகள் முறையே
Fe2+ → Fe3+ + 1e- -------------------- (1)
மற்றும்
MnO-4 + 5e- → Mn2+ -------------------- (2)
அரைவினைகளின் இருபுறமும் அணுக்கள் மற்றும் மின் சுமையினை சமன் செய்க.
சமன்பாடு (1) மாற்றம் ஏதுமில்லை
Fe2+ → Fe3+ + 1e- -------------------- (1)
சமன்பாடு 2) ⇒ வினைபடுபொருள் பகுதியில் 4'O' உள்ளது.
எனவே, விளைபொருள் பகுதியில் 4H2O சேர்க்கவும். 'H' ஐ சமன் செய்ய, வினைபடுபொருள் பகுதியில் 8H+ சேர்க்கவும்.
MnO-4 + 5e- + 8H+ → Mn2+ + 4H2O ---- (3)
படி : 3
இழந்த எலக்ட்ரான்களின் எண்ணிக்கையும், ஏற்றுக் கொள்ளப்பட்ட எலக்ட்ரான்களின் எண்ணிக்கையும் சமமாகுமாறு, இரு அரைவினைகளையும் சமப்படுத்துக.
பின்னர், இரு அரைவினைகளையும் கூட்டுவதால் சமன்படுத்தப்பட்ட சமன்பாடு (6) கிடைக்கிறது
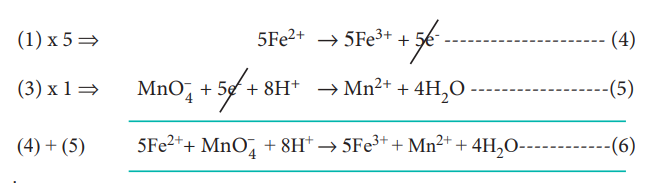
தன் மதிப்பீடு
8. ஆக்சிஜனேற்ற எண்ணைப் பயன்படுத்தி பின்வரும் சமன்பாட்டினை சமன் செய்க.
As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO
தீர்வு
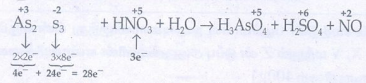
வினைபடு பொருள் உள்ள பகுதியில் எலக்ட்ரான்களின் எண்ணிக்கையை சமன்படுத்துக.
⇒ 3As2S3 + 28HNO3 + H2O → H3AsO4 + H2SO4 + NO
வினைபடு பொருட்களுள்ள பகுதியின் அடிப்படையில் வினைவிளை பொருளை சமன்படுத்துக.
⇒ 3As2S3 + 28HNO3 + H2O → 6H3AsO4 + 9H2SO4 + 28NO
வினைவிளை பொருள் பகுதி : 36 ஹைட்ரஜன் அணுக்கள் & 88 ஆக்ஸிஜன் அணுக்கள்
வினைபடு பொருள் பகுதி : 28 ஹைட்ரஜன் அணுக்கள் & 74 ஆக்ஸிஜன் அணுக்கள்
வேறுபாடானது 8 ஹைட்ரஜன் அணுக்கள் & 14 ஆக்ஸிஜன் அணுக்கள்
ஃ வினைபடு பொருள் பகுதியிலுள்ள H2O மூலக்கூறை '4' ஆல் பெருக்குக. சமன்படுத்தப்பட்ட சமன்பாடானது,
3As2S3 + 28HNO3 + 4H2O → 6H3AsO4 + 9H2SO4 + 28NO