11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
வேதிவினைக் கூறுவிகிதக் கணக்கீடுகள்
1. வேதிவினைக் கூறுவிகிதக் கணக்கீடுகள்
ஒரு சமன்படுத்தப்பட்ட வேதிச் சமன்பாட்டில், வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்கள் ஆகியவற்றிற்கு இடையேயான 'மோல்' எண்ணிக்கை தொடர்பினை வேதி வினைக்கூறு விகிதம் என்கிறோம். வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்களின் அளவினை மோல் அல்லது நிறை அல்லது கன அளவின் அடிப்படையில் குறிப்பிடலாம். இம்மூன்று அலகுகளையும் ஒன்றிலிருந்து மற்றொன்றிற்கு மாற்ற முடியும்.
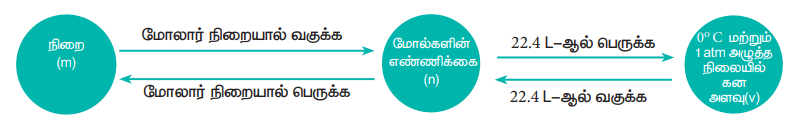
மீத்தேனின் எரிதல் வினையினை கருத்திற் கொண்டு, இந்த மாற்றங்களை நாம் விளக்க முடியும்,
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
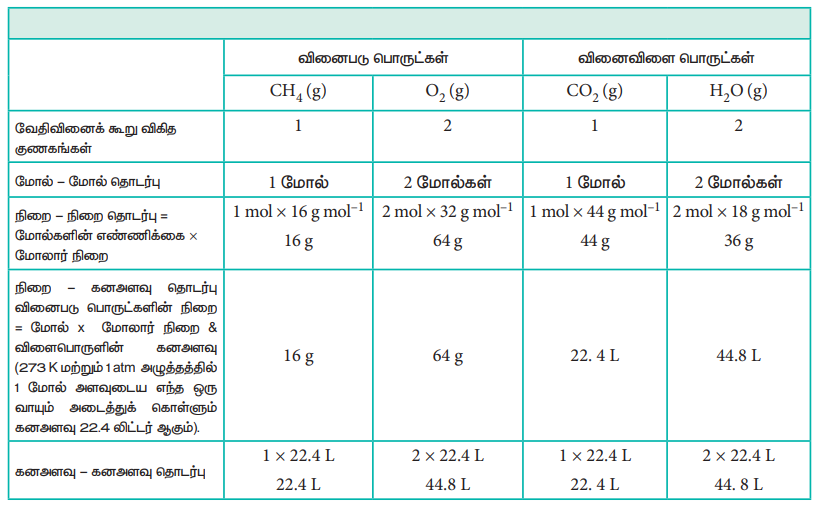
வேதிவினைக் கூறு விகித அடிப்படையிலான கணக்கீடுகள்
1. 10 மோல் அம்மோனியாவை உருவாக்க எத்தனை மோல் ஹைட்ரஜன் தேவை?
அம்மோனியா உருவாதலுக்கான சமன்படுத்தப்பட்ட சமன்பாடு
N2 (g) + 3 H2 (g) → 2 NH3 (g)
மேற்கண்டுள்ள சமன்படுத்தப்பட்ட சமன்பாட்டின் அடிப்படையில்,
2 மோல் அம்மோனியாவை உருவாக்க 3 மோல் ஹைட்ரஜன் தேவைப்படுகிறது.
ஃ 10 மோல் அம்மோனியாவை உருவாக்க.
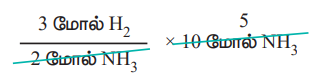
= 15 மோல் ஹைட்ரஜன் தேவை.
2. 32 g மீத்தேன் எரிக்கப்படும் போது உருவாகும் நீரின் அளவினைக் கணக்கிடுக.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
சமன்படுத்தப்பட்ட சமன்பாட்டின் அடிப்படையில், 1 மோல் (16 g) CH4 எரிதலின் போது 2 மோல் (2 × 18 = 36g) நீரினைத் தருகிறது.
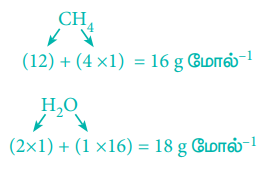
ஃ 32 g மீத்தேன் எரிதலின் போது
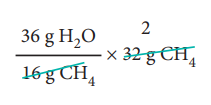
= 72 g நீரைத் தருகிறது
3. திட்ட வெப்ப அழுத்த நிலைகளில் 50 g கால்சியம் கார்பனேட்டை முற்றிலுமாக எரிப்பதால் உருவாகும் கார்பன் டைஆக்ஸைடின் கனஅளவு எவ்வளவு?
சமன்படுத்தப்பட்ட சமன்பாடு
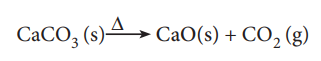
மேற்கண்டுள்ள சமன்பாட்டின்படி
1 மோல் (100g) CaCO3 ஐ வெப்பப்படுத்தும் போது 1 மோல் CO2 உருவாகிறது.
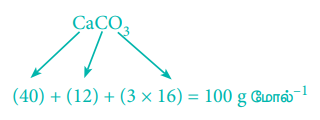
திட்ட வெப்ப அழுத்த நிலைகளில், 1 மோல் CO2 ஆனது 22.7 லிட்டர் கனஅளவை அடைத்துக் கொள்ளும்.
ஃ திட்ட வெப்ப அழுத்த நிலைகளில், 50 g CaCO3 ஐ வெப்பப்படுத்தும் போது
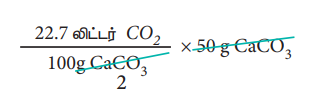
= 11.35 லிட்டர் of CO2 வைத் தருகிறது
4. 273 K மற்றும் 1 atm அழுத்தத்தில், 11.2 L லிட்டர் HCl ஐ உருவாக்கத் தேவையான குளோரினின் கன அளவைக் கண்டறிக.
HCl உருவாவதற்கான சமன்படுத்தப்பட்ட சமன்பாடு,
H2 (g) + Cl2 (g) → 2 HCl (g)
கொடுக்கப்பட்ட வெப்ப அழுத்த நிலையில்,
2 மோல் HCl ஐ உருவாக்க, 1 மோல் குளோரின் வாயு தேவைப்படுகிறது.
அதாவது 44.8 லிட்டர் HCl ஐ உருவாக்க, 22.4 லிட்டர் குளோரின் வாயு தேவைப்படுகிறது.
ஃ 11.2 லிட்டர் HCl ஐ உருவாக்க,
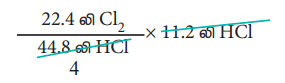
= 5.6 லிட்டர் குளோரின் வாயு தேவைப்படும்.
5. மெக்னீசியம் கார்பனேட்டில் அடங்கியுள்ள தனிமங்களின் சதவீத இயைபினைக் கண்டறிக. 90% தூய்மையான 1kg MgCO3 ஐ வெப்பப்படுத்தும் போது உருவாகும் CO2 ன் நிறையை கிலோகிராமில் கணக்கிடுக.
சமன்படுத்தப்பட்ட சமன்பாடு
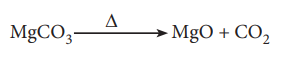
MgCO3 ன் மோலார் நிறை = 84 g mol-1.
84g MgCO3 ல் 24g மெக்னீசியம் உள்ளது
ஃ 100g MgCO3 ல்
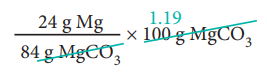
= 28.57 g Mg மெக்னீசியம் உள்ளது
அதாவது மெக்னீசியத்தின் சதவீதம் = 28.57 %.
84g MgCO3 ல் 12g கார்பன் உள்ளது
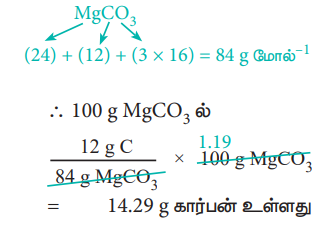
= 14.29g கார்பன் உள்ளது
ஃ கார்பனின் சதவீதம் = 14.29 %.
84g MgCO3 ல் 48g ஆக்சிஜன் உள்ளது
ஃ 100g MgCO3 ல்
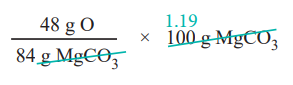
= 57.14g ஆக்சிஜன் உள்ளது
ஃ ஆக்சிஜனின் சதவீதம் = 57.14 %
சமன்படுத்தப்பட்ட சமன்பாட்டின் படி,
100 % தூய்மையான 84 g MgCO3 ஆனது வெப்பப்படுத்தும் போது 44g CO2 ஐத் தருகிறது.
ஃ 90 % தூய்மையான 1000 g MgCO3 ஐ வெப்பப்படுத்தும் போது
= [44 g / (84 g × 100%)] × 90 % × 1000 g
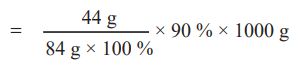
= 471.43 g CO2 ஐ தருகிறது.
= 0.471 kg CO2 உருவாகிறது