கணக்கீடுகள், எடுத்துக்காட்டு கணக்குகள், வினைக்கட்டுப்பாட்டுக் காரணி - வேதி வினைக் கூறுகளின் விகிதம் (stoichiometry) | 11th Chemistry : UNIT 1 : Basic Concepts of Chemistry and Chemical Calculations
11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
வேதி வினைக் கூறுகளின் விகிதம் (stoichiometry)
வேதி வினைக் கூறுகளின் விகிதம் (stoichiometry)
உனது வீட்டில் கேசரி தயார் செய்வதை நீ எப்போதாவது பார்த்திருக்கிறாயா? கேசரி தயாரிப்பதில் உள்ள முறைகளில், ஒரு முறையினைப் பயன்படுத்தி ஆறு கப் கேசரி தயாரிக்கத் தேவையான பொருட்களின் விவரம் பின்வருமாறு:
1) ரவை - 1 கப்
2) சர்க்கரை - 2 கப்
3) நெய் - 1/2 கப்
4) உலர் பழங்கள் மற்றும் பருப்புகள் – 1/4 கப்
அதாவது,
1 கப் ரவை + 2 கப் சர்க்கரை + 1/2 கப் நெய் + 1/4 கப் உலர் பழங்கள் மற்றும் பருப்புகள் = 6 கப் கேசரி
மேற்கண்டுள்ள விவரங்களிலிருந்து, 3 கப் கேசரி தயாரிப்பதற்கு தேவையான பொருட்களை நம்மால் பின்வருமாறு கணக்கிட இயலும்,
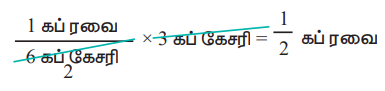
மாற்றாக, 3 கப் ரவையைக் கொண்டு தயார் செய்ய இயலும் கேசரியின் அளவினை பின்வருமாறு கணக்கிடலாம்.
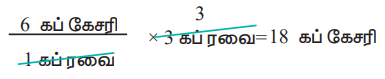
இதைப் போலவே தேவையான மற்ற பொருட்களின் அளவினையும் நம்மால் கண்டறிய இயலும்.

இந்தக் கணக்கீட்டு முறையினை, ஒரு வேதிவினையின், வேதிவினைக் கூறுகளின் விகிதங்களைக் கண்டறிய நாம் பயன்படுத்தலாம். கிரேக்க மொழியில், stoicheion என்பதற்கு தனிமம் எனவும் metron என்பதற்கு அளவீடு என்றும் பொருள் அதாவது வேதிவினைக் கூறுகளின் விகிதமானது ஒரு சமன்படுத்தப்பட்ட வேதிச் சமன்பாட்டில், வேதி வினைப் பொருட்களுக்கு இடையேயான எண்ணியல் தொடர்பினைத் தருகிறது.
வேதி வினைக்கூறு விகித கோட்பாட்டினைப் பயன்படுத்தி,
ஒரு குறிப்பிட்ட அளவு வினைவிளை பொருளை பெறத் தேவையான வினைபடுபொருளின் அளவையோ அல்லது வினைபடு பொருளின் அளவினைக் கொண்டு வினையில் உருவாகும் விளைபொருளின் அளவையோ அவ்வினைக்கான சமன்படுத்தப்பட்ட சமன்பாட்டின் மூலம் நம்மால் கணக்கிட முடியும். பின்வரும் வேதிவினையினை நாம் கருதுவோம்
C(s) + O2 (g) → CO2 (g)
இந்தச் சமன்பாட்டிலிருந்து 1 மோல் கார்பன், 1 மோல் ஆக்சிஜன் மூலக்கூறுடன் வினைபுரிந்து 1 மோல் கார்பன் டை ஆக்ஸைடைத் தருகிறது என்பதை நாம் அறிந்து கொள்கிறோம்.
1 மோல் C ≡ 1 மோல் O2 ≡ 1 மோல் CO2
'≡' என்ற குறியீடு, 'வேதிவினைக்கூறு விகித அடிப்படையில் சமம்' என்பதனைக் குறிப்பிடுகிறது.
1. வேதிவினைக் கூறுவிகிதக் கணக்கீடுகள்
ஒரு சமன்படுத்தப்பட்ட வேதிச் சமன்பாட்டில், வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்கள் ஆகியவற்றிற்கு இடையேயான 'மோல்' எண்ணிக்கை தொடர்பினை வேதி வினைக்கூறு விகிதம் என்கிறோம். வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்களின் அளவினை மோல் அல்லது நிறை அல்லது கன அளவின் அடிப்படையில் குறிப்பிடலாம். இம்மூன்று அலகுகளையும் ஒன்றிலிருந்து மற்றொன்றிற்கு மாற்ற முடியும்.
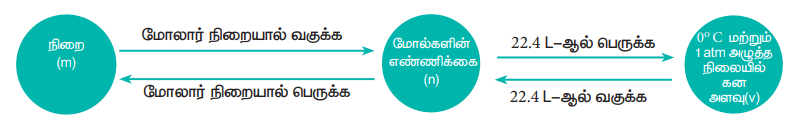
மீத்தேனின் எரிதல் வினையினை கருத்திற் கொண்டு, இந்த மாற்றங்களை நாம் விளக்க முடியும்,
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
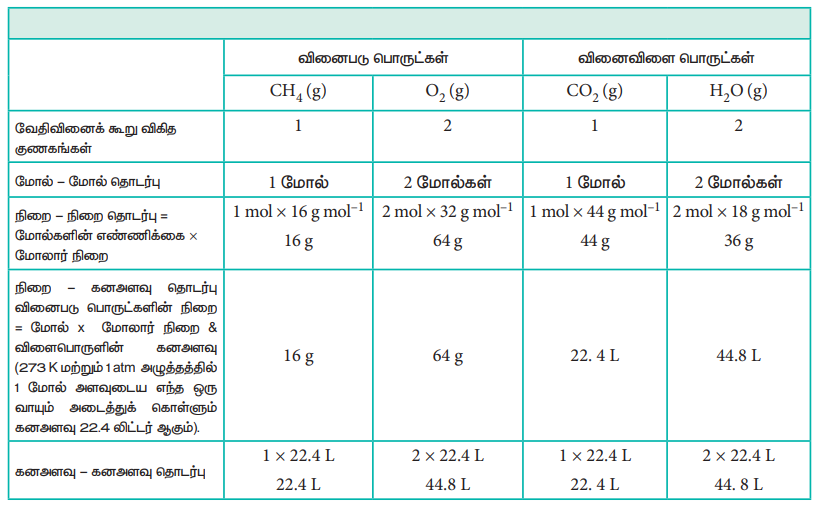
வேதிவினைக் கூறு விகித அடிப்படையிலான கணக்கீடுகள்
1. 10 மோல் அம்மோனியாவை உருவாக்க எத்தனை மோல் ஹைட்ரஜன் தேவை?
அம்மோனியா உருவாதலுக்கான சமன்படுத்தப்பட்ட சமன்பாடு
N2 (g) + 3 H2 (g) → 2 NH3 (g)
மேற்கண்டுள்ள சமன்படுத்தப்பட்ட சமன்பாட்டின் அடிப்படையில்,
2 மோல் அம்மோனியாவை உருவாக்க 3 மோல் ஹைட்ரஜன் தேவைப்படுகிறது.
ஃ 10 மோல் அம்மோனியாவை உருவாக்க.
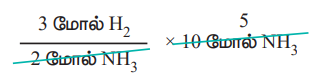
= 15 மோல் ஹைட்ரஜன் தேவை.
2. 32 g மீத்தேன் எரிக்கப்படும் போது உருவாகும் நீரின் அளவினைக் கணக்கிடுக.
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
சமன்படுத்தப்பட்ட சமன்பாட்டின் அடிப்படையில், 1 மோல் (16 g) CH4 எரிதலின் போது 2 மோல் (2 × 18 = 36g) நீரினைத் தருகிறது.
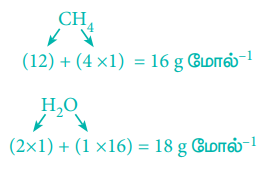
ஃ 32 g மீத்தேன் எரிதலின் போது
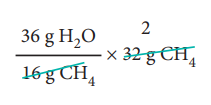
= 72 g நீரைத் தருகிறது
3. திட்ட வெப்ப அழுத்த நிலைகளில் 50 g கால்சியம் கார்பனேட்டை முற்றிலுமாக எரிப்பதால் உருவாகும் கார்பன் டைஆக்ஸைடின் கனஅளவு எவ்வளவு?
சமன்படுத்தப்பட்ட சமன்பாடு
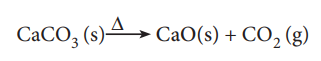
மேற்கண்டுள்ள சமன்பாட்டின்படி
1 மோல் (100g) CaCO3 ஐ வெப்பப்படுத்தும் போது 1 மோல் CO2 உருவாகிறது.
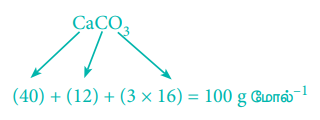
திட்ட வெப்ப அழுத்த நிலைகளில், 1 மோல் CO2 ஆனது 22.7 லிட்டர் கனஅளவை அடைத்துக் கொள்ளும்.
ஃ திட்ட வெப்ப அழுத்த நிலைகளில், 50 g CaCO3 ஐ வெப்பப்படுத்தும் போது
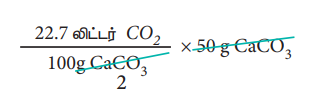
= 11.35 லிட்டர் of CO2 வைத் தருகிறது
4. 273 K மற்றும் 1 atm அழுத்தத்தில், 11.2 L லிட்டர் HCl ஐ உருவாக்கத் தேவையான குளோரினின் கன அளவைக் கண்டறிக.
HCl உருவாவதற்கான சமன்படுத்தப்பட்ட சமன்பாடு,
H2 (g) + Cl2 (g) → 2 HCl (g)
கொடுக்கப்பட்ட வெப்ப அழுத்த நிலையில்,
2 மோல் HCl ஐ உருவாக்க, 1 மோல் குளோரின் வாயு தேவைப்படுகிறது.
அதாவது 44.8 லிட்டர் HCl ஐ உருவாக்க, 22.4 லிட்டர் குளோரின் வாயு தேவைப்படுகிறது.
ஃ 11.2 லிட்டர் HCl ஐ உருவாக்க,
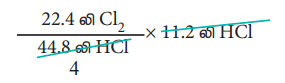
= 5.6 லிட்டர் குளோரின் வாயு தேவைப்படும்.
5. மெக்னீசியம் கார்பனேட்டில் அடங்கியுள்ள தனிமங்களின் சதவீத இயைபினைக் கண்டறிக. 90% தூய்மையான 1kg MgCO3 ஐ வெப்பப்படுத்தும் போது உருவாகும் CO2 ன் நிறையை கிலோகிராமில் கணக்கிடுக.
சமன்படுத்தப்பட்ட சமன்பாடு
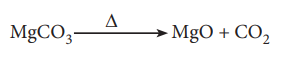
MgCO3 ன் மோலார் நிறை = 84 g mol-1.
84g MgCO3 ல் 24g மெக்னீசியம் உள்ளது
ஃ 100g MgCO3 ல்
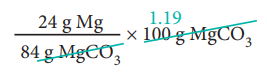
= 28.57 g Mg மெக்னீசியம் உள்ளது
அதாவது மெக்னீசியத்தின் சதவீதம் = 28.57 %.
84g MgCO3 ல் 12g கார்பன் உள்ளது
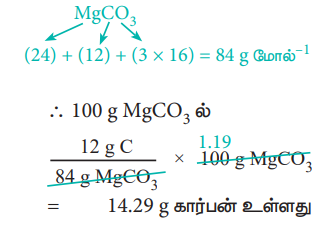
= 14.29g கார்பன் உள்ளது
ஃ கார்பனின் சதவீதம் = 14.29 %.
84g MgCO3 ல் 48g ஆக்சிஜன் உள்ளது
ஃ 100g MgCO3 ல்
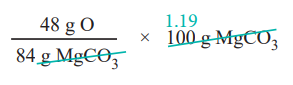
= 57.14g ஆக்சிஜன் உள்ளது
ஃ ஆக்சிஜனின் சதவீதம் = 57.14 %
சமன்படுத்தப்பட்ட சமன்பாட்டின் படி,
100 % தூய்மையான 84 g MgCO3 ஆனது வெப்பப்படுத்தும் போது 44g CO2 ஐத் தருகிறது.
ஃ 90 % தூய்மையான 1000 g MgCO3 ஐ வெப்பப்படுத்தும் போது
= [44 g / (84 g × 100%)] × 90 % × 1000 g
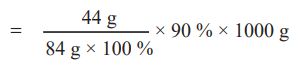
= 471.43 g CO2 ஐ தருகிறது.
= 0.471 kg CO2 உருவாகிறது
2. வினைக்கட்டுப்பாட்டுக் காரணி
கொடுக்கப்பட்ட வேதி வினையில், உருவாகும் வினைவிளை பொருட்களின் அளவினைத் தீர்மானிப்பதில் வேதிவினைக்கூறு விகித கோட்பாடு பயன்படுவதை முந்தையப் பாடப் பகுதியில் நாம் கற்றோம். வேதிவினைக் கூறு விகித அடிப்படையிலான அளவினைக் கொண்ட வினைபடுபொருட்களைக் கொண்டு ஒரு வினையானது நிகழ்த்தப்படும் போது, அனைத்து வினைபடுபொருட்களும், வினைவிளை பொருட்களாக மாற்றப்படுகிறது. மாறாக, வேதிவினைக் கூறு விகித அடிப்படையில் அமையாத அளவினைக் கொண்ட வினைபடு பொருட்களைக் கொண்டு, வினை நிகழ்த்தப்படும் போது, உருவாகும் விளை பொருளின் அளவானது, எந்த வினைபடுபொருள் முதலில் முழுவதும் வினைபடுகிறதோ, அந்த வினைபடுபொருளைச் சார்ந்து அமையும். இவ்வினைபடு பொருள் வினை தொடர்ந்து நிகழ்வதைக் கட்டுப்படுத்துகிறது, இது வினை கட்டுப்பாட்டுக் காரணி என அழைக்கப்படுகிறது. மற்ற வினைப் பொருட்கள், மிகுதியான வினைப் பொருட்கள் எனப்படுகின்றன.
வேதிவினைக் கூறு விகித கோட்பாட்டினை புரிந்து கொள்ள பயன்படுத்திய ஒப்புமையான கேசரி தயாரித்தலை நினைவுகூர்க.
அதில் குறிப்பிடப்பட்ட தயாரிப்பு முறையின் படி, ஒவ்வொரு கப் ரவாவிற்கும் இரண்டு கப் சர்க்கரை தேவைப்படும். 8 கப் சர்க்கரையும், 3 கப் ரவாவும் உள்ள ஒரு நிலையைக் கருதுக. (பிற தேவையான அனைத்துப் பொருட்களும் கூடுதலாக உள்ளது) சமையல் குறிப்பின்படி, 3 கப் ரவா மற்றும் 6 கப் சர்க்கரையினைப் பயன்படுத்தி 18 கப் கேசரியினைத் தயாரிக்க இயலும். நம்மிடம் கூடுதலாக 2 கப் சர்க்கரை இருந்த போதிலும் நம்மால் கூடுதலாக கேசரியினை தயாரிக்க இயலாது. ஏனெனில், தேவையான ரவா நம்மிடம் இல்லை. எனவே, இந்நிகழ்வில் தயாரிக்கப்படும் கேசரியின் அளவினை ரவா கட்டுப்படுத்துகிறது. இந்த ஒப்புமையினை, பின்வரும் வேதிவினைக்கு நீட்டிப்போம். மூன்று மோல் சல்பரானது பன்னிரெண்டு மோல் புளூரினுடன் வினைபுரிந்து சல்பர்ஹெக்சா புளுரைடை உருவாக்க அனுமதிக்கப்படுகிறது.
இவ்வினைக்கான சமன்படுத்தப்பட்ட சமன்பாடானது
S + 3F2 → SF6
வேதிவினைக் கூறு விகித அடிப்படையில்,
1 மோல் சல்பர், 3 மோல் புளூரினுடன் வினைபுரிந்து. 1 மோல் சல்பர்ஹெக்சா புளூரைடைத் தருகிறது. எனவே மூன்று மோல் சல்பர், 9 மோல் புளூரினுடன் வினைபுரிந்து, மூன்று மோல் சல்பர் ஹெக்சா புளூரைடைத் தரும். இந் நேர்வில், எடுத்துக் கொள்ளப்பட்ட அனைத்து சல்பர் மூலக்கூறுகளும் வினைபுரிந்து விட்டதால், இவ்வினை தொடர்ந்து நிகழ்வதை சல்பர் கட்டுப்படுத்துகிறது எனவே சல்பர் ஆனது வினைக் கட்டுப்படுத்தும் காரணி மற்றும் புளூரின் ஆனது மிகுதியான காரணி ஆகும். இந்நேர்வில் மூன்று மோல் புளூரின் மிகுதியாக எஞ்சியுள்ளது. மேலும் இவை வினைபுரிவதில்லை.
தன்மதிப்பீடு
7) ஒரு வினையின் சமன்படுத்தப்பட்ட சமன்பாடு கீழே கொடுக்கப்பட்டுள்ளது
2x + 3y → 4l + m
8 மோல் x ஆனது 15 மோல் y உடன் வினைபுரிய அனுமதிக்கப்படும் போது,
i) வினைக்கட்டுப்பாட்டு காரணி எது?
ii) உருவாகும் வினைவிளை பொருட்களின் அளவினைக் கணக்கிடுக.
iii) வினையின் இறுதியில், மிகுதியாக எஞ்சியிருக்கும் வினைபடுபொருளின் அளவினைக் கணக்கிடுக.
தீர்வு
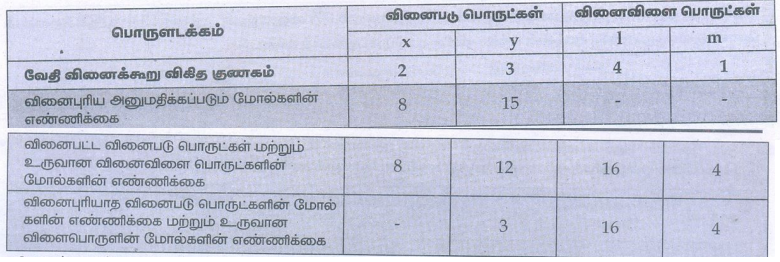
வினைக் கட்டுப்பாட்டுக் காரணி : x
உருவான விளைபொருள் : 16 மோல்கள் 1 மற்றும் 4 மோல்கள் m
கூடுதலாக எஞ்சியுள்ள வினைபடு பொருள் : 3 மோல்கள் y
யூரியாவானது நைட்ரஜனை அடிப்படையாகக் கொண்ட பொதுவாக பயன்படுத்தப்படும் ஒரு உரம் ஆகும். இது அம்மோனியா மற்றும் கார்பன் டை ஆக்ஸைடு ஆகிய வினை பொருட்களுக்கு இடையே நிகழும் பின்வரும் வேதிவினையின் மூலம் தயாரிக்கப்படுகிறது.
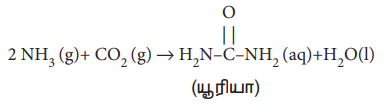
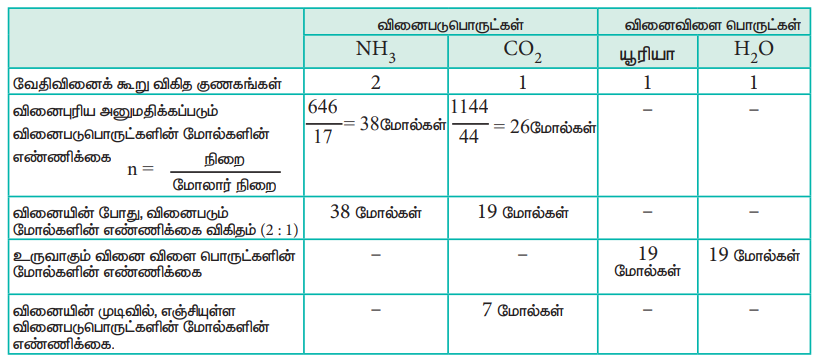
ஒரு செயல்முறையில், 646 g அம்மோனியாவானது, 1.144 kg CO2 உடன் வினையுரிய அனுமதிக்கப்பட்டு, யூரியா உருவாக்கப்படுகிறது என்க.
1) அனைத்து வினைபடு பொருட்களும், முழுவதுமாக வினையில் ஈடுபடுவதில்லை எனில், வினைகட்டுப்பாட்டுக் காரணி யாது?
2) உருவாகும் யூரியாவின் அளவினைக் கண்டறிக. மேலும் வினைபுரியாமல் மிகுதியாக உள்ள வினைக்காரணியைக் கண்டறிக.
சமன்படுத்தப்பட்ட சமன்பாடு,
2 NH3 (g) + CO2 (g) → H2NCONH2 (aq) + H2O (l)
தீர்வு:
1) இவ்வினையில் அம்மோனியா முழுவதும் வினைபடுகிறது. எனவே அம்மோனியா வினை கட்டுபாட்டுக் காரணி ஆகும். CO2 முழுவதும் வினைபுரியாமல் எஞ்சியுள்ளது எனவே CO2 மிகுதியாக உள்ள வினைக் காரணியாகும்.
2) உருவாகும் யூரியாவின் அளவு
= உருவான யூரியாவின் மோல்களின் எண்ணிக்கை × யூரியாவின் மோலார் நிறை
= 19 மோல்கள் × 60 g mol-1
= 1140 g = 1.14 kg
வினைபுரியாமல் எஞ்சியுள்ள CO2 அளவு
= எஞ்சியுள்ள CO2 மோல்களின் எண்ணிக்கை × CO2 மோலார் நிறை
= 7 மோல்கள் × 44 g mol-1
= 308 g.