11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
பாடச்சுருக்கம் - வேதியியல்: வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
பாடச்சுருக்கம்
நமது அன்றாட வாழ்வின் அடிப்படைத் தேவைகளை நிறைவு செய்வதில் வேதியியல் முக்கியப்பங்காற்றுகிறது. நமது வாழ்வில் பயன்படும் அனைத்தும் பருப்பொருட்களால் ஆக்கப்பட்டவை. நிறையுள்ள இடத்தை அடைத்துக் கொள்ளும் அனைத்தும் பருப்பொருட்கள் என அழைக்கப்படுகின்றன. பருப்பொருள்கள் இயற் நிலைமை மற்றும் வேதித் தன்மையின் அடிப்படையில் வகைப்படுத்தப்படுகின்றன. தனிமம் என்பது ஒரு வகை அணுக்களை மட்டுமே பெற்றிருக்கும். சேர்மங்கள் ஒன்றிற்கும் மேற்பட்ட, தனிமங்களின் அணுக்களைக் கொண்டிருக்கும். சேர்மங்களின் பண்பு அதில் அடங்கியுள்ள தனிமங்களின் பண்புகளிலிருந்து மாறுபட்டிருக்கும்.
அணுக்கள் மிகச்சிறிய உருவளவைப் பெற்றிருப்பதால், அதன் நிறையினை நேரடியாகக் கண்டறிய இயலாது. நியம அணுவான C-12 ஐ அடிப்படையாகக் கொண்டு IUPAC ஒரு ஒப்புமை அளவீட்டை அறிமுகப்படுத்தியுள்ளது. சிறும ஆற்றல் நிலையில் உள்ள ஒரு C-12 அணுவின் நிறையில் பன்னிரெண்டில் ஒரு பங்கு நிறை ஒருமைப்படுத்தப்பட்ட நிறை என அழைக்கப்படுகிறது. 1 அணு நிறை அலகு (அல்லது) 1u என்பது ≈ 1.6605 × 10-27 kg க்கு சமம். ஒப்பு அணு நிறை என்பது, சராசரி அணுநிறைக்கும், ஒருமைப்படுத்தப்பட்ட நிறைக்கும் இடையேயான விகிதம் என வரையறுக்கப்படுகிறது. ஒரு தனிமத்தின் சராசரி அணு நிறை என்பது அதன் இயற்கையில் கிடைக்கும் அனைத்து ஐசோடோப்புகளின் நிறைகளின் சராசரியாகும்.
ஒரு தனித்த மூலக்கூறின் நிறைக்கும், அதன் ஒருமைப்படுத்தப்பட்ட நிறைக்கும் இடையேயான விகிதம் மூலக்கூறு நிறை என வரையறுக்கப்படுகிறது. ஒரு மூலக்கூறின் ஒப்பு மூலக்கூறு நிறையானது, அம் மூலக்கூறில் அடங்கியுள்ள அனைத்து அணுக்களின் ஒப்பு அணுநிறைகளின் கூடுதலுக்குச் சமம்.
பொருளின் அளவு வழக்கமாக மோல் என்ற அலகால் குறிப்பிடப்படுகிறது. 12g கார்பன்-12 ஐசோடோப்பில் காணப்படும் கார்பன் அணுக்களின் எண்ணிக்கைக்குச் சமமான அடிப்படைத் துகள்களைப் பெற்றுள்ள ஒரு அமைப்பில் உள்ள பொருளின் அளவு ஒரு மோல் எனப்படும். ஒரு மோல் அளவுள்ள எந்த ஒரு பொருளிலும் உள்ள உட்பொருட்களின் எண்ணிக்கை 6.022 × 1023க்குச் சமம், இந்த எண் அவகாட்ரோ எண் என்றழைக்கப்படுகிறது. ஒரு பொருளின் மோலார் நிறை என்பது ஒரு மோல் அளவுள்ள அப்பொருளின் நிறையாகும், இது g mol-1 என்ற அலகால் குறிப்பிடப்படுகிறது. 273K மற்றும் 1 atm அழுத்தத்தில் ஒரு மோல் நல்லியல்பு வாயு 22.4 லிட்டர் கனஅளவுள்ள இடத்தினை அடைத்துக் கொள்ளும். மோல் கருத்தினைப் போலவே, பகுப்பாய்வு வேதியியலில் கிராம் சமான நிறை என்ற கருத்தும் பயன்படுகிறது.
1.008g ஹைட்ரஜன் அல்லது 8g ஆக்சிஜன் அல்லது 35.45g குளோரின் இவற்றோடு சேரக்கூடிய அல்லது இவற்றை இடப்பெயர்ச்சி செய்யக்கூடிய ஒரு தனிமம் அல்லது சேர்மம் அல்லது அயனியின் நிறையே, அதன் கிராம் சமான நிறை என வரையறுக்கப்படுகிறது.
ஒரு சேர்மத்தில் அடங்கியுள்ள தனிமங்களை அளந்தறியும் ஆய்வின் மூலம் கண்டறியப்பட்ட தனிமங்களின் நிறை சதவீதத்தினைப் பயன்படுத்தி, அச்சேர்மத்தின் எளிய விகித வாய்பாடு மற்றும் மூலக்கூறு வாய்பாடுகளைக் கண்டறியலாம்.
சேர்மத்தின், ஒரு மூலக்கூறில் அடங்கியுள்ள வெவ்வேறு தனிமங்களின் எண்ணிக்கையின் எளிய விகிதத்தினை அத்தனிமத்தின் குறியீட்டிற்கு கீழ் ஒட்டாக எழுதுவதால் பெறப்படும் வாய்பாடு எளிய விகித வாய்பாடு எனப்படும். சேர்மத்தின் ஒரு மூலக்கூறில் உள்ள அனைத்து தனிமங்களின் சரியான எண்ணிக்கையினை, அத்தனிமத்தின் குறியீட்டிற்கு கீழ் ஒட்டாக குறிப்பிட்டு எழுதுவதால் பெறப்படும் வாய்பாடு மூலக்கூறு வாய்ப்பாடாகும்.
வேதிவினைக் கூறுகளின் விகிதமானது, ஒரு சமன்படுத்தப்பட்ட வேதிச் சமன்பாட்டில், வேதி வினைப் பொருட்களுக்கு இடையேயான எண்ணியல் தொடர்பினைத் தருகிறது.
வேதிவினைக் கூறு விகித அடிப்படையில் அமையாத அளவினைக் கொண்ட வினைபடு பொருட்களைக்கொண்டு, வினை நிகழ்த்தப்படும் போது, உருவாகும், விளை பொருளின் அளவானது, எந்த வினைபடுபொருள் முதலில் முழுவதும் வினைபடுகிறதோ, அந்த வினைபடுபொருளைச் சார்ந்து அமையும். வினை தொடர்ந்து நிகழ்வதை, இவ்வினைபடு பொருள் கட்டுப்படுத்துகிறது, இது வினை கட்டுப்பாட்டுக் காரணி என அழைக்கப்படுகிறது. மற்ற வினைப் பொருட்கள் மிகுதியான வினைப் பொருட்கள் எனப்படுகின்றன.
ஒரு வினையில் எலக்ட்ரான்கள் இழக்கப்படுமாயின் அவ்வினை ஆக்சிஜனேற்றம் எனவும், எலக்ட்ரான்கள் ஏற்கப்படின் அவ்வினை ஆக்சிஜன் ஒடுக்கம் எனவும் அழைக்கப்படுகின்றன. இவ்விரு வினைகளும் ஒரே நேரத்தில் நிகழ்வதால் இவ்வகை வினைகள் ஆக்சிஜனேற்ற-ஒடுக்க வினைகள் (redox reactions) என்றும் அழைக்கப்படுகின்றன இவ்வினைகளை ஆக்சிஜனேற்ற எண் பற்றிய கோட்பாட்டின் அடிப்படையில் விளக்கலாம்.
ஒரு சேர்மத்தில் உள்ள ஒரு குறிப்பிட்ட அணுவின் ஆக்ஸிஜனேற்ற எண் என்பது, அவ்வணுவினைத் தவிர்த்து, பிற அணுக்களை, ஆக்சிஜனேற்ற என்ணைக் கண்டறிவதற்கான விதிகளின்படி நிர்ணயம் செய்யப்பட்ட அவற்றின் வழக்கமான ஆக்சிஜனேற்ற நிலையில் அயனிகளாக நீக்கிய பின்னர், அக்குறிப்பிட்ட அணுவின் மீது எஞ்சியிருப்பதாகக் கருதப்படும் கற்பனையான மின்சுமை என வரையறுக்கப்படுகிறது.
ஒரு வினையில், ஒரு தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரித்தால் அது ஆக்சிஜனேற்றம் அடைந்துள்ளது மற்றும் ஆக்சிஜனேற்ற எண் குறைந்தால் அது ஒடுக்கம் அடைந்துள்ளது.
● இரண்டு வினைப் பொருட்கள் வினைபுரிந்து ஒரு சேர்மத்தினைத் தரும் ஆக்சிஜனேற்ற - ஒடுக்க வினைகள், இணையும் வினைகள் என அழைக்கப்படுகின்றன.
● ஒரு சேர்மம், இரண்டு அல்லது அதற்கு மேற்பட்ட கூறுகளாக சிதைவடையும், ஆக்சிஜனேற்ற ஒடுக்க வினைகள் சிதைவடையும் வினைகள் என அழைக்கப்படுகின்றன.
● ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் போது, ஒரு சேர்மத்தில் உள்ள ஒரு அணு அல்லது அயனி மற்றொரு அணு அல்லது அயனியால் பதிலீடு செய்யப்பட்டால் அத்தகைய வினைகள் இடப்பெயர்ச்சி வினைகள் எனப்படுகின்றன.
● சில ஆக்சிஜனேற்ற - ஓடுக்க வினைகளில், ஒரே சேர்மம், ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜன் ஓடுக்கம் இரண்டிற்கும் உட்படுகிறது. இத்தகைய வினைகளில், ஒரே தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரிக்கவும், குறையவும் செய்கிறது. இத்தகைய வினைகள் விகிதச்சிதைவு வினைகள் என அழைக்கப்படுகின்றன.
● பல்வேறு உலோகங்களுக்கிடையே எலக்ட்ரானை ஏற்கும் / இழக்கும் தன்மையின் அடிப்படையில் அமையும் வினைகள் எலக்ட்ரான் பரிமாற்றத் திறன் வினைகள் எனப்படும்.
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளுக்கான சமன்பாட்டினை, ஆக்சிஜனேற்ற எண் முறை அல்லது அயனி - எலக்ட்ரான் முறையினைப் பயன்படுத்தி சமன் செய்யலாம்.
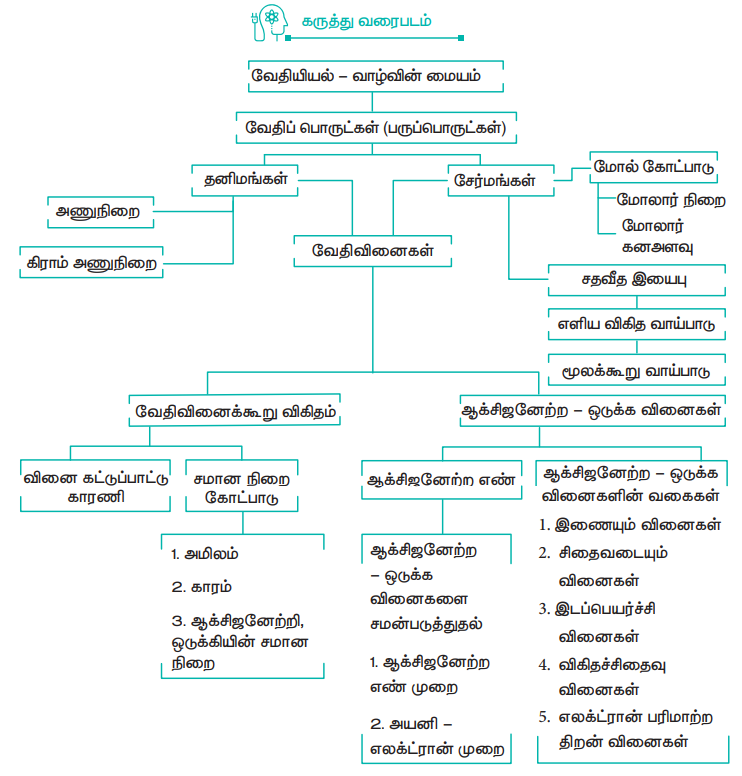
கருத்து வரைபடம்
இணையச்செயல்பாடு
எளிய விகித மற்றும் மூலக்கூறு வாய்பாடுகள் கணக்கீடு
செய்முறையைப் பயன்படுத்தி தனிமங்களின் சதவீத இயைபிலிருந்து அவற்றின் எளிய விகித வாய்பாடு மற்றும் மூலக்கூறு வாய்ப்பாட்டினை கணக்கிட இயலும்
https://ggbm.at/fbUwKmUW என்ற URLக்குச் செல்க அல்லது வலது புறத்தில் உள்ள விரைவுத் துலக்கக் குறியீட்டினை (QR code) ஸ்கேன் செய்க
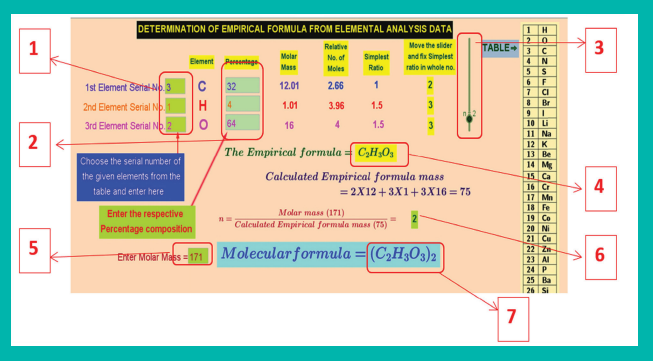
நிலை 1: இணையப் பக்கத்தினை திறந்து கொடுக்கப்பட்ட உரலியைத் (URL) தட்டச்சு செய்க. 11ம் வகுப்பு வேதியியல் என்ற பெயரில் ஒரு ஜியோஜீப்ரா (Geogebra) பயிற்சி ஏட்டினை நீங்கள் காண முடியம். எளிய விகித வாய்பாடு (Empirical formula) என்று பெயரிடப்பட்டுள்ள பயிற்சி பக்கத்தினை திறக்கவும், படத்தில் காண்பது போன்று வலைப்பக்கத்தினை தாங்கள் காணலாம்.
நிலை 2: சோதனைக்கு எடுத்துக் கொள்ளப்பட்ட சேர்மத்தில் அடங்கியுள்ள தனிமங்களுக்கு உரிய வரிசை எண்ணினை, வலைப்பக்கத்தின் வலது புறத்தில் கொடுக்கப்பட்டுள்ள அட்டவணையிலிருந்து தெரிவு செய்து, அதற்கென கொடுக்கப்பட்டுள்ள இடம் (1)ல் பதிவு செய்க மற்றும் தனிமங்களின் சதவீத இயைபினை தொடர்புடைய இடங்களில் (2)ல் பதிவு செய்க.
நிலை 3: இப்பொழுது, மோலார் நிறை ஒப்பு மோல்களின் எண்ணிக்கை மற்றும் எளிய விகிதம் ஆகிய அனைத்தும் தாமாக கணக்கிடப்பட்டு, தொடர்புடைய கட்டங்களில் நிரம்பும். எளிய விகிதமானது பின்ன எண்ணாக அமைந்தால், நகர்த்தியைச் (3), சிறிய எண்ணிலிருந்து நகர்த்துவதன் மூலம் எளிய விகிதத்தினை முழு எண்ணாக மாற்றுக.
இப்பொழுது கணக்கிடப்பட்ட எளிய விகித வாய்ப்பாட்டினை (4)ல் காணலாம்.
நிலை 4: மூலக்கூறு வாய்ப்பாட்டினைக் கணக்கிட, தொடர்புடைய கட்டம் (5)ல் மோலார் நிறையினைப் பதிவு செய்க. இப்பொழுது 'n' ஆனது திரையில் (6)ல் தோன்றும், மேலும் மூலக்கூறு VVV கீழே (7)ல் தெரியும்.