11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் வகைகள்
2. ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் வகைகள்
ஆக்சிஜனேற்ற – ஒடுக்க வினைகளை பின்வருமாறு வகைப்படுத்தலாம்.
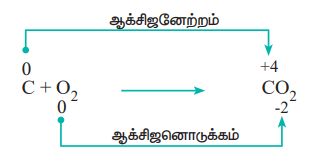
1. இணையும் வினைகள்: (Combination reactions) :
இரண்டு வினைப் பொருட்கள் வினைபுரிந்து ஒரு சேர்மத்தினைத் தரும் ஆக்சிஜனேற்ற - ஒடுக்கவினைகள், இணையும் வினைகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டு:
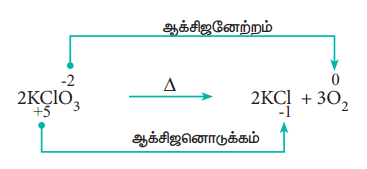
2. சிதைவடையும் வினைகள் : (Decomposition reactions)
ஒரு சேர்மம், இரண்டு அல்லது அதற்கு மேற்பட்ட கூறுகளாக சிதைவடையும், ஆக்சிஜனேற்ற ஒடுக்க வினைகள் சிதைவடையும் வினைகள் என அழைக்கப்படுகின்றன. இவ்வினைகள் இணையும் வினைகளுக்கு நேர்மாறானவை. இவ்வகை வினைகளில், ஒரு சேர்மத்தில் உள்ள இரண்டு வெவ்வேறான தனிமங்களின் ஆக்சிஜனேற்ற எண்களில் மாற்றம் ஏற்படுகிறது.
எடுத்துக்காட்டு:
3. இடப்பெயர்ச்சி வினைகள் (Displacement reactions)
ஆக்சிஜனேற்ற - ஒடுக்க வினைகளின் போது, ஒரு சேர்மத்தில் உள்ள ஒரு அணு அல்லது அயனி மற்றொரு அணு அல்லது அயனியால் பதிலீடு செய்யப்பட்டால் அத்தகைய வினைகள் இடப்பெயர்ச்சி வினைகள் எனப்படுகின்றன. இவ்வினைகளை மேலும்
i) உலோக இடப்பெயர்ச்சி வினைகள்
ii) அலோக இடப்பெயர்ச்சி வினைகள் என வகைப்படுத்தலாம்.
(i) உலோக இடப்பெயர்ச்சி வினைகள்:
ஒரு கண்ணாடி கலனில் நீர்த்த தாமிர சல்பேட் (Copper Sulphate) கரைசலை எடுத்துக் கொண்டு, அதில் துத்தநாக (Zinc) உலோக தகட்டினை வைக்கவும். கரைசலை உற்று நோக்கவும். கரைசலின் அடர் நீல நிறத்தின் செறிவு மெதுவாக குறையத்துவங்கும். இறுதியில் நிறம் முற்றிலும் மறைந்துவிடும். துத்தநாக உலோகத் தகட்டின் மீது பழுப்பு நிற தாமிர உலோகம் படிந்திருப்பதைக் காணலாம். இந்நிகழ்வு நடைபெற பின்வரும் உலோக இடப்பெயர்ச்சி வினை காரணமாக அமைகிறது.

ii) அலோக இடப்பெயர்ச்சி வினைகள்:
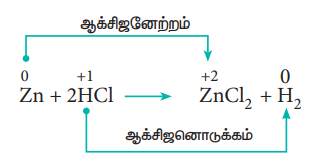
நீர்த்த HCl கரைசலுடன் துத்தநாக துகள்களை சேர்க்கும்போது HCl ல் இருந்து துத்தநாகம் ஹைட்ரஜனை இடப்பெயர்ச்சி செய்கிறது.
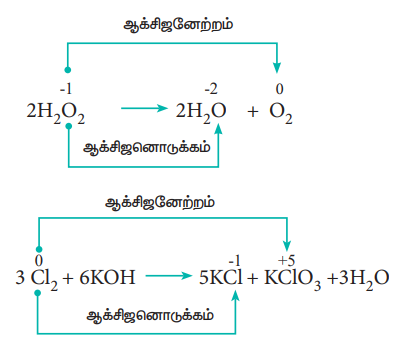
4. விகிதச்சிதைவு வினைகள் (Disproportionation reactions)
சில ஆக்சிஜனேற்ற – ஒடுக்க வினைகளில், ஒரே சேர்மம், ஆக்சிஜனேற்றம் மற்றும் ஆக்சிஜனொடுக்கம் இரண்டிற்கும் உட்படுகிறது. இத்தகைய வினைகளில், ஒரே தனிமத்தின் ஆக்சிஜனேற்ற எண் அதிகரிக்கவும், குறையவும் செய்கிறது. இத்தகைய வினைகள் விகிதச்சிதைவு வினைகள் என அழைக்கப்படுகின்றன.
எடுத்துக்காட்டு :
5. எலக்ட்ரான் பரிமாற்றத் திறன் வினைகள் (Competitive electron transfer reactions)
தாமிர சல்பேட் கரைசலிலிருந்து, தாமிரத்தை, துத்தநாகம் இடப்பெயர்ச்சி செய்வதை உலோக இடப்பெயர்ச்சி வினைகளில் நாம் கற்றறிந்தோம். இதன் எதிர்வினை நிகழ வாய்ப்புள்ளதா? என்பதை நாம் சோதித்து அறிவோம். முன்னரே விளக்கிய செயல்முறைப்படி, துத்தநாக சல்பேட் கரைசலை ஒரு கலனில் எடுத்துக் கொண்டு, தாமிர தகட்டினை அக்கரைசலில் வைக்கவும். தாமிரமானது, துத்தநாக சல்பேட் கரைசலிலிருந்து, துத்தநாகத்தை இடப்பெயர்ச்சி செய்திருக்குமாயின், Cu2+ அயனிகள் கரைசலில் இருந்திருக்க வேண்டும். இதன் விளைவாக கரைசல் நீல நிறமாக மாற்றமடைந்திருக்க வேண்டும். ஆனால், இத்தகைய மாற்றங்கள் ஏதும் நிகழ்வதில்லை. எனவே, தாமிரம் மற்றும் துத்தநாகம் ஆகிய இரண்டினையும் ஒப்பிடும்போது, துத்தநாகமானது எலக்ட்ரானை இழக்கும் தன்மையினையும், தாமிரமானது எலக்ட்ரானை ஏற்கும் தன்மையினையும் பெற்றுள்ளது என்று நாம் முடிவு செய்யலாம்.
மேற்கண்டுள்ளவாறு வெள்ளி நைட்ரேட் (Silver Nitrate) கரைசலில், தாமிர தகட்டினை வைத்து வினை ஏதேனும் நிகழ்கிறதா என பார்ப்போம். சிறிது நேரம் கழித்த பின்னர், கரைசல் மெதுவாக நீல நிறமாக மாறத்துவங்கும். Cu2+ அயனிகள் உருவாவதே இதற்கு காரணமாகும்.
அதாவது, வெள்ளி நைட்ரேட் கரைசலில் உள்ள வெள்ளியை, தாமிரம் இடப்பெயர்ச்சி செய்கிறது.
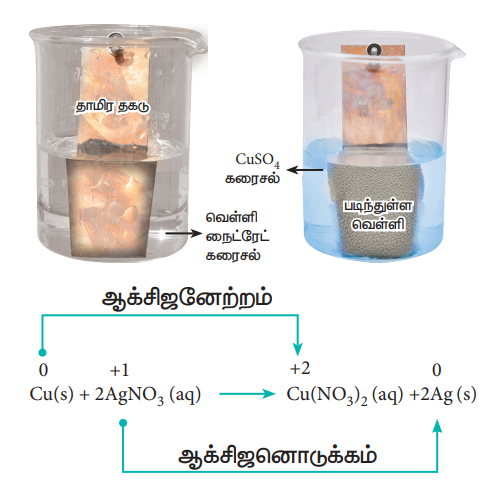
தாமிரம் மற்றும் வெள்ளி ஆகியவற்றிக்கு இடையே வினைத்திறனை ஒப்பிடும்போது, தாமிரம் எலக்ட்ரானை இழக்கும் தன்மையினையும், வெள்ளி எலக்ட்ரானை ஏற்கும் தன்மையினையும் பெற்றுள்ளதை மேற்கண்டுள்ள வினை உணர்த்துகிறது.
மேற்கண்டுள்ள சோதனை முடிவுகளிலிருந்து, துத்தநாகம், தாமிரம் மற்றும் வெள்ளி ஆகிய உலோகங்களுக்கிடையே ஒப்பிடும் போது எலக்ட்ரானை வெளியிடும் திறன் பின்வரும் வரிசையில் அமைந்துள்ளது என நாம் முடிவு செய்யலாம்.
துத்தநாகம் > தாமிரம் > வெள்ளி
உலோகங்களுக்கு இடையேயான, எலக்ட்ரான்களை பெறுவதில் உள்ள மேற்கண்டுள்ள தன்மையானது, கால்வானிக் மின் கலன்களை வடிவமைப்பதில் நமக்கு பயனுள்ளதாக உள்ளது. கால்வானிக் மின்கலன்களைப் பற்றி XII ம் வகுப்பில் விரிவாக கற்போம்.