11 வது வேதியியல் : அலகு 1 : வேதியியலின் அடிப்படைக் கருத்துக்கள் மற்றும் வேதிக் கணக்கீடுகள்
மூலக்கூறு நிறை
அணு மற்றும் மூலக்கூறு நிறைகள்.
2. மூலக்கூறு நிறை
ஒப்பு அணு நிறையினைப் போன்று ஒப்பு மூலக்கூறு நிறையானது, ஒரு மூலக்கூறின் நிறைக்கும், ஒருமைபடுத்தப்பட்ட அணு நிறைக்கும் இடையேயான விகிதம் என வரையறுக்கப்படுகிறது. ஒரு சேர்மத்தின் ஒப்பு மூலக்கூறு நிறையினை, அதில் அடங்கியுள்ள அணுக்களின் ஒப்பு அணு நிறைகளின் கூடுதல் மூலம் கணக்கிட இயலும்.
எடுத்துக்காட்டாக,
i) ஹைட்ரஜன் மூலக்கூறின் ஒப்பு மூலக்கூறு நிறை (H2)
= 2 × (ஹைட்ரஜன் அணுவின் ஒப்பு அணு நிறை)
= 2 × 1.008 u
= 2.016 u.
ii) குளூக்கோஸ் சேர்மத்தின் ஒப்பு மூலக்கூறு நிறை (C6H12O6)
= (6 × 12) + (12 × 1.008) + (6 × 16)
= 72 + 12.096 + 96
= 180.096 u
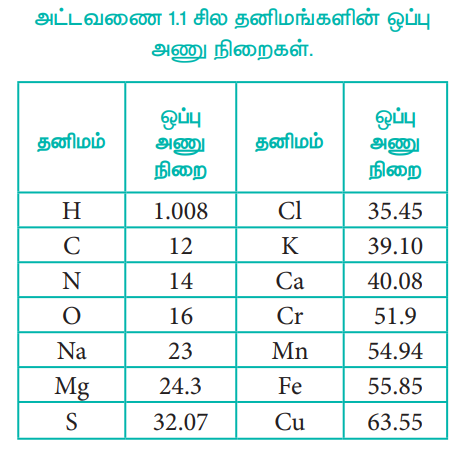
அட்டவணை 1.1 சில தனிமங்களின் ஒப்பு அணு நிறைகள்.
தன்மதிப்பீடு
2) பின்வருவனவற்றின் ஒப்பு மூலக்கூறு நிறையினைக் கணக்கிடுக.
● எத்தனால் (C2 H5 OH)
● பொட்டாசியம் பெர்மாங்கனேட் (KMnO4)
● பொட்டாசியம் டைகுரோமேட் (K2 Cr2 O7)
● சுக்ரோஸ் (C12 H22 O11)
தீர்வு:
(i) C2H5OH : (2 × 12) + (5 × 1) + (1 × 16) + (1 × 1)
= 46g
(ii) KMnO4 : (1 × 39) + (1 × 55) + (4 × 16)
= 158g
(iii) K2Cr2O7 : (2 × 39) + (2 × 52) + (7 × 16)
= 294g
(iv) C12H22O11 : (12 × 12) + (22 × 1) + (11 × 16)
= 342 g