புத்தக வினாக்கள் மற்றும் முக்கிய கேள்வி பதில்கள் | வேதியியல் - வேதிவினை வேகவியல் : பின்வரும் வினாக்களுக்கு விடையளிக்க | 12th Chemistry : UNIT 7 : Chemical Kinetics
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 7 : வேதிவினை வேகவியல்
வேதிவினை வேகவியல் : பின்வரும் வினாக்களுக்கு விடையளிக்க
6. வினை வேகத்தை தீர்மானிக்கும் படி என்பதனை உதாரணத்துடன் விளக்குக.
• வினைவேக மாற்றி முன்னிலையில் H2O2 சிதைவடையும் வினையினைக் கருதுக.
2H2O2(aq) → 2H2O(t) + O2(g)
• மேற்கண்ட வினை, H2O2 மற்றும் I-இரண்டையும் பொறுத்து முதல் வகை வினை என சோதனை மூலம் கண்டறியப்பட்டது.
• இதிலிருந்து H2O2 சிதைவடையும் வினையில் I- இடம் பெறுகிறது என அறிய முடிகிறது.
படிநிலை 1:
H2O2(aq) + I- (aq) → H2O(t) + OI- (aq) (மெதுவான படி)
படிநிலை 2:
H2O2 (aq) + I- (aq) → H2O (t) + I- (aq) + O2(g) (வேகமான படி)
ஒட்டுமொத்த வினை: 2H2O2(aq) → 2H2O(ppp) +O2(g)
• மேற்கண்டுள்ள இரு வினைகளும் அடிப்படை வினைகளாகும்.
• படிநிலை 1 மற்றும் 2 ஐ சேர்ப்பதன் மூலம் ஒட்டுமொத்த வினைக்கான சமன்பாட்டினைப் பெறலாம்.
• படிநிலை 1ல் H2O2 மற்றும் I- ஆகிய இரண்டு வினைபடு பொருட்களும் இடம்பெறுவதால் அந்த படிநிலையே வினைவேகத்தை தீர்மானிக்கும் மெதுவான படிநிலையாகும்.
• மேலும், ஒட்டுமொத்த வினை, இரு மூலக்கூறு வினையாகும்.
7. முதல் வகை வினையின் வரைபட விளக்கத்தினைத் தருக
• ஒரு முதல் வகை வினை A → விளைபொருள்
k = 2.303 / t log [Ao]/A
• மேற்கண்ட சமன்பாட்டினை நேர்கோடு சமன்பாடு y = mx + c என்ற வடிவில் பின்வருமாறு எழுதலாம்.
k = 1/t In[Ao]/[A]
kt = In[Ao] - In[A]
ஃ In[A] = In[Ao] – kt
In[A] = -kt + In[Ao]
y = mx+c
• சரிவு = m = -k
• y அச்சு வெட்டுத்துண்டு c = In[A °]
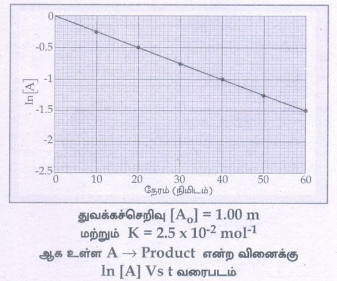
துவக்கச்செறிவு [A°] =1.00 m
மற்றும் K= 2.5 × 10-2 mol-1
ஆக உள்ள A → Product என்ற வினைக்கு In [A]Vs t வரைபடம்
• சீரான நேர இடைவெளிகளில், வினைபடு பொருட்களின் செறிவினைக் கண்டறிவதன் மூலம் வினை நிகழ்வதைக் கண்காணித்தால் அம்முடிவுகளின் அடிப்படையில் வரையப்படும், In[A] Vs t வரைபடமானது எதிர்க்குறி சாய்வுடன் கூடிய நேர்கோட்டினைத் தரும்.
இதிலிருந்து வினைவேக மாறிலியின் மதிப்பினை நாம் கண்டறியலாம்.
8. பின்வரும் வினைகளுக்கான வேக விதியினைத் தருக.
அ) ஒரு வினை x ஐப் பொறுத்து 3/2 வினை வகையையும், y ஐப் பொறுத்து பூஜ்ய வகையையும் பெற்றுள்ளது.
ஆ) ஒரு வினை NO வைப் பொறுத்து இரண்டாம் வகை, Br2 வைப் பொறுத்து முதல் வகை.
அ) வினை வேகம் = k[x] 3/2 [Y] °
ஃவினை வேகம் = k[x] 3/2
ஆ) வினை வேகம் = k[NO] 2 [Br2]1
9. ஒரு வேதிவினையின் வேகத்தை வினைவேக மாற்றி எவ்வாறு பாதிக்கின்றது என்பதனை எடுத்துக்காட்டுடன் விளக்குக.
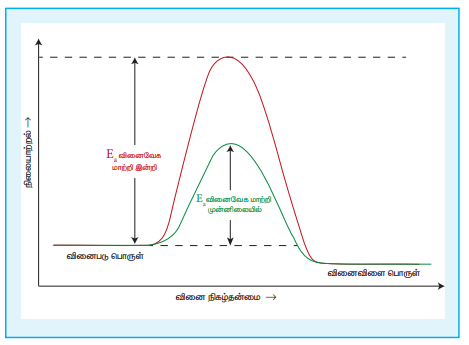
• ஒரு பொருள் எந்த ஒரு நிரந்தரமான வேதி மாற்றத்திற்கும் உட்படாமல் வினையின் வேகத்தினை மட்டும் மாற்றி அமைக்குமானால் அது வினைவேக மாற்றி எனப்படும்.
• வினைவேக மாற்றி வினையின் கிளர்வ, ஆற்றலைக் குறைக்கிறது. எனவே, ஆற்றல் தடையினை கடந்து சென்று விளைபொருளாக மாறும் வினைபடு மூலக்கூறுகளின் எண்ணிக்கை அதிகரிக்கின்றன. இதனால் வினை வேகமும் அதிகரிக்கின்றது.
• எ.கா: 7 ml 0.1 N ஆக்சாலிக் அமிலக் கரைசல், 5 ml 0.1 N KMnO4 கரைசல் மற்றும் 5 ml 2N நீர்த்த H2SO4 கரைசல் ஆகியவற்றை A மற்றும் B என குறியிடப்பட்ட இரு சோதனைக் குழாய் களில் எடுக்கவும்.
• இரு சோதனைக் குழாய்களிலும் உள்ள கரைசல்கள் இளஞ்சிவப்பு நிறத்திலிருக்கும்.
• சிறிதளவு மாங்கனீசு சல்பேட் படிகங்களை சோதனைக்குழாய் Aயில் இடவும். இளஞ்சிவப்பு நிறம் மறையத் துவங்கி இறுதியில் முழுவதும் மறைகிறது.
• ஏனெனில் இந்நிகழ்வில் MnSO4 வினைவேக மாற்றியாக செயல்பட்டு MnO4- ஆல் C2042- ன் ஆக்சிஜனேற்றமடையும் வினையின் வேகத் தினை அதிகரிக்கின்றது. எனவே இளஞ்சிவப்பு நிறம் மறைகிறது.
• சோதனைக் குழாய் Bயில் இது நிகழவில்லை . எனவே நிறம் மறையவில்லை.
10. A, B மற்றும் C ஆகியவற்றிற்கிடையேயான வினையின் வேக விதி வினைவேகம் = k[A]2[B][L]3/2 பின்வரும் நேர்வுகளின் வினைவேகம் எவ்வாறு மாற்றமடையும்?
i) [L]ன் செறிவு நான்கு மடங்காக உயர்த்தும் போது
ii) [A] மற்றும் [B] ஆகிய இரண்டின் செறிவுகளையும் இரு மடங்காக்கும் போது
iii) [A]ன் செறிவை பாதியாகக் குறைக்கும் போது
iv) [A] ன் செறிவை (3/2) மடங்காக குறைத்தும் [L] ன் செறிவை நான்கு மடங்காகவும் மாற்றும் போது
தீர்வு:
i) வினைவேகம் = k[A]2[B][L]3/2 ............. (1)
[L] = [4L] எனும் போது
வினைவேகம் = k[A]2[B][L]3/2
வினைவேகம் = 8 (k[A] 2[B] [L] 3/2) ...........(2)
சமன்பாடு (1) மற்றும் (2) ஐ ஒப்பிட வினை வேகம் 8 மடங்கு அதிகரிக்கிறது.
ii) [A] = [2A] மற்றும் [B] = [2B] எனும் போது வினைவேகம் = k[2A]2[2B][L]3/2
வினைவேகம் = 8( k[A] 2 [B] [L] 3/2...........(3)
சமன்பாடு (1) மற்றும் (3) ஐ ஒப்பிட வினைவேகம் 8 மடங்கு அதிகரிக்கிறது.
iii) [A] = [A/2] எனும் போது வினைவேகம் = k[A/2]2 [B] [L]3/2
வினைவேகம் = (1/4) (k[A]2[B] [L]3/2 ------(4)
சமன்பாடு (1) மற்றும் (4) ஐ ஒப்பிட வினை வேகம் 1/4 மடங்கு அதிகரிக்கிறது.
iv) [A] = [A/3] மற்றும் [L] = [4L) எனும் போது
வினைவேகம்= k[A/3]2 [B] [4L]3/2
வினைவேகம்= (8/9) (k[A]2[B] [L]3/2 ------(5)
சமன்பாடு (1) மற்றும் (4) ஐ ஒப்பிட வினை வேகம் 8/9 மடங்கு அதிகரிக்கிறது.
11. ஒருபடியின் (monomer) செறிவானது 0.05 molL-1 ஆக உள்ள ஒரு இருபடி (dimer) உருவாகும் இரண்டாம் வகை வினையின் வினைவேகம் 7.5 × 10-3 mol L-1s-1 வினைவேக மாறிலியினைக் கண்டறிக.
தீர்வு: M என்ற ஒருபடி மூலக்கூறு இருபடியாகும் வினையைக் கருதுவோம்.
2M → (M)2
வினைவேகம் =k[M]n
n = 2 மற்றும் [M] = 0.05 mol L-1
வினைவேகம் = 7.5 × 10-3 mol L-1 s-1
k = வினைவேகம் / [M]n
k = 7.5 × 10-3 /(0.05)2 = 3mol-1 Ls-1
12. x + y + z → விளைபொருள் என்ற வினையின்,வேக விதி, வினைவேகம் = k[x]3/2[y]1/2வினையின் ஒட்டு மொத்த வினைவகை மற்றும் Z ஐப் பொறுத்து வினையின் வகை என்ன?
தீர்வு:
வினைவேகம் = k[x]3/2[y]1/2
ஒட்டுமொத்த வினைவகை = (3/2 + 1/2) = 2
இரண்டாவது வகை வினை.
வினைவேக வீதியானது தன் செறிவு மதிப்பினைக் கொண்டிருப்பதில்லை. எனவே Z ஐப் பொறுத்து பூஜ்ய வகை வினையாகும்.
13. இரு மூலக்கூறு வினைகளுக்கான மோதல் கொள்கையினைச் சுருக்கமாக விளக்குக.
• 1916ல் மேக்ஸ் ட்ராட்ஸ் என்பவராலும், 1918ல் வில்லியம் லூயிஸ் என்பவராலும் மோதல் - கொள்கை தனித்தனியே முன் மொழியப்பட்டது.
• இக்கொள்கையின்படி, வினைபடு பொருட்களின் மூலக்கூறுகளுக்கிடையே மோதல் நிகழ்வதால் வேதி வினைகள் நிகழ்கின்றன.
• A2(g) + B2(g) → 2AB(g)
• ஒரு வினாடியில் A2மற்றும் B2 மூலக்கூறுகளுக் கிடையே நடை பெறும் மோதல்களின் எண்ணிக்கைக்கு நேர் விகிதத்தில் இருக்கும். வினை வேகம் 01. ஒரு லிட்டர் கன அளவில் ஒரு வினாடியில் மோதலுறும் மூலக் கூறுகளின் எண்ணிக்கை (மோதல் வீதம்)
• மோதல் எண்ணிக்கை α. A2 மற்றும் B2 வின் செறிவுகள்
மோதல் வீதம் α [A2] [B2]
மோதல் வீதம் =Z [A2] [B2]
Z என்பது மாறிலி
• அறை வெப்பநிலை (298 K) மற்றும் 1 atm அழுத்தத்தில் ஒவ்வொரு மூலக்கூறும் ஒரு வினாடியில் 109 மோதல்களுக்கு உட்படுவதாகக் கருதினால், 10-9 வினாடியில் 1 மோதல் நடப்ப தாகக் கொள்ளலாம்.
• ஒவ்வொரு மோதலும் வினை நிகழ காரணமாக அமையுமானால், வினையானது 10-9 வினாடியில் நிறைவடைய வேண்டும்.
• வினை நிகழ வேண்டுமானால், மோதலுறும் மூலக்கூறுகள் ஒரு குறிப்பிட்ட அளவு குறைந்தபட்ச ஆற்றலைப் பெற்றிருக்க வேண்டும். அவ்வாற்றல் கிளர்வு ஆற்றல் எனப்படும்.
• கிளர்வு ஆற்றலை விட குறைவான ஆற்றலைக் கொண்டுள்ள மூலக் கூறுகளுக்கு இடையே மோதல் நிகழும் போது அவைகள் எவ்வித மாற்றங்களுக்கும் உட்படுவதில்லை. எனவே அம் மோதலின் காரணமாக வினையேதும் நிகழ்வதில்லை .
• வினை நிகழ காரணமாக அமையும் மோதல்களின் விகிதம் f என்பது
f = c –Ea/RT
• 300K வெப்பநிலையில் 100 KJ mol-1 கிளர்வு ஆற்றலுடைய ஒரு வினைக்கு மோதல் காரணி fன் மதிப்பு f = e-40 ≈ 4 × 10-18 = 4/10-18
• எனவே 1018 மோதல்களில், நான்கு மோதல்கள் மட்டுமே வினைபடு பொருட்களை, வினை விளை பொருள்களாக மாறுவதற்கு தேவையான ஆற்றலைப் பெற்றிருந்தாலும் வினை இடைநிலை உருவாக சாதகமான திசைப் போக்கில் மோதல் நிகழ்ந்தால் மட்டுமே அவை வினைபுரியும்.
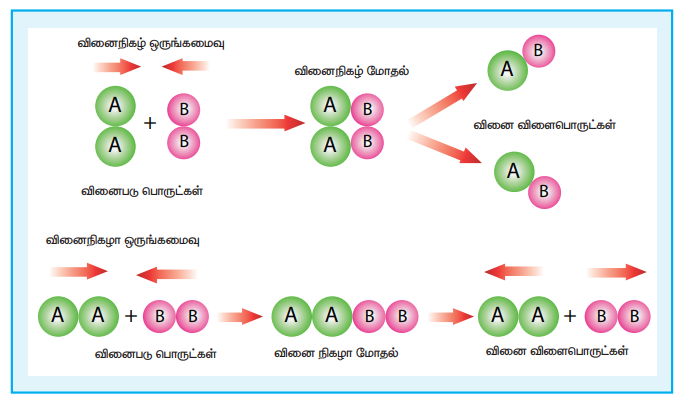
• தகுந்த திசைப்போக்குடன் அமைந்துள்ள வினை நிகழ காரணமான மோதல்களின் எண்ணிக் கையை இட அமைவுக் காரணி p தருகிறது.
வினைவேகம் = p × f × மோதல் வீதம்
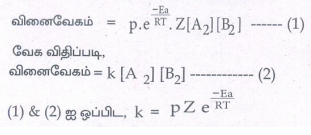
வேக விதிப்படி, வினைவேகம் = k [A 2] [B2] ------------ (2)
(1) & (2) ஐ ஒப்பிட, k = pZe -Ea/RT
k = வினைவேக மாறிலி
14. அர்ஹீனியஸ் சமன்பாட்டினை எழுதி அதில் இடம் பெற்றுள்ளனவற்றை விளக்குக.
அர்ஹீனியஸ் சமன்பாடு
k = Ae –Ea/RT
k = வினைவேக மாறிலி
A = அதிர்வெண் காரணி
Ea = கிளர்வு ஆற்றல்
R = வாயு மாறிலி
T = தனி வெப்பநிலை Kல்
15. 500 K வெப்பநிலையில் வாயு நிலையில் உள்ள Cl207 சிதைவடைந்து Cl2 மற்றும் O2 ஆக மாறும் வினை ஒரு முதல் வகை வினையாகும். 500 K ல் ஒரு நிமிடத்திற்குப் பின் Cl2O7 ன் செறிவு 0.08 லிருந்து 0.04 atm ஆக மாற்றமடைந்தால் S-1 ல் வினைவேக மாறிலியைக் கணக்கிடுக.
தீர்வு:
k = 2.303/t log [Ao]/[A]
k = 2.303/1min log [0.08]/[0.04]
k = 2.303 log 2
k = 2.303 × 0.3010
k = 0.6932 min-1
k = (0.6932/60)s-1
k = 1.153 ×10-2s-1

16. பூஜ்ய வகை வினைக்கு இரு எடுத்துக்காட்டுகள் தருக.
பூஜ்ய வகை வினைக்கு எடுத்துக்காட்டுகள்:
1. H2 மற்றும் Cl2 ஆகியவற்றிற்கு இடையேயான ஒளி வேதிவினை
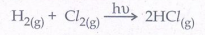
2. சூடான பிளாட்டினம் புறப்பரப்பில் N2O சிதைவடைதல்.
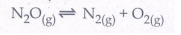
17. போலி முதல் வகை வினையை ஒரு எடுத்துக் காட்டுடன் விளக்குக.
• ஒரு இரண்டாம் வகை வினையில் ஏதேனும் ஒரு வினைபடு பொருளின் அளவினை மிக அதிக அளவில் எடுத்துக் கொள்வதன் மூலம், அவ்வினையினை முதல் வகை வினையாக மாற்றி அமைக்கலாம்.
• இவ்வாறு மாற்றியமைக்கப்படும் வினைகள் போலி முதல் வகை வினைகள் எனப்படுகின்றன. எ.கா: அமில முன்னிலையில் எஸ்டரை நீராற்பகுத்தல்.
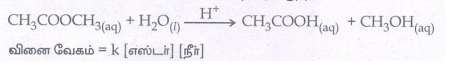
வினை வேகம் = k [எஸ்டர்) (நீர்]
• இவ்வினையானது, அதிக அளவு நீரைக்கொண்டு நிகழ்த்தப்பட்டால், நீராற் பகுத்தலின்போது, நீரின் செறிவில் குறிப்பிடத் தகுந்த அளவு மாற்றம் ஏற்படுவதில்லை .
• அதாவது ஏறத்தாழ நீரின் செறிவு மாறிலியாகும்.
• இந்நிலையில் k(நீர்) = k1 என வரையறுக்கப்படுகிறது.
• எனவே மேற்கண்ட வேகச் சமன்பாட்டினை பின்வருமாறு எழுதலாம்.
வினை வேகம் = k1 [எஸ்டர்)
18. பின்வரும் வினைகளில் வினை வகையைக் கண்ட றிக.
1. இரும்பு துருப்பிடித்தல்
2.  ன் கதிரியக்கச் செறிவு
ன் கதிரியக்கச் செறிவு
3. 2A + 3B → விளைபொருள் ; வினைவேகம்
k[A] 1/2 [B]2
i) இரும்பு துருப்பிடித்தல்:
இரும்பு துருப்பிடித்தல் மிக மெதுவாக நடை பெறும் வினை. எனவே அதன் வினை வேகத்தை நிர்ணயிப்பது கடினம். மேலும் அதன் வேக விதியை எழுதுவது கடினம், ஆகவே வினை வகையை நிர்ணயிப்பது கடினம்.
ii) 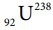 ன் கதிரியக்கச் செறிவு: முதல் வகை வினை ஆகும்.
ன் கதிரியக்கச் செறிவு: முதல் வகை வினை ஆகும்.
iii) 2A + 3B விளைபொருள் ; வினைவேகம்
k[A] 1/2 [B]2
வினை வகை = 1/2 + 2 = 2 ½ = 5/2
19. ஒரு வாயு நிலை வினையின் கிளர்வு ஆற்றல் 200 kJ mol-1. அவ்வினையின் அதிர்வுக் காரணி 1.6 × 1013 s-1. 600 K ல் வினைவேக மாறிலியைக் கணக்கிடுக. (e-40.09 = 3.8 × 10-18).
Ea = 200KJmol-1 = 200 ×103Jmol-1
A=1.6 × 1013s-1 T= 600k
R = 8.314Jk-1mol-1
e-40.09 = 3.8 × 10-18
k = Ae –Ea/RT
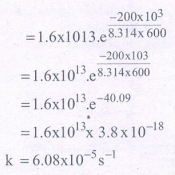
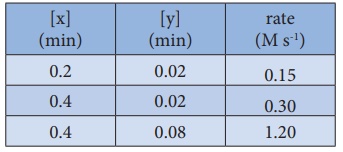
20. 2x + y → L என்ற வினைக்கு பின்வரும் விவரங்களிலிருந்து வேக விதியினைத் தீர்மானிக்கவும்.
தீர்வு:
வினைவேகம் = k [x] n [y]m
0.15 = k [0.2] n [0.02] m .................(1)
0.30 = k [0.4] n [0.02] m ..................(2)
1.20 = k [0.4] n [0.08] m ................(3)
(3)/2
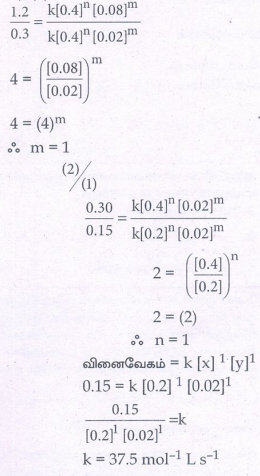
2 = (2)
ஃn = 1
வினைவேகம் = k [x] 1 [y]1
0.15 = k [0.2] 1 [0.02]1
0.15 / [0.2]1[0.02]1 = k
k = 37.5 mol-1 LS-1
21. ஒரு வேதி வினையின் வேகத்தினை, வினைபடு பொருட்களின் செறிவு எவ்வாறு பாதிக்கிறது என்பதை விளக்குக.
• வினைவேகம் α. வினைபடு பொருட்களின் செறிவு
• வினைவேகம் α. வினைபடும் மூலக்கூறுகளுக் கிடையே நடைபெறும் மோதல்களின் எண்ணிக்கை
• வினைபடு பொருட்களின் செறிவு α. வினைபடும் மூலக்கூறுகளுக்கிடையே நடைபெறும் மோதல்களின் எண்ணிக்கை
• எனவே வினைபடு பொருட்களின் செறிவு அதிகரிக்கும் போது, வினைபடும் மூலக்கூறு களுக்கிடையே நடைபெறும் மோதல்களின் எண்ணிக்கை அதிகரிக்கிறது. அதனால் வினையின் வேகமும் அதிகரிக்கிறது.
22. ஒரு வேதி வினையின் வேகத்தினை வினைபடு பொருட்களின் தன்மை எவ்வாறு பாதிக்கிறது என்பதை விளக்குக.
• ஒரு வேதி வினையில், வினைபடு பொருட்களில் உள்ள சில பிணைப்புகள் பிளவுறுதல் மற்றும் சில புதிய பிணைப்புகள் உருவாதல் ஆகியவற்றின் காரணமாக வினை விளை பொருட்கள் உருவாகின்றன.
• இச்செயல்முறையோடு தொடர்புடைய நிகர ஆற்றல் மாற்றம், வினைபடு பொருட்களின் தன்மையைப் பொறுத்து அமைகிறது.
• எனவே வெவ்வேறு வினைபடு பொருட்கள் வெவ்வேறு வினை வேகங்களைப் பெற்றுள்ளன.
• எ.கா: பெர்ரஸ் அம்மோனியம் சல்பேட் மற்றும் KMnO4 இடையே நிகழும் ஆக்சிஜனேற்ற ஒடுக்க வினை வேகமாக நடைபெறும் வினை. இவ்வினையில் KMnO4 ன் இளஞ்சிவப்பு நிறம் உடனே மறைகிறது.
• ஆனால் ஆக்சாலிக் அமிலம் மற்றும் KMnO4 இடையே நிகழும் ஆக்சிஜனேற்ற ஒடுக்க வினை மெதுவாக நடைபெறும் வினை 60°C வெப்ப நிலைக்கு சூடுபடுத்தும் போதே வினை நிகழ்ந்து, KMnO4ன் இளஞ்சிவப்பு நிறம் மறைகிறது.
• இவ்விரு வினைகளின் வேகத்தில் உள்ள வேறுபாடு, அவ்வினைகளின் வினைபடு பொருட்களான பெர்ரஸ் அம்மோனியம் சல்பேட் மற்றும் ஆக்சாலிக் அமிலத்தின் தன்மையைச் சார்ந்த து.
• எனவே ஒரு வேதி வினையின் வேகத்தினை வினைபடு பொருட்களின் தன்மை பாதிக்கிறது.
23. ஒரு முதல் வகை வினையின் வினைவேக மாறிலி 1.54 × 10-3S-1. அதன் அரைவாழ் காலத்தினைக் கண்ட றிக.
t ½ = 0.693 / k
k = 1.54 × 10-3 s-1; t1/2 = ?
= (0.693) / (1.54 . 10-3)
t1/2 = 450 S
24. SO2 Cl2 → SO2 + Cl2 என்ற வாயு நிலை ஒருபடித்தான வினையானது முதல் வகை வினை வேகவியலுக்கு உட்படுகிறது. அதன் அரை வாழ் காலம் 8.0 நிமிடங்கள். SOCl2 ன் செறிவானது அதன் ஆரம்ப அளவில் 1% ஆக குறைய ஆகும் காலத்தினை கணக்கிடுக.
தீர்வு: t1/2=8 நிமிடங்கள் t99% =?;
[A°] = 100% ; [A] =1%

t= 52.93 நிமிடங்கள்
25. A என்ற பொருள் சிதைவடையும் வினை ஒரு முதல் வகை வினையாகும். வினைபொருளில் சரி பாதி குறைய ஆகும் காலம் 60 விநாடிகள் எனில் அவ் வினையின் வினைவேக மாறிலியைக் கணக்கிடுக. 180 வினாடிகளுக்குப் பிறகு எஞ்சியிருக்கும் வினை பொருளின் (A) அளவினைக் கண்டறிக.
i) t ½ = 60 விநாடிகள் k = ?
t ½ = 0.6932 / t ½ = 0.6932 / 60
k = 0.01155 விநாடி-1
ii) t = 180 விநாடிகள் = 3 × 60 = 3t ½
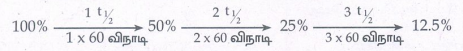
180 விநாடிகளுக்குப் பிறகு 12.5% வினைபொருள் A எஞ்சியிருக்கும்.
26. ஒரு பூஜ்ய வகை வினை 20 நிமிடங்களில் 20% நிறைவுறுகிறது. வினைவேக மாறிலியைக் கணக்கிடுக. அவ்வினை 80% நிறைவடைய ஆகும் காலம் எவ்வளவு?
தீர்வு:
i) A = 100 M, [A0] - [A] = 20M
பூஜ்ய வகை வினைக்கு,
k = ([Ao] – [A] / t )
k = (20M / 20min)
= 1M min-1
வினைவேக மாறிலி = 1M min-1
ii) 80% நிறைவடைய ஆகும் நேரம் கணக்கிடுதல் K=1M min-1
[Ao]= 100M, [Ao] - [A] = 80M, t = ?
t = ([Ao] – [A] / K )
k = (80M / 1M min-1)
= 80 min
t = 80 நிமிடங்கள்
27. ஒரு வினையின் கிளர்வு ஆற்றல் 22.5k Cal mol-1 1 மேலும் 40°C ல் வினைவேக மாறிலி 1.8 × 10-5 S-1 எனில் அதிர்வுக் காரணி A ன் மதிப்பைக் கண்ட றிக.
Ea = 22.5 K Cal mol-1 = 22500 Cal mol-1
k = 1.8 × 10-5, T = 40 + 273 = 313K
A = ? R = 1.987 Cal K-1 mol-1
இம்மதிப்புகளை இச்சமன்பாட்டில் பிரதியிட
Log A = log K + (Ea / 2303RT)
= log (1.8 × 10-5) + 22500 / 2.303 × 1.987 × 313
= log 1.8- 5 x 1 + 15.7089
= 0.2553 – 5 + 15.7089
= 0.2553 + 10.7089
log A = 10.9642
A = Antilog of 10.9642 (10.9642 ன் எதிர் மடக்கை )
A = 9.208 × 1010 மோதல்கள் விநாடி -1
28. பென்சீன் டையசோனியம் குளோரைடின் நீர்க் கரைசல் பின்வருமாறு சிதைவுறுகிறது.
C6H5N2Cl →C6H5Cl + N2.
சிதைவுறுதல் . வினையானது 10 g L-1 துவக்கச் செறிவுடன் நிகழ்த்தப்படுகிறது. 50°C வெப்பநிலையில் வெவ்வேறு கால அளவுகளில் உருவான N2 வாயுவின் கன அளவு பின்வரும் அட்டவணையில் தரப்பட்டுள்ளது.
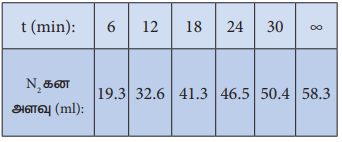
மேற்கண்டுள்ள வினை ஒரு முதல் வகை வினை எனக்காட்டுக. வினைவேக மாறிலியின் மதிப்பு என்ன?
தீர்வு :
ஒரு முதல் வகை வினைக்கு k = 2.303 / t log a / a - x
a = V∞ 58.3 ml ; (a - x) = (V∞-Vt)
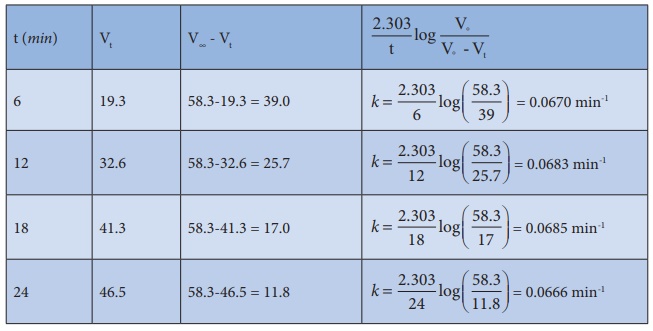
k மதிப்பானது மாறிலியாக அமைவதால், கொடுக்கப்பட்ட வினை ஒரு முதல் வகை வினையாகும் சராசரி k மதிப்பு = 0.0676 min-1.
29. பின்வரும் விவரங்களிலிருந்து ஹைட்ரஜன் பெராக்ஸைடு சிதைவுறுதல் ஒரு முதல் வகை வினை எனக்காட்டுக.

இங்கு t என்பது நேரம் (நிமிடங்களில்) மற்றும் V என்பது ஒரு குறிப்பிட்ட கன அளவு உடைய வினைக் கலவையுடன் தரம் பார்க்கும் போது தேவைப்படும் திட்ட KMnO4 கரைசலின் கன அளவு ஆகும்.
Vt = வினைபட்ட KMnO4ன் கனஅளவு
α. வினை புரியாமல் மீதமுள்ள H2O2ன் கன அளவு = (a -x) = [A]
t = 0 ⇒ VO = KMnO4 ன் கனஅளவு = H2O2ன் ஆரம்பு கனஅளவு = a = [A°]
k = 2.303/t log [a/(a-x)]
k = (2.303/t) log (V0 /Vt)
V0 = 46.1 ml.

k மதிப்பானது மாறிலியாக அமைவதால், கொடுக்கப்பட்ட வினை ஒரு முதல் வகை வினையாகும். சராசரி k மதிப்பு = 0.04355 min-1
30. ஒரு முதல் வகை வினை 50 நிமிடங்களில் 40% நிறைவடைகிறது. வினைவேக மாறிலியின் மதிப்பினைக் கண்டறிக. அவ்வினை 80% நிறைவடைய தேவையான காலம் எவ்வளவு?
தீர்வு
i) ஒரு முதல் வகை வினைக்கு k = 2.303/t log [A0]/[A]
[A°] = 100%, t = 50 நிமிடங்கள் என்க.
எனவே, [A] = 100 - 40 = 60
k = 0.010216 min-1 எனவே, வினைவே மாறிலி 0.010216 min-1
ii) t = ?, வினை 80% நிறைவடையும் போது,
[A] = 100 - 80 = 20%
k= 0.010216 min-1
t = (2.303 / 0.010216) log (100 / 20)
t = 157.58 min
t = 157.58 min 80% வினை நிறைவடைய ஆகும் காலம் 157.58 min.