வேதிவினை, வேகவியல் - மோதல் கொள்கை | 12th Chemistry : UNIT 7 : Chemical Kinetics
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 7 : வேதிவினை, வேகவியல்
மோதல் கொள்கை
மோதல் கொள்கை
1916ல் மேக்ஸ் ட்ராட்ஸ் என்பவராலும் 1918ல் வில்லியம் லூயிஸ் என்பவராலும் இக்கொள்கை தனித்தனியே முன்மொழியப்பட்டது. மோதல் கொள்கையானது வாயுக்களின் இயக்கவியற்கொள்கையை அடிப்படையாகக் கொண்டது. இக்கொள்கையின்படி, வினைபடு பொருட்களின் மூலக்கூறுகளுக்கிடையே மோதல் நிகழ்வதால் வேதி வினைகள் நிகழ்கின்றன. பின்வரும் வினையினைக் கருத்திற் கொண்டு மோல் கொள்கையினை நாம் புரிந்துக் கொள்வோம்.
A2 (g) + B2 (g) → 2AB (g)
A2 மற்றும் B2 ஆகிய மூலக்கூறுகளுக்கிடையே நிகழும் மோதலின் காரணமாக அவைகளுக்கிடையே வேதி வினை நிகழ்வதாக நாம் கருதினால், அவ்வினையின் வேகமானது ஒரு வினாடியில் அம்மூலக்கூறுகளுக்கிடையே நடைபெறும் மோதல்களின் எண்ணிக்கைக்கு நேர் விகிதத்திலிருக்கும்.
வினைவேகம் 0 ஒரு லிட்டர் கன அளவில் ஒரு வினாடியில் மோதலுறும் மூலக்கூறுகளின் எண்ணிக்கை (மோதல் வீதம்)
மோதல்களின் எண்ணிக்கையானது A2 மற்றும் B2 ஆகியனவற்றின் செறிவுகளுக்கு நேர்விகிதத்திலிருக்கும்.
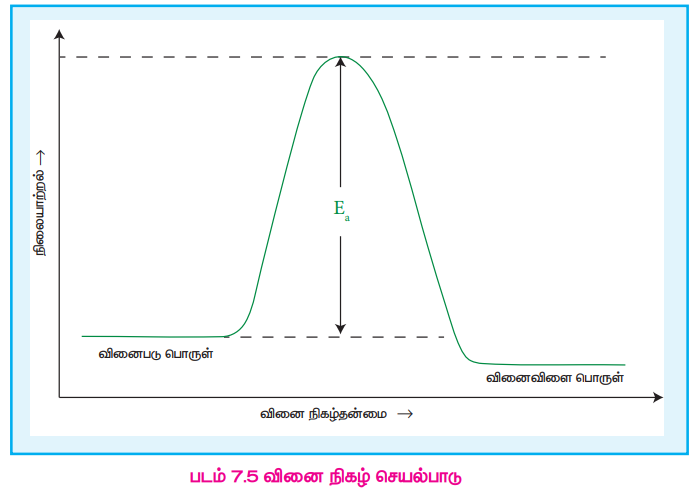
மோதல் வீதம் oc [A2][B2]
மோதல் வீதம் =Z[A2] [B2]
இங்கு Z என்பது மாறிலி
வாயுக்களில் மோதல் வீதத்தினை வாயுக்களின் இயக்கவியற் கொள்கையின் அடிப்படையில் கணக்கிட இயலும். அறை வெப்பநிலை (298K)ல் மற்றும் 1 atm அழுத்தத்தில் ஒவ்வொரு மூலக்கூறும் ஒரு வினாடியில் 109 மோதல்களுக்கு உட்படுவதாகக் கருதினால் அதாவது 10-9 வினாடியில் 1 மோதல் நடப்பதாகக் கருதுவோம். ஒவ்வொரு மோதலும் வினை நிகழ காரணமாக அமையுமேயானால் வினையானது 10-9 வினாடியில் நிறைவடைந்திருக்க வேண்டும். ஆனால் நடைமுறையில் இவ்வாறு நிகழ்வதில்லை. இதிலிருந்து அனைத்து மோதல்களும் வினை நிகழ காரணமாக அமைவதில்லை என அறிய முடிகிறது. வினை நிகழ வேண்டுமெனில், மோதலுறும் மூலக்கூறுகள் ஒரு குறிப்பிட்ட அளவு குறைந்தபட்ச ஆற்றலைப் பெற்றிருக்க வேண்டும் அவ்வாற்றல் கிளர்வு ஆற்றல் என அழைக்கப்படுகிது. கிளர்வு ஆற்றலை விட குறைவான ஆற்றலைக் கொண்டுள்ள மூலக்கூறுகளுக்கிடையே மோதல் நிகழும் போது அவைகள் எவ்வித மாற்றங்களுக்கும் உட்படுவதில்லை ஆதலால் அம்மோதலின் காரணமாக வினையேதும் நிகழ்வதில்லை.
வினைநிகழ காரணமாக அமையும் மோதல்களின் விகிதம் (f) ஆனது பின்வரும் சமன்பாட்டால் ஏற்படுகிறது.
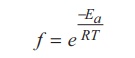
இங்கு (f) என்பது மோதல் காரணி எனப்படுகிறது. இதன் எண் மதிப்பின் அளவினை புரிந்து கொள்ளும் பொருட்டு 300K வெப்பநிலையில் 100 kJ mol-1 கிளர்வு ஆற்றலுடைய ஒரு வினைக்கு f ன் மதிப்பை நாம் கணக்கிடுவோம்.
- ( 100×103J mol-1 / 8.314J K-1 mol-1 × 300K)
f= e
f = e-40 = 4 × 10-18
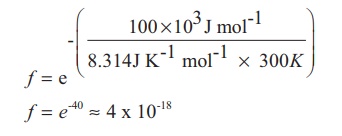
எனவே, 10-18 மோதல்கள் நிகழும் போது நான்கு மோதல்கள் மட்டுமே வினைபடுபொருட்களை வினைவிளைபொருளாக மாற்றுவதற்குத் தேவையான ஆற்றலைப் பெற்றுள்ளன என அறிகிறோம்.
இந்த விகிதமானது வினைபடுபொருட்களின் திசைப்போக்கினைப் (Orientation) பொருத்து மேலும் குறையும் அதாவது வினைபடு பொருட்கள் வினை நிகழத் தேவையான ஆற்றலைப் பெற்றிருந்தாலும் வினை இடைநிலை உருவாக சாதகமான திசைப் போக்கில் வினைபடு பொருட்களின் மோதல் நிகழ்ந்தால் மட்டுமே அவைவினைபுரியும்
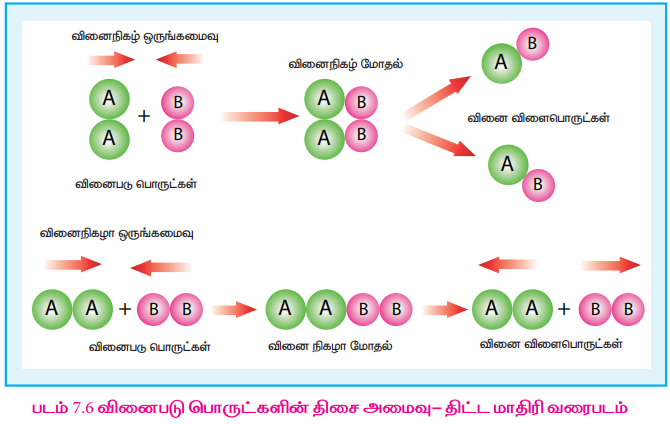
படம் 7.6 ஆனது வினை நிகழ்வதில், வினைபடு பொருட்களின் திசைப் போக்கின் முக்கியத்துவத்தினை விளக்குகிறது.
தகுந்த திசைப்போக்குடன் அமைந்துள்ள வினை நிகழ காரணமாக உள்ள மோதல்களின் எண்ணிக்கையை இட அமைவுக் காரணி P தருகிறது.
ppp வினைவேகம் = px f x மோதல் வீதம்
அதாவது வினைவேகம் = p x e –Ea/RTx Z [A2][B2] ...(1)
வேகவிதிப்படி,
வினைவேகம் = k [A2] [B2 ] ..(2)
இங்கு k என்பது வினைவேக மாறிலி
சமன்பாடு (1) மற்றும் (2) ஐ ஒப்பிட, வினைவேக மாறிலி k ஆனது
k = p Ze–Ea/RT
