புத்தக வினாக்கள் மற்றும் முக்கிய கேள்வி பதில்கள் | வேதியியல் - திட நிலைமை : பின்வரும் வினாக்களுக்கு விடையளிக்க | 12th Chemistry : UNIT 6 : Solid State
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 6 : திட நிலைமை
திட நிலைமை : பின்வரும் வினாக்களுக்கு விடையளிக்க
வேதியியல் : திட நிலைமை
II. பின்வரும் வினாக்களுக்கு விடையளி
1. அலகு கூட்டினை வரையறு.
‘ஒரு படிக திடப்பொருளில், மீண்டும் மீண்டும் தோன்றக்கூடிய, முப்பரிமாண எளிய அடிப்படை வடிவமைப்பு அலகுக் கூடு எனப்படும்.
2. அயனிப்படிகங்களின் ஏதேனும் மூன்று பண்புகளைக் கூறுக.
• அதிக உருகுநிலையைப் பெற்றுள்ளன.
• திட நிலைமையில் மின்சாரத்தை கடத்துவதில்லை.
• உருகிய அல்லது கரைசல் நிலையில் மின்சாரத்தை கடத்துகின்றன.
3. படிக திண்மங்களை படிக வடிவமற்ற திண்மங்களிலிருந்து வேறுபடுத்துக.
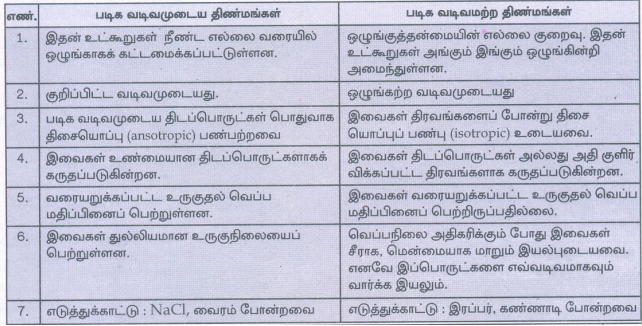
படிக வடிவமுடைய திண்மங்கள்
1. இதன் உட்கூறுகள் நீண்ட எல்லை வரையில் ஒழுங்காகக் கட்டமைக்கப்பட்டுள்ளன.
2. குறிப்பிட்ட வடிவமுடையது.
3. படிக வடிவமுடைய திடப்பொருட்கள் பொதுவாக திசையொப்பு (ansotropic) பண்பற்றவை
4. இவைகள் உண்மையான திடப்பொருட்களாகக் கருதப்படுகின்றன.
5. வரையறுக்கப்பட்ட உருகுதல் வெப்ப மதிப்பினைப் பெற்றுள்ளன.
6. இவைகள் துல்லியமான உருகுநிலையைப் பெற்றுள்ளன.
7. எடுத்துக்காட்டு : NaCl, வைரம் போன்றவை
படிக வடிவமற்ற திண்மங்கள்
1. ஒழுங்குத்தன்மையின் எல்லை குறைவு. இதன் உட்கூறுகள் அங்கும் இங்கும் ஒழுங்கின்றி அமைந்துள்ளன.
2. ஒழுங்கற்ற வடிவமுடையது
3. இவைகள் திரவங்களைப் போன்று திசை யொப்புப் பண்பு (isotropic) உடையவை.
4. இவைகள் திடப்பொருட்கள் அல்லது அதி குளிர் விக்கப்பட்ட திரவங்களாக கருதப்படுகின்றன.
5. இவைகள் வரையறுக்கப்பட்ட உருகுதல் வெப்ப மதிப்பினைப் பெற்றிருப்பதில்லை.
6. வெப்பநிலை அதிகரிக்கும் போது இவைகள் சீராக, மென்மையாக மாறும் இயல்புடையவை. எனவே இப்பொருட்களை எவ்வடிவமாகவும் வார்க்க இயலும்.
7. எடுத்துக்காட்டு ; இரப்பர், கண்ணாடி போன்றவை
4. பின்வரும் திண்மங்களை வகைப்படுத்துக.
அ) P4
ஆ) பித்தளை
இ) வைரம்
ஈ) NaCl
உ) அயோடின்
திண்மம் : வகை
அ) P4 : மூலக்கூறு படிகம்
ஆ) பித்தளை - உலோகப்படிகம்
இ) வைரம் - சகப்பிணைப்பு படிகம்
ஈ) NaCl - அயனிப் படிகம்
உ) அயோடின் - மூலக்கூறு படிகம்
5. ஏழு வகையான அலகு கூடுகளை சுருக்கமாக விளக்குக.
முதல்நிலை எளிய அலகுக்கூட்டில் ஏழு படிக அமைப்புகள் காணப்படுகின்றன. அவையாவன, கனசதுரம், சாய்சதுரம், அறுமுக வடிவம், நான்முக வடிவம், ஆர்த்தோ சாய்சதுரம், ஒற்றைச் சரிவு வடிவம், முச்சரிவு வடிவம், இவ்வமைப்புகள் அவைகளின் படிக அச்சுகள் மற்றும் கோணங்களில் வேறுபடுகின்றன.
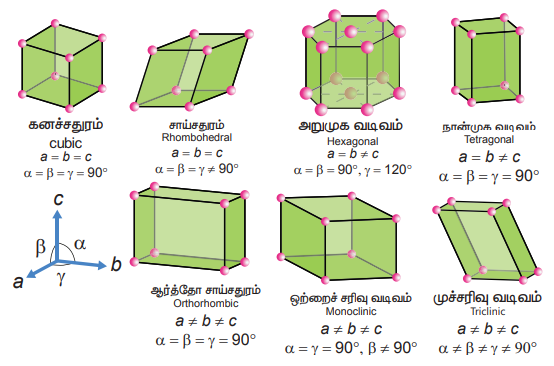
கனசதுரம்
a = b = c
α = β = ɤ = 90°
சாய்சதுரம்
a = b = c
α = β = ɤ ≠ = 90°
அறுமுக வடிவம்
a = b ≠ c
α = β = 90° , ɤ = 120°
நான்முக வடிவம்
a = b ≠ c
α = β = ɤ = 90°
ஆர்த்தோ சாய்சதுரம்
a ≠ b ≠ c
α = β = ɤ = 90°
ஒற்றைச்சரிவு வடிவம்
a ≠ b ≠ c
α = ɤ = 90° , β = 90°
முச்சரிவு வடிவம்
a ≠ b ≠ c
α ≠ ≠ ɤ
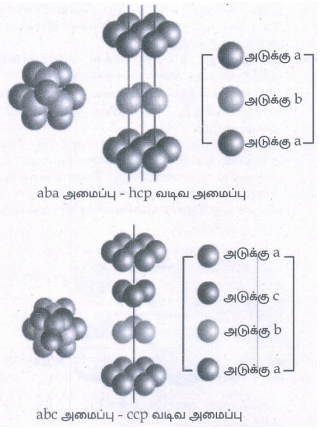
6. அறுங்கோண நெருங்கிப் பொதிந்த அமைப்பினை (hcp) கனசதுர நெருங்கிப் பொதிந்த அமைப்பிலிருந்து (ccp) வேறுபடுத்துக.
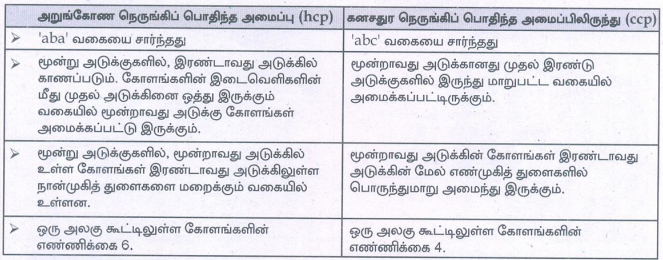
அறுங்கோண நெருங்கிப் பொதிந்த அமைப்பு (hcp)
• 'aba' வகையை சார்ந்தது
• மூன்று அடுக்குகளில், இரண்டாவது அடுக்கில் காணப்படும். கோளங்களின் இடைவெளிகளின் மீது முதல் அடுக்கினை ஒத்து இருக்கும் வகையில் மூன்றாவது அடுக்கு கோளங்கள் அமைக்கப்பட்டு இருக்கும்.
• மூன்று அடுக்குகளில், மூன்றாவது அடுக்கில் உள்ள கோளங்கள் இரண்டாவது அடுக்கிலுள்ள நான்முகித் துளைகளை மறைக்கும் வகையில் உள்ளன.
• ஒரு அலகு கூட்டிலுள்ள கோளங்களின் எண்ணிக்கை 6.
கனசதுர நெருங்கிப் பொதிந்த அமைப்பிலிருந்து (ccp)
• 'abc' வகையை சார்ந்தது
• மூன்றாவது அடுக்கானது முதல் இரண்டு அடுக்குகளில் இருந்து மாறுபட்ட வகையில் அமைக்கப்பட்டிருக்கும்.
• மூன்றாவது அடுக்கின் கோளங்கள் இரண்டாவது அடுக்கின் மேல் எண்முகித் துளைகளில் பொருந்துமாறு அமைந்து இருக்கும்.
• ஒரு அலகு கூட்டிலுள்ள கோளங்களின் எண்ணிக்கை 4.
7. நான்முகி மற்றும் எண்முகி வெற்றிடங்களை வேறுபடுத்துக.
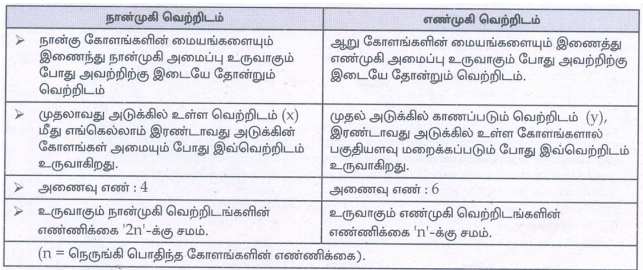
நான்முகி வெற்றிடம்
• நான்கு கோளங்களின் மையங்களையும் இணைந்து நான்முகி அமைப்பு உருவாகும் போது அவற்றிற்கு இடையே தோன்றும் வெற்றிடம்
• முதலாவது அடுக்கில் உள்ள வெற்றிடம் (x) மீது எங்கெல்லாம் இரண்டாவது அடுக்கின் கோளங்கள் அமையும் போது இவ்வெற்றிடம் உருவாகிறது.
• அணைவு எண் : 4
• உருவாகும் நான்முகி வெற்றிடங்களின் எண்ணிக்கை '2n'-க்கு சமம்.
எண்முகி வெற்றிடம்
• ஆறு கோளங்களின் மையங்களையும் இணைத்து எண்முகி அமைப்பு உருவாகும் போது அவற்றிற்கு இடையே தோன்றும் வெற்றிடம்.
• முதல் அடுக்கில் காணப்படும் வெற்றிடம் (y), இரண்டாவது அடுக்கில் உள்ள கோளங்களால் பகுதியளவு மறைக்கப்படும் போது இவ்வெற்றிடம் உருவாகிறது.
• அணைவு எண் : 6
• உருவாகும் எண்முகி வெற்றிடங்களின் எண்ணிக்கை 'n'-க்கு சமம்.
(n = நெருங்கி பொதிந்த கோளங்களின் எண்ணிக்கை).
8. புள்ளி குறைபாடுகள் என்றால் என்ன?
படிகத் திண்மங்களில் இடப்பெயர்ச்சியான அணுக்கள், அல்லது அதிக எண்ணிக்கையிலான அணுக்கள் அல்லது நிரப்பப்படாத அணுக்கள் ஆகியவற்றினால் ஏற்படும் குறைபாடுகள் புள்ளி குறைபாடுகள் எனப்படும்.
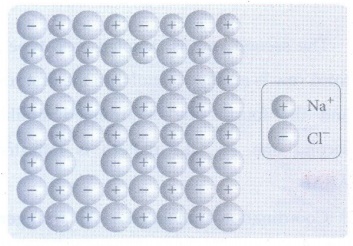
9. ஷாட்கி குறைபாட்டினை விளக்குக.
அயனி படிகங்களின் அணிக்கோவை புள்ளிகளில் சம எண்ணிக்கையில் நேர் மற்றும் எதிர் அயனிகள் இல்லாமல் வெற்றிடம் காணப் படுவதால் ஏற்படும் படிகக் குறைபாடு ஷாட்கி குறைபாடு எனப்படும்.
• இக்குறைபாடு படிகத்தின் வேதிவினைக்கூறு விகிதத்தினை மாற்றியமைப்பதில்லை.
• நேரயனியின் உருவளவ, , எதிரயனியின் உருவளவ, டன் ஏறத்தாழ ஒத்திருக்கும் அயனிகளைக் கொண்ட படிகங்களில் இக் குறைபாடு காணப்படுகிறது.
• படிகங்களில் அதிக அளவு ஷாட்கி குறைபாடு காணப்பட்டால் அவைகளின் அடர்த்தி குறையும்.
• ஷாட்கி குறைபாடானது, படிகங்களில் அணுக்கள் அல்லது அயனிகள் படிக அணிக்கோவைத் தளம் முழுமைக்கும் நகர்வதற்கு ஒரு எளிய வழியினை ஏற்படுத்துகிறது.
• எ.கா. சோடியம் குளோரைடு
10. உலோகம் அதிகமுள்ள குறைபாடு மற்றும் உலோகம் குறைவுபடும் குறைபாடுகளை எடுத்துக் காட்டுடன் விளக்குக.
உலோகம் அதிகமுள்ள குறைபாடு:
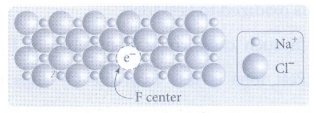
• படிகங்களில், எதிர் அயனிகளோடு ஒப்பிடும் போது உலோக அயனிகளின் எண்ணிக்கை அதிகமாக காணப் படுவதால் உலோகம் அதிகமுள்ள குறைபாடு ஏற்படுகிறது.
• எ.கா. NaCl, KCIL
• எதிர அயனிகளால் ஏற்படும் வெற்றிடங்களுக்குச் சமமான எண்ணிக்கையில் கூடுதலான உலோக அயனிகள் அல்லது கூடுதலான நேர் அயனிகள் மற்றும் எலக்ட்ரான் ஆகியன இடைச் செருகல் நிலைகளில் காணப் படுவதால் மின் நடுநிலைத் தன்மை பராமரிக்கப்படுகிறது.
• எடுத்துக்காட்டாக சோடியம் குளோரைடு படிகங்களைச் சோடியத்தின் ஆவியுடன் வெப்பப் படுத்தும் போது Na+ அயனிகள் உருவாகின்றன. மேலும் அவை படிகத்தின் புறப்பரப்பில் படிகின்றன.
• இந்நிலையில் குளோரைடு அயனிகள் அணிக்கோவை புள்ளிகளிலிருந்து இடம் பெயர்ந்து படிகத்தின் புறப் பரப்பிற்கு விரவி Na+ அயனிகளுடன் இணைகிறது.
• மேலும் ஆவி நிலையில் உள்ள சோடியத்தால் இழக்கப்பட்ட எலக்ட்ரான்கள் படிக அணிக்கோவைத் தளத்தில் ஊடுருவி (Cl-) அயனிகளால் ஏற்படுத்தப்பட்ட வெற்றிடத்தில் இடம் கொள்கின்றன.
• இத்தகைய இணையாகாத தனித்த எலக்ட்ரான்களால் நிரப்பப்பட்ட எதிர் அயனி வெற்றிடங்கள் F மையங்கள் எனப்படும்.
• எனவே அதிகப்படியான Na+ அயனிகளைக் கொண்டுள்ள NaCl வாய்பாடானது Na1+XCl என குறிப்பிடப்படுகிறது.
உலோகம் குறைவுபடும் குறைபாடு:

• எதிர் அயனிகளைக் காட்டிலும் நேர் அயனிகளின் எண்ணிக்கை குறைவாகக் காணப்படுவதால் ஏற்படும் குறைபாடு உலோகம் குறைவுபடும் குறைபாடு எனப்படும்.
• மாறுபடும் ஆக்சிஜனேற்ற நிலைகளைக் கொண்ட நேர் அயனிகள் உள்ள படிகங்களில் இக்குறைபாடு காணப்படுகிறது. எ.கா. FeO
• இதில் படிக அணிக்கோவை புள்ளிகளில் சில FeO அயனிகள் இடம் பெற்றிருப்பதில்லை .
• இந்நேர்வில் மின் நடுநிலைத் தன்மையை பராமரிக்கும் பொருட்டு படிகத்தில் இடம் பெறாத Fe2+ அயனிகளின் எண்ணிக்கையைப் போல இருமடங்கு எண்ணிக்கையில் படிகத்திலுள்ள மற்ற Fe2+ அயனிகள் Fe2+ அயனிகளாக ஆக்சிஜனேற்றமடைகின்றன.
• ஒட்டுமொத்த O2- அயனிகளின் எண்ணிக்கை யோடு ஒப்பிடும் போது ஒட்டு மொத்த Fe2+ மற்றும் Fe3+ அயனிகளின் எண்ணிக்கையின் கூடுதல் குறைவாக இருக்கும்.
• சோதனையின் மூலம் கண்டறியப்பட்ட ஃபெர்ரஸ் ஆக்சைடின் வாய்பாடு FeXO என குறிப்பிடப்படுகிறது. இங்கு என் மதிப்பு 0.93 முதல் 0.98 வரை இருக்கலாம்.
11. Fcc அலகு கூட்டில் காணப்படும் அணுக்களின் எண்ணிக்கையைக் கணக்கிடுக.
Fcc அலகு கூட்டில் காணப்படும் அணுக்களின் எண்ணிக்கை
= (Nc / 8 + Nf / 2)
= (8 / 8 + 6 / 2)
= 1 + 3 = 4
12. AAAA, ABABA மற்றும் ABC ABC வகை முப்பரிமாண நெருங்கிப் பொதிந்த அமைப்புகளை தகுந்த படத்துடன் விளக்குக.
எளிய கனசதுர அமைப்பு : (AAAA அமைப்பு)
• முப்பரிமாணத்தில், ஒவ்வொரு அடுக்கும் , AAAA வகை இரு பரிமாண அமைப்பினை ஒத்திருக்குமாறு ஒரு அமைப்பினை உருவாக்கினால், அவ்வாறு உருவாகும் அமைப்பு எளிய கனசதுர அமைப்பாகும்.
• இரண்டாம் அடுக்கில் அமையும் அனைத்துக் கோளங்களும் முதல் அடுக்கில் அமையப் பெற்ற கோளங்களுக்கு நேராக அவற்றின் மேற்புறத்தில் அமைகின்றன. எனவே இதன் விளைவாக உருவாகும் அமைப்பில் அனைத்து அடுக்குகளும் ஒரே மாதிரியாக உள்ளன.
• வெவ்வேறு அடுக்குகளில் காணப்படும் அனைத்து கோளங்களும், அனைத்து திசை களிலும் ஒரே வரிசையில் அமைகின்றன. இவ்வாறான அமைப்பில் ஒரு அலகுக்கூடு எளிய கனசதுர அமைப்பினைப் பெறுகிறது.
• எளிய கனசதுர அமைப்பில் உள்ள ஒவ்வொரு கோளமும், தான் அமைந்துள்ள அடுக்கில் உள்ள ஒரு கோளத்தினையும், கீழ் அடுக்கில் உள்ள ஒரு கோளத்தினையும் சேர்த்து மொத்த 7 கோளங் களைத் தொட்டு கொண்டுள்ளது. எனவே எளிய கனசதுர அமைப்பில் கோளத்தின் அணைவு எண் 6 ஆகும்.
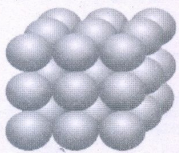
பொருள் மைய கனசதுர அமைப்பு : (ABABAB.... அமைப்பு)
• இந்த அமைப்பில், முதல் வரிசையான வகை A *வரிசையில் உள்ள கோளங்கள் ஒன்றையொன்று நேரடியாக தொட்டுக் கொள்ளாமல் சிறிது விலகி அமைந்துள்ள
• இந்த A அடுக்கில் உள்ள கோளங்களுக்கு இடையே உள்ள இடைவெளியில் இரண்டாம் அடுக்கு உருவாக்கப்படுகிறது.
• மூன்றாவது அடுக்கு முதல் அடுக்கினை ஒத்திருக்குமாறு அமைக்கப்படுகிறது.
• அதாவது படிகம் முழுமையும் இந்த அமைப் பானது ABAB... என மீண்டும் மீண்டும் அமையுமாறு உள்ளது.
• ஒரு குறிப்பிட்டக் கோளம், அதற்கு மேல் அடுக்கில் உள்ள நான்கு கோளங்களையும் கீழ் அடுக்கில் உள்ள நான்கு கோளங்களையும் சேர்த்து மொத்தம் 8 கோளங்களை தொட்டு கொண்டிருப்பதால் அக்கோளத்தின் அணைவு எண் 8 ஆகும்.
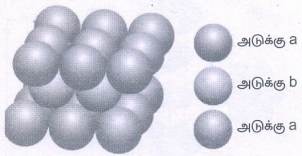
முகப்பு மைய கனசதுர அமைப்பு : (ABC ABC ABC.... அமைப்பு)
• இத்தகைய அமைப்புகளில், முதல் அடுக்கானது, இரு பரிமாணத்தில் ABAB வரிசை முறையில் அமைக்கப்பட்டது போன்று அமைக்கப்படுகிறது.
• இரண்டாவது அடுக்கின் மேல் எண்முகித் துளைகளில் பொருந்துமாறு மூன்றாவது அடுக்கின் கோளங்களை அடுக்கலாம். இவ்வாறு அமைக்கும் போது மூன்றாவது அடுக்கு முதல் இரண்டு அடுக்குகள் 'a' மற்றும் 'b' யிலிருந்து மாறுபட்டிருக்கும். இம்மூன்றாவது அடுக்கு 'c' என குறிக்கப்படுகிறது. தொடர்ந்து abc abc ..... என்ற அமைப்பில் அடுத்தடுத்த அடுக்குகளால் உருவாகும் இவ்வமைப்பு கனசதுர நெருங்கி பொதிந்த அமைப்பு (ccp) எனப்படும்.
• hcp மற்றும் ccp ஆகிய இரு அமைப்புகளிலும் ஒரு கோளத்தைச் சுற்றி அதே அடுக்கில் ஆறு கோளங்கள், மேல் உள்ள அடுக்கில் மூன்று கோளங்கள் மற்றும் கீழ் உள்ள அடுக்கில் மூன்று கோளங்கள் தொட்டுக் கொள்வதால் அதன் அணைவு எண் 12 ஆகும்.
• இதுவே மிகச்சிறந்த நெருங்கிப் பொதிந்த அமைப்பு.
• கன சதுர நெருங்கி பொதிந்த அமைப்பு முகப்பு மைய கன சதுர அலகு கூட்டினை அடிப்படையாகக் கொண்டது.
13. அயனிப் படிகங்கள் ஏன் கடினமாகவும், உடையும் தன்மையினையும் பெற்றுள்ளன?
• அயனிப் படிகங்களில் நேர் அயனிகள் மற்றும் எதிர் அயனிகள் வலிமையான நிலைமின்னியல் கவர்ச்சி விசையால் ஒன்றோடொன்று இறுக்கமாக பிணைத்து வைக்கப்பட்டுள்ளன.
• எனவே அயனி படிகங்கள் கடினமாகவும், உடையும் தன்மை யினையும் பெற்றுள்ளன.
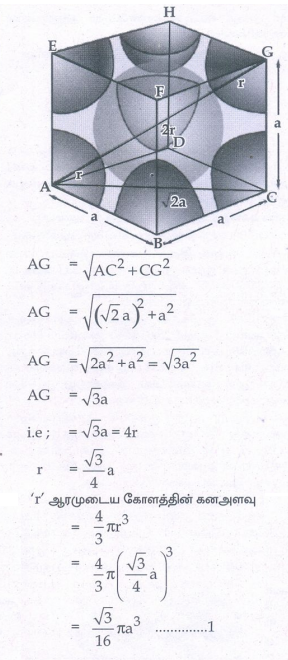
14. பொருள் மைய கனச்சதுர அமைப்பில் பொதிவுத் திறன் சதவீதத்தினைக் கணக்கிடுக.
பொதிவுத்திறன் :
இவ்வமைப்பில் படத்தில் காட்டியுள்ளவாறு கோளங்கள் கனச்சதுரத்தின் முதன்மை மூலை விட்டத்தின் வழியே தொட்டுக் கொண்டுள்ளன.
ln ∆ ABC
Ac2 = AB2 + BC2
AC = √AB2 + BC2
AC = √a2 + a2
= √2a2 = √2a
In ∆ ACG.
AG2 = AC2 + CG22
bcc வடிவமைப்பில் ஒரு அலகுக் கூட்டில் காணப் படும் கோளங்களின் எண்ணிக்கை இரண்டு என நாம் அறிவோம். எனவே அனைத்துக் கோளங்களின் கன அளவு
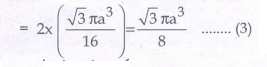
பொதிவுத்திறன் அல்லது பொதிவு பின்னம் =
ஒரு அலகுக்கூட்டில் உள்ள கோளங்களின் மொத்த கன அளவு / அலகுக்கூட்டின் கன அளவு × 100
ஃபொதிவு பின்னம் =
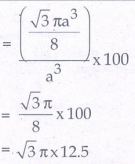
=1.732 × 3.14 × 12.5 = 68%
• அதாவது ஒரு அலகுக் கூட்டின் மொத்த கன அளவில் 68% கன அளவு கோளங்களால் நிரம்பியுள்ளது. எளிய கனச்சதுர அமைப்பினைக் காட்டிலும் இம்முறையில், அணுக்களால் அதிக கன அளவு நிரப்பப்பட்டுள்ளதால் வெற்றிடம் குறைவாக உள்ளது.
15. சதுர நெருங்கிப் பொதிந்த இரு பரிமாண அடுக்கில் ஒரு மூலக்கூறின் அணைவு எண் என்ன?
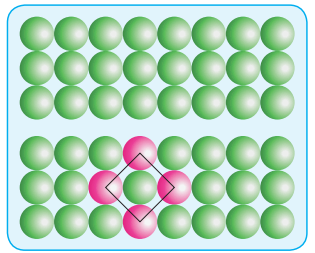
• இவ்வகை அமைப்பில், ஒவ்வொரு கோளமும் தனக்கு அருகாமையில் சூழ்ந்துள்ள நான்கு கோளங்களைத் தொட்டு கொண்டிருக்கும். எனவே கோளத்தின் அணைவு எண் 4 ஆகும்.
• தொட்டுக் கொண்டிருக்கும் நான்கு கோளங்களின் மையங்களையும் இணைத்தால் ஒரு சதுரம் உருவாகிறது.
• எனவே இது சதுர நெருங்கிப் பொதிந்த அமைப்பு எனப்படும்.
16. சோதனை முடிவுகளில் அடிப்படையில் நிக்கல் ஆக்ஸைடின் வாய்ப்பாடு Ni0.96O1.00 . என கண்டறியப்பட்டது. இதில் Ni2+ மற்றும் Ni3+ அயனிகள் எவ்விகிதத்தில் காணப்படுகின்றன.
• Ni0.96O1.00 என்ற வாய்பாட்டிலிருந்து ஒரு மூலக்கூறில் ஏற்படும் Ni2+ இழப்பு = 1-0.96 = 0.04
• ஒரு Ni2+ அயனி இழப்பிற்கு இரண்டு Ni3+ அயனிகள் சேர்க்கப்படுகிறது.
• எனவே 0.04 Ni2+ அயனி இழப்பிற்கு 2 × 0.04 Ni3+அயனிகள் சேர்க்கப்படுகின்றன.
ஒரு NiO மூலக்கூறில் உள்ள Ni3+ அயனி = 2 × 0.04 = 0.08
ஒரு மூலக்கூறு NiO வில் உள்ள மொத்த Ni2+ மற்றும் Ni3+அயனிகளின் எண்ணிக்கை = 0.96
= 0.96 Ni அயனிகளில் 0.08 Ni3+ அயனிகள் மட்டுமே உள்ளன.
எனவே Ni3+ அயனிகளின் சதவீதம்
= (0.08 / 0.96) × 100 = 8.3%
Ni3+ அயனிகளின் சதவீதம் = 100 -8.3 = 91.7%
17. அணைவு எண் என்றால் என்ன ? bcc அமைப்பில் உள்ள ஒரு அணுவின் அணைவு எண் யாது?
• படிகத்தில் ஒரு குறிப்பிட்ட துகளைச் சூழ்ந்து காணப்படும் அருகாமை துகள்களின் எண்ணிக்கை அக்குறிப்பிட்ட துகளின் அணைவு எண் என அழைக்கப்படுகிறது.
• bcc அமைப்பின் அணைவு எண் 8.
18. ஒரு தனிமம் bcc அமைப்பினை பெற்றுள்ளது. அதன் அலகு கூட்டின் விளிம்பு நீளம் 288pm. அத் தனிமத்தின் அடர்த்தி 7.2gcm-3 எனில் 208g தனிமத்தில் காணப்படும் அணுக்களின் எண்ணிக்கை யாது?
bcc அமைப்பு ஒரு அலகுக்கூட்டில் காணப்படும் மொத்த அணுக்களின் எண்ணிக்கை n = 2
a = 288 pm = 288 × 10-12 m = 288 × 10-10 cm
= 2.88 × 10-8 cm
NA = 6.023 × 1023;
ρ = 7.2 gcm-3;
w = 208g;
M = ?
ρ = nM / a3NA
ஃ M = ρa3NA / n
7.2 × (2.88×10-8)3
× 6.023 × 1023 / 2
M =51.79gmol-1
மோல்களின் எண்ணிக்கை
n = (W / M) = (208 ? 51.79) = 4moles
அணுக்களின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை × அவோகேட்ரோ எண்
= n × NA
= 4 × 6.023 × 1023
= 2.4092 × 1024 அணுக்கள்
19. அலுமினியமானது கனச்சதுர நெருங்கிப் பொதிந்த அமைப்பில் படிகமாகிறது. அதன் உலோக ஆரம் 125pm அலகு கூட்டின் விளிம்பு நீளத்தைக் கணக்கிடுக.
கனசதுர நெருங்கிப் பொதிந்த அமைப்பு முகப்பு மைய கனசதுர அலகுக் கூட்டினை அடிப்படை யாகக் கொண்டது.
fcc அலகு கூட்டிற்கு ஆரம் r = a √2 / 4
r =125pm a = ?
ஃ r = a √2 / 4 ஃ a = 4r / √2
= 4 × 125 / 1.414 a = 353.6pm
20. 10-2mol சதவீதத்தில் ஸ்ட்ரான்சியம் குளோரைடானது NaCl படிகத்தில் மாசாக சேர்க்கப் படுகிறது. நேர் அயனி வெற்றிடத்தின் செறி வினைக் கண்டறிக,
• NaCl படிகத்தில் மாசாக சேர்க்கப்படும் ஒவ்வொரு Sr2+ அயனிக்கும், இரண்டு Na+ அயனிகள் நீக்கப்படுகின்றன. காரணம் ஒரு Sr2+ அயனியின் மின் சுமை = இரண்டு Na+ அயனியின் மின்சுமை.
• Sr2+ அயனி ஒரு Na+அயனியின் இடத்தை நிரப்புகிறது. மற்றொரு Na+ அயனியின் இடம் வெற்றிடமாகிறது.
• எனவே ஒரு Sr2+ அயனி ஒரு Na+ அயனி வெற்றிடத்தை உருவாக்குகிறது.
• எனவே நேர் அயனி வெற்றிட எண்ணிக்கை = சேர்க்கப்பட்ட Sr2+ அயனிகளின் எண்ணிக்கை
• Sr2+ன் மோல் சதவீதம் = 10-2
ஃ Sr2+ன் மோல் எண்ணிக்கை = 10-2 / 100 = 10-4 மோல்கள்
அயனிகளின் எண்ணிக்கை = மோல்களின் எண்ணிக்கை × அவகாட்ரோ எண்
= n × NA
= 10-4 × 6.023 × 1023
= 6.023 × 1019 Sr2+ அயனிகள்
ஃநேர் அயனி வெற்றிட எண்ணிக்கை = சேர்க்கப்பட்ட Sr2+ அயனிகளின் எண்ணிக்கை
= 6.023 × 1019
21. KF ஆனது சோடியம் குளோரைடைப் போன்று fcc அமைப்பில் படிகமாகிறது. KF ன் அடர்த்தி 2.48 gcm-3 எனில் KF ல் உள்ள K+ மற்றும் F-அயனிகளுக்கிடையேயானத் தொலைவினைக் கண்ட றிக.
• fcc அலகுக் கூட்டில் உள்ள அணுக்களின் எண்ணிக்கை n = 4
ρ = 2.48 gcm-3
KF ன் மூலக்கூறு நிறை M = 39+19 = 58g mol-1
NA = 6.023 × 1023; a = ?
ρ = (nM / a3NA)
a3 = nM / ρNA
= ( 4 × 58 / 2.48) × ( 6.023 × 1023)
a3 = 0.1553 × 10-21 cm3
a = 0.5375 × 10-7cm
a = 5.375 × 10-8 cm
K+ மற்றும் F- அயனிகளுக்கிடையேயானத் தொலைவு
= 1/ 2 × விளிம்பு நீளம் = (1 / 2) × a
= 1 / 2 × 5.375 × 10-8
= 2.6875 × 10-8cm
= 2.6875 × 10-10 m
= 268.75 × 10-12 m
= 268.75pm
22. ஒரு அணு fcc அமைப்பில் படிகமாகிறது. மேலும் அதன் அடர்த்தி 10gcm-3 மற்றும் அதன் அலகுக் கூட்டின் விளிம்புநீளம் 100pm.1g படிகத்தில் உள்ள அணுக்களின் எண்ணிக்கையினைக் கண்டறிக.
fcc படிகத்தில் ஒரு அலகுக்கூட்டில் உள்ள அணுக்களின் எண்ணிக்கை n = 4.
ρ =10gcm-3 NA = 6.023 × 1023
a =100 pm = 100 × 1012 m
=100 × 1010 cm = 1.00 × 108 cm
For fccn = 4 M = ? W = 1g
Ρ = nM / a3NA M =( ρa3 NA) / n
10 × (1.00 × 10-8)3 × 6.023 × 1023 / 4
மோலார் நிறை M = 1.51 g mol-1
மோல்களின் எண்ணிக்கை n = W / M = 1 / 1.51 = 0.6623 மோல்கள்
n மோல்களில் உள்ள அணுக்களின் எண்ணிக்கை = n × NA
ஃ 0.6623 மோல்களில் உள்ள அணுக்களின் எண்ணிக்கை = 0.6623 × 6.023 × 1023
= 3.989 × 1023 அணுக்கள்
23. X மற்றும் Y ஆகிய அணுக்கள் bcc படிக அமைப்பினை உருவாக்குகின்றன. கனச்சதுரத்தின் மூலையில் X. அணுக்களும் அதன் மையத்தில் Y அணுவும் இடம் பெறுகிறது. அச்சேர்மத்தின் வாய்ப்பாடு என்ன?
bcc அமைப்பில் மூலை அணுக்கள் X= 8 × (1) / (8) = 1 அணு
பொருள் மைய அணு Y= 1 × (1) / (1) = 1 அணு
ஃவாய்பாடு X1Y1 அல்லது XY.
24. அலகு கூட்டின் விளிம்பு நீளம் 4.3 x 10-8cm ஆக உள்ள bcc வடிவமைப்பில் சோடியம் படிகமாகிறது. சோடியம் அணுவின் அணு ஆர மதிப்பினைக் கண்டறிக.
bcc படிக அமைப்பின் ஆரம் r = ( √3 / 4) = a
a = 4.3 × 10-8cm r = ?
r = ( √3 / 4) = a
= ( √3 / 4.3 × 10-8) / 4
r = (1.732 × 4.3 × 10-8) / (4 ) = 1.862 × 10-8cm
25. ஃபிரங்கல் குறைபாடு பற்றி குறிப்பு வரைக. மார்ச் - 2020 படிக அணிக்கோவைத் தளத்தில் இடம் பெற வேண்டிய ஒரு அயனி அவ்விடத்தில் அமை யாமல் மற்றொரு இடைச்செருகல் நிலையில் அமைவதால் ஃபிரங்கல் குறைபாடு தோன்றுகிறது.
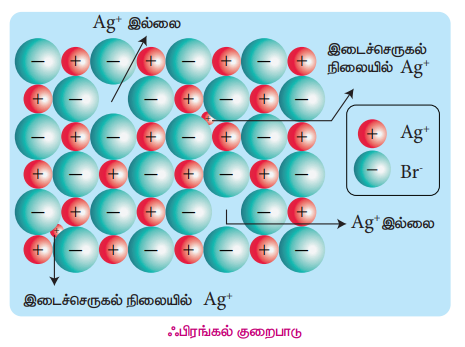
• உருவ அளவில் அதிக வேறுபாடு உடைய நேர் மற்றும் எதிர் அயனிகளைக் கொண்ட அயனிப் படிகங்களில் இக்குறைபாடு காணப்படுகிறது.
• இக்குறைபாடு படிக அடர்த்தியில் பாதிப்பை ஏற்படுத்துவதில்லை.
• (எ.கா) சில்வர் புரோமைடு
• சிறிய உருவளவு Ag+ அயனி அதன் வழக்கமான அணிக்கோவைப் புள்ளிகளில் இடம் பெறாமல் இடைச் செருகல் நிலைகளில் காணப்படுகிறது.
தன்மதிப்பீடு –1
1. முகப்பு மைய கனச் சதுர அலகுக் கூட்டினை பெற்றுள்ள ஒரு தனிமத்தின் அலகுக் கூட்டின் விளிம்பு நீளம் 352.4 pm அதன் அடர்த்தி 8.9 gcm-3, எனில் 100g நிறையுடைய அத்தனிமத்தில் எத்தனை அணுக்கள் உள்ளன எனக் கண்டறிக?
a = 352.4 pm = 352.4 × 10-12m
= 352. 4 × 10-12 × 102 cm
= 352. 4 × 10-10 cm
= 3.524 × 10-8 cm
= 8.9 gcm-8; NA = 6.023 × 1023
fcc அலகுக்கூட்டிற்கு n = 4 ; W = 100g M = ?
ρ = nM / a3NA M = ρa3 NA / n
= 8.9 (3.524 × 10-8)3 × 6.023 × 10 23 / 4
= 8.9 (3.524)3 × 6.023 × 10-24 × 1023 / 4
= 586.476 × 10-1
மோலார் நிறை M = 58.65g mol-1
மோல்களின் எண்ணிக்கை
n = w/m = 100 / 58.65 = 1.705 மோல்கள்
n மோல்களில் உள்ள அணுக்களின் எண்ணிக்கை = n. NA
1.705 மோல்களில் உள்ள அணுக்களின் எண்ணிக்கை
= 1.705 × 6.023 × 1023
= 10.269 × 1023
= 1.027 × 1024 அணுக்கள்
2. Cscl ஆனது விளிம்பு நீளம் 412.1pm உடைய பொருள் மைய கனச்சதுர அமைப்பில் படிகமாகிறது எனில் அதன் அடர்த்தியைக் கண்டறிக.
Cscl ஒரு bcc வகை படிகம் எனவே n = 2
a = 412.1 pm = 412.1 × 10-12 m
NA = 6.023 × 1023 = 412.1 × 10-10 cm
= 4.121 × 10-8cm
Cscl ன் மோலார் நிறை M = 132.9 + 35.5 = 168.4g mol-1 ρ =?
= 168. 4 g mol-1
ρ = nM / a3 NA
= 2 × 168.4 / (4.121 × 10-8)3 × 6.023 × 1023
= 0.799 × 101
p = 7.99gcm-3
3. அணு நிறை 60 உடைய ஒரு தனிமத்தின் முகப்பு மைய கனச்சதுர அலகுக்கூட்டின் விளிம்பு நீளம் 4 எனில் அதன் அடர்த்தியைக் கண்டறிக.
fcc அலகுக்கூட்டிற்கு n = 4 ;
M = 60g atom-1
ஃn = 4
a = 4Ǻ = 4 × 10-10
m = 4 ×10-8cm
ρ + ?
NA = 6.023 × 1023
ρ = nM / a3NA
= 4 × 60 / (4 × 10-8)3 × (6.023 × 1023) = 0.622 × 10
ρ = 6.226gcm-3