11 வது வேதியியல் : அலகு 8 : இயற் மற்றும் வேதிச்சமநிலை
சமநிலை மாறிலியின் பயன்பாடுகள்
சமநிலை மாறிலியின் பயன்பாடுகள்
சமநிலை மாறிலியைப் பற்றிய அறிவின் மூலம் நாம்,
1. நிகர வினை எத்திசையில் நிகழும் என்பதனை கணிக்க இயலும்.
2. வினை நிகழும் அளவினைத் தீர்மானிக்க இயலும்.
3. சமநிலையில் உள்ள வினைபடுபொருள்கள் மற்றும் வினைவிளைப்பொருள்கள் ஆகியவற்றின் செறிவுகளைக் கண்டறிய இயலும்.
ஆனால் இச் சமநிலை மாறிலிகளைக் கொண்டு முன்னோக்கிய வினை அல்லது பின்னோக்கிய வினையின் வினைவேகங்களைப் பற்றி எத்தகவலையும் கண்டறிய இயலாது என்பது குறிப்பிடத்தக்கது.
1. வினை நிகழும் அளவினை கணித்தல்
ஒரு வினை எந்த அளவிற்கு நிகழும் என்பதை நாம் கண்டறிய சமநிலை மாறிலியின் மதிப்பு Kc உதவுகிறது. அதாவது ஒரு குறிப்பிட்ட வெப்பநிலையில் வினையானது வினைவிளை பொருள் உருவாகும் திசையில் எந்த அளவிற்கு நிகழ்கிறது என்பதனைக் கண்டறிய உதவுகிறது.
Kc ன் மதிப்பு மிக அதிகமாக இருப்பின், அவ்வினை அதிக அளவு விளைபொருளுடன் சமநிலையை அடைந்துள்ளது என அறியலாம். மாறாக Kc மதிப்பு குறைவாக இருப்பின் குறைந்த அளவு விளைபொருளுடன் சமநிலை அடைகிறது என அறியலாம்.
பொதுவாக, Kc ன் மதிப்பு 103 ஐ விட அதிகம் எனில், வினையானது ஏறத்தாழ நிறைவடையும் நிலையில் உள்ளது. Kc ன் மதிப்பு 10-3ஐ விட குறைவாக இருப்பின் வினை அரிதாக தொடர்ந்து நிகழும். Kc ன் மதிப்பு 10-3 முதல் 103 வரையிலான அளவில் இருப்பின், சமநிலையில், குறிப்பிடத்தக்க அளவு வினைபடுபொருள்கள் மற்றும் வினைவிளை பொருள்கள் ஆகிய இரண்டும் காணப்படுகின்றன.
அட்டவணை 8.2, Kc ஐ பொருத்து வினை நிகழும் அளவு

எடுத்துக்காட்டு
பின்வரும் சமநிலை வினைகளைக் கருதுக.
அவைகளின் சமநிலை மாறிலிகளைத் தொடர்பு படுத்துக.
i) N2 + O2 ⇌ 2NO ; K1
ii) 2NO + O2 ⇌ 2NO2 ; K2
iii) N2 + 2O2 ⇌ 2NO2; K3

2. வினையின் திசையினை நிர்ணயித்தல்
வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்கள் ஆகியவற்றின் செறிவு/பகுதி அழுத்தங்கள் கொடுக்கப்பட்டிருப்பின், சமநிலை மாறிலி பற்றிய அறிவினைப் பயன்படுத்தி நிகர வினை நிகழும் திசையினைத் தீர்மானிக்க இயலும்.
ஒரு பொதுவான ஒருபடித்தான வினையினைக் கருதுவோம்.
xA + yB ⇌ lC + mD
மேற்கண்டுள்ள வினைக்கு, சமநிலையற்ற நிலையில், வினைக் குணகம் (Q) வை பின்வருமாறு வரையறுக்கலாம்
சமநிலையற்ற நிலையில், கொடுக்கப்பட்ட ஒரு வெப்பநிலையில், ஒரு வினையின் சமன்படுத்தப்பட்ட சமன்பாட்டில் உள்ளவாறு வினைவிளைப் பொருள்களின் மோலார் செறிவுகளின் வேதிவினைக்கூறு விகிதமடிகளின் பெருக்கற்பலனுக்கும், வினைப்படு பொருள்களின் மோலார் செறிவுகளின் வேதிவினைக்கூறு விகிதமடிகளின் பெருக்கற்பலனுக்கும், இடையேயான விகிதம் வினை குணகம் எனப்படுகிறது.
சமநிலையற்ற நிலையில், வினைக் குணகம் (Q)வை பின்வரும் சமன்பாட்டைப் பயன்படுத்திக் கணக்கிட இயலும்
Q = [C]l [D]m / [A]x [B]y

வினை தொடர்ந்து நிகழும் போது, வினைபடுபொருள்கள் மற்றும் வினைவிளை பொருள்களின் செறிவு மற்றும் Q ன் மதிப்பும் சமநிலை அடையும் வரை மாறிக்கொண்டே இருக்கும். சமநிலையில், குறிப்பிட்ட ஒரு வெப்பநிலையில் Q ன் மதிப்பு Kc க்கு சமமாகிறது. சமநிலை அடைந்த பின்னர் Q ன் மதிப்பில் மாற்றம் ஏதும் ஏற்படுவதில்லை. Q ன் மதிப்பை Kc உடன் ஒப்பிட்டு நாம் வினையின் திசையினைத் தீர்மானிக்க இயலும்
● Q = Kc, எனும்போது வினை சமநிலையில் உள்ளது.
● Q > Kc, எனும்போது வினையானது பின்னோக்கிய திசையில் நிகழ்கிறது. அதாவது வினைபடுபொருள் உருவாகிறது.
● Q < Kc, எனும்போது வினையானது முன்னோக்கிய திசையில் நிகழ்கிறது. அதாவது வினைவிளை பொருள் உருவாகிறது

எடுத்துக்காட்டு 1
717K வெப்பநிலையில் பின்வரும் வினைக்கு Kc ன் மதிப்பு 48.
H2 (g) + I2 (g) ⇌ 2HI(g)
ஒரு குறிப்பிட்ட நிலையில், H2, I2 மற்றும் HI ஆகியவற்றின் செறிவுகள் முறையே 0.2mol L-1 , 0.2 mol L-1 மற்றும் 0.6 mol L-1 என கண்டறியப்படுகிறது. மேற்கண்டுள்ள தகவல் மூலம் நாம் வினை நிகழும் திசையினை பின்வருமாறு கண்டறிய இயலும்

Q < Kc என்பதால், வினையானது முன்னோக்கிய திசையில் நிகழும்.
எடுத்துக்காட்டு 2
N2O4 (g) ⇌ 2NO2 (g)
373Kல், மேற்கண்டுள்ள வினைக்கு Kc = 0.21. கொடுக்கப்பட்ட நேரத்தில் N2O4 மற்றும் NO2 ஆகியவற்றின் செறிவுகள் முறையே 0.125 mol dm-3 மற்றும் 0.5 mol dm-3 என கண்டறியப்பட்டது. இவ் விவரங்களிலிருந்து வினை நிகழும் திசையினை நாம் பின்வருமாறு தீர்மானிக்க இயலும்.

Q ன் மதிப்பானது Kcன் மதிப்பினை விட அதிகம் எனவே Qன் மதிப்பு 0.21 ஆகும் வரை வினையானது பின்னோக்கிய திசையில் நிகழும்.
தன் மதிப்பீடு
3. ஹைட்ரஜனை தொழில் முறையில் தயாரிக்க பின்வரும் நீர்வாயு மாற்ற வினை மிக முக்கியமானதாகும்.
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
கொடுக்கப்பட்ட வெப்பநிலையில் Kp = 2.7, 2L குடுவையில் 0.13மோல் CO, 0.56 மோல் நீர் 0.78 மோல் CO2 மற்றும் 0.28 மோல் H2 ஆகியன எடுத்துக்கொள்ளப்பட்டால், சமநிலையை அடைய வினை எந்த திசையில் நிகழும் எனக் கண்டறிக.
தீர்வு:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Kp = 2.7
[CO] = 0.13, [H2O] = 0.56
[CO2] = 0.78 , [H2] = 0.28
V = 2L
Kp = KC (RT)Δng Δng = 2 – 2 = 0
2. 7 = KC (RT)o
KC = 2. 7

Q = 3
Q > KC
எனவே வினை பின்னோக்கிய திசையில் நிகழும்.
3. சமநிலையில் வினைபடு பொருள்கள் மற்றும் வினை விளைபொருள்களின் செறிவுகளைக் கணக்கிடுதல்
ஒரு வினைக்கு, வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்கள் ஆகியவற்றின் சமநிலைச் செறிவுகள் தெரிந்திருப்பின், சமநிலை மாறிலியைக் கணக்கிடலாம் அதைப் போலவே சமநிலை மாறிலி மதிப்பு தெரிந்திருப்பின் சமநிலைச் செறிவுகளைக் கண்டறிய இயலும்.
HI சிதைவடைதல்:
HI உருவாகும் மீள்வினையை நாம் கருதுவோம்.V கொள்ளளவு உடைய கலனில் 'a' மோல் ஹைட்ரஜன் மற்றும் ‘b’ மோல் அயோடின் வாயுக்கள், வினைபுரிய அனுமதிக்கப்படுகின்றன. x மோல் ஹைட்ரஜன் x மோல் அயோடினுடன் வினைபுரிந்து 2x மோல் HIஐ தருவதாகக் கொள்வோம்.
H2(g) +I2(g) ⇌ 2HI (g)

நிறைதாக்க விதியைப் பயன்படுத்த,

சமநிலை மாறிலி Kp ன் மதிப்பினை பின்வருமாறு கணக்கிட இயலும்.
KP க்கும் KC க்கும் இடையேயான தொடர்பினை நாம் அறிவோம்.
KP = KC (RT)Δng
இங்கு
Δng = np – nr = 2 – 2 = 0
எனவே Kp = Kc
Kp = 4x2 / (a – x) (b –x)
தீர்க்கப்பட்ட கணக்கு
ஒரு லிட்டர் கலனில், ஒரு மோல் ஹைட்ரஜன் மற்றும் ஒரு மோல் அயோடின் கலக்கப்பட்டு சமநிலை அடைய அனுமதிக்கப்படுகிறது. சமநிலைக் கலவையில் 0.4 மோல் HI காணப்படுகிறது. சமநிலை மாறிலியைக் கணக்கிடுக.
கொடுக்கப்பட்ட தரவுகள்
[H2] = 1 mol L-1; [I2] = 1 mol L-1
சமநிலையில், [HI] = 0.4 mol L-1 ;Kc = ?
தீர்வு

PCl5 சிதைவடைதல்:
‘V' கனஅளவுள்ள ஒரு கலனில் 'a' மோல் PCl5 எடுத்துக்கொள்ளப்படுவதாகக் கருதுவோம்.
'x' மோல் PCl5 சிதைவடைந்து x மோல் PCl3 மற்றும் x மோல் Cl2 வைத் தருகிறது என்க.
PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)

நிறைதாக்க விதியினைப் பயன்படுத்த,

Kp ன் மதிப்பினை பின்வருமாறு கணக்கிடலாம்.
Kp க்கும் Kc க்குமானத் தொடர்பினை நாம் அறிவோம்.
KP = KC (RT)Δng
இங்கு
Δng = np – nr = 2 – 1 = 1
Kp = Kc (RT)
PV = nRT என நாம் அறிவோம்.
RT = (PV / n)
இங்கு n என்பது சமநிலையில் உள்ள மொத்த மோல்களின் எண்ணிக்கையினைக் குறிப்பிடுகின்றது.
n = (a-x) + x + x = (a+x)

தொகுப்பு முறையில் அம்மோனியா தயாரித்தல்
'a' மோல் நைட்ரஜன் மற்றும் ‘b' மோல் ஹைட்ரஜன் ஆகியன ‘V’ கனஅளவுள்ள ஒரு கலனில் எடுத்துக் கொள்ளப்பட்டு அம்மோனியா உருவாக்கப்படும் வினையைக் கருதுக. 'x' மோல் நைட்ரஜன் '3x' மோல் ஹைட்ரஜனுடன் வினைபுரிந்து 2x மோல் அம்மோனியா உருவாகிறது என்க.
N2 (g) + 3H2 (g) ⇌ 2NH3 (g)

நிறைதாக்க விதியைப் பயன்படுத்த,

Kp ன் மதிப்பை பின்வருமாறு கணக்கிடலாம்.
Kp = KC (RT)Δng
Δng = np – nr = 2 - 4 = -2
Kp = 4x2 V2 / (a-x) (b-3x)3 (RT)-2

சமநிலையில் மொத்த மோல்களின் எண்ணிக்கை,
n = a-x + b-3x + 2x = a+b-2x

தீர்வு கண்டறியப்பட்ட கணக்குகள்
1. NH3, N2 மற்றும் H2 ஆகியனவற்றின் சமநிலைச் செறிவுகள் முறையே 1.8×10- 2M, 1.2×10- 2M மற்றும் 3×10- 2M. N2 மற்றும் H2 விலிருந்து NH3 உருவாகும் வினைக்கு சமநிலை மாறிலியின் மதிப்பினைக் காண்க.
கொடுக்கப்பட்டவை:
[NH3] = 1.8 × 10- 2M
[N2] = 1.2 × 10- 2M
[H2] = 3 × 10- 2M
Kc = ?
தீர்வு
N2(g) + 3H2(g) ⇌ 2NH3(g)

2. 298 K வெப்பநிலையில் A + B ⇌ C + D என்ற வினையின் சமநிலை மாறிலியின் மதிப்பு 100. இவ்வினையில் உள்ள நான்கு வினைப்பொருள்களின் துவக்கச் செறிவுகளும் lM எனில், வினைவிளை பொருள் Dயின் சமநிலைச் செறிவைக் கண்டறிக.
கொடுக்கப்பட்டவை:
[A] = [B] = [C] = [D] =1 M
Kc = 100
[D]eq = ?
தீர்வு:
வினைப் பொருள்களின் வினைப்பட்ட மோல்களின் எண்ணிக்கையை x என்க.

தன்மதிப்பீடு
4) 423K வெப்பநிலையில், 1dm3 கலனில் 1 மோல் PCl5 எடுத்துக்கொள்ளப்பட்டு சமநிலை அடைய அனுமதிக்கப்படுகிறது. வினைக்கலவையின் சமநிலைச் செறிவுகளைக் காண்க. (PCl5 சிதைவடையும் வினைக்கு 423Kல் KC ன் மதிப்பு 2)
தீர்வு:
PCl5 ⇌ PCl3 + Cl2
கொடுக்கப்பட்டவை
[PCl5]ஆரம்பம் = 1 mol ; V = 1 dm3 ; KC = 2

2 – 2x = x2
x2 + 2x – 2 = 0
a x2 + bx + c = 0 என்ற இருபடி சமன்பாட்டின்
தீர்வுகள்
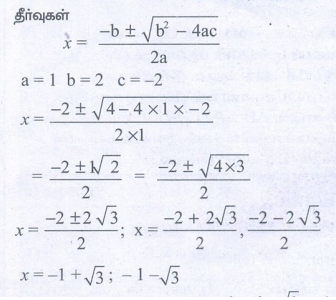
x நேர்குறி உடையது. அதனால் -1 - √3 சாத்தியமற்றது
எனவே x = -1 + 1.732 = 0.732
ஃ சமநிலை செறிவுகள்
