11 வது வேதியியல் : அலகு 8 : இயற் மற்றும் வேதிச்சமநிலை
Kp மற்றும் Kc ஆகியவற்றிக்கு இடையேயான தொடர்பு
Kp மற்றும் Kc ஆகியவற்றிக்கு இடையேயான தொடர்பு:
வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்கள் ஆகிய அனைத்தும் நல்லியல்பு வாயு நிலைமையில் உள்ள பின்வரும் பொதுவான வினை ஒன்றை நாம் கருதுவோம்.
xA + yB ⇌ lC + mD
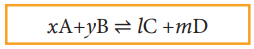
சமநிலை மாறிலி Kc ன் மதிப்பு
Kc = [C]l [D]m / [A]x [B]y (1)
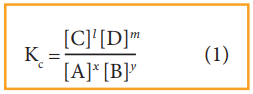
மற்றும் Kp ன் மதிப்பு
Kp = PlC × PmD / PxA × PyB (2)
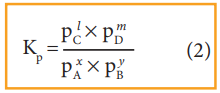
நல்லியல்பு வாயுச் சமன்பாட்டின் படி
PV = nRT
or
P = (n / V) RT
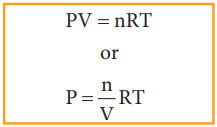
எனவே,
பகுதி அழுத்தம் (P) = மோலார் செறிவு × (RT)
மேற்கண்டுள்ளதன் அடிப்படையில் வினைபடுபொருள்கள் மற்றும் வினைவிளைப் பொருள்களின் பகுதி அழுத்தங்களை பின்வருமாறு எழுதலாம்.
PxA = [A]x (RT) x
PyB = [B]y (RT)y
PlC = [C]l (RT) l
PmD = [C]m (RT)m
சமன்பாடு (2)ல் பிரதியிட

சமன்பாடு (1) மற்றும் (4) ஐ ஒப்பிடும்போது,
Kp = Kc (RT)∆ng (5)
இங்கு,
∆ng என்பது வாயு நிலைமையில் உள்ள வினைவிளைப்பொருள்களின் மோல்களின் மொத்த எண்ணிக்கைக்கும், வினைபடுபொருள்களின் மோல்களின் மொத்த எண்ணிக்கைக்கும் இடையேயான வேறுபாடாகும்.
எனவே, பின்வரும் தொடர்புகளை நாம் பெறலாம்.
∆ ng = 0 எனும்போது,
Kp = Kc (RT)0 = Kc
உதாரணம்:
H2(g) + I2(g) ⇌ 2HI (g)
N2 (g) + O2 (g) ⇌ 2NO (g)
∆ng ஆனது நேர்குறி மதிப்பை பெறும் போது
Kp = Kc (RT)+ve
Kp > Kc
2NH3 (g) ⇌ N2 (g) + 3H2 (g)
PCI5 (g) ⇌ PCl3 (g) + Cl2 (g)
∆ng ஆனது எதிர்குறி மதிப்பை பெறும் போது
Kp = Kc (RT)-ve
Kp < Kc
எடுத்துக்காட்டு:
2H2 (g) + O2 (g) ⇌ 2H2O (g)
2SO2 (g) + O2 (g) ⇌ 2SO3 (g)
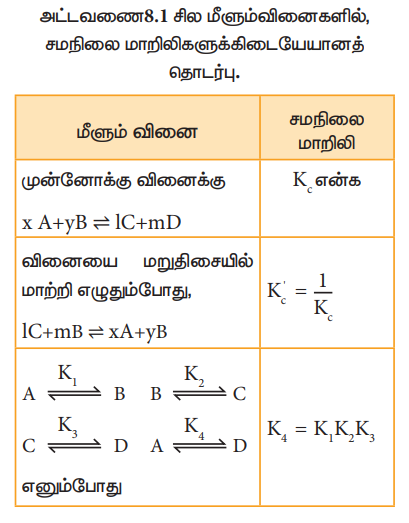
அட்டவணை 8.1 சில மீளும்வினைகளில், சமநிலை மாறிலிகளுக்கிடையேயானத் தொடர்பு.