11 வது வேதியியல் : அலகு 8 : இயற் மற்றும் வேதிச்சமநிலை
லீ-சாட்லியரின் தத்துவம்
லீ-சாட்லியரின் தத்துவம்
தொகுப்பு முறையில் அம்மோனியா தயாரித்தல் போன்ற முக்கியமான தொழிற் முக்கியத்துவம் வாய்ந்த வினைகள் மீள் தன்மையுடையவை. இத்தகைய வினைகளில் அதிகபட்ச விளைபொருளைப் பெற சாதகமான வினை நிபந்தனைகளை அறிந்து கொள்ளுதல் முக்கியமானதாகும். "வினை நிகழ் நிபந்தனைகளை மாற்றியமைப்பதன் மூலம் சமநிலையில் உள்ள ஒரு அமைப்பில் பாதிப்பினை ஏற்படுத்தும்போது, புதிய நிபந்தனைகளுக்கு ஏற்றவாறு அமைப்பு தன்னைத்தானே சரிசெய்து கொண்டு மீளவும் சமநிலையை அடைகிறது",
வெப்பநிலை, அழுத்தம் மற்றும் செறிவு ஆகியவற்றை மாற்றியமைப்பதால் சமநிலையில் உள்ள அமைப்பின் மீது ஏற்படும் விளைவினை லீ-சாட்லியர் பிரான் தத்துவத்தினைப் பயன்படுத்தித் தீர்மானிக்க இயலும்.
இத்தத்துவம் பின்வருமாறு
சமநிலையில் உள்ள அமைப்பின் மீது ஒரு பாதிப்பினை ஏற்படுத்தும் போது, அப்பாதிப்பினால் ஏற்படும் விளைவினை ஈடு செய்யும் திசையில் சமநிலை தன்னைத் தானே நகர்த்தி அவ்விளைவினை சரி செய்து கொள்ளும்
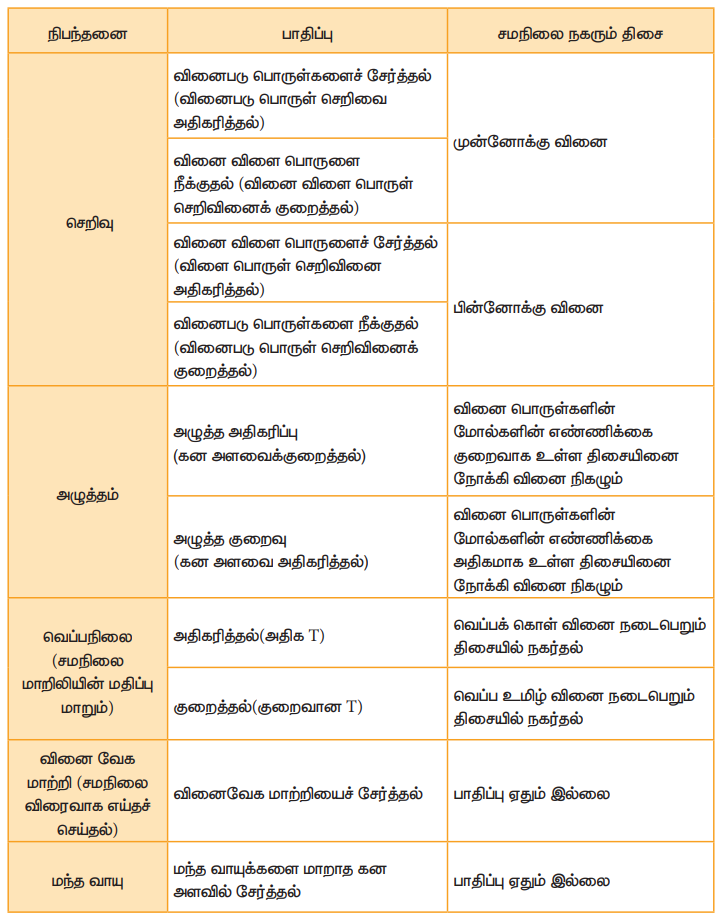
1. செறிவினால் ஏற்படும் விளைவு
சமநிலையில், வினைபடு பொருள்கள் மற்றும் வினை விளைபொருள்களின் செறிவில் எவ்வித மாற்றமும் ஏற்படுவதில்லை. அதிக அளவு வினைபடு பொருளையோ அல்லது வினை விளைப் பொருளையோ சமநிலையில் உள்ள அமைப்பில் சேர்க்கும் போது தொடர்புடைய வினைப் பொருட்களின் செறிவில் மாற்றம் ஏற்படுகிறது.
லீ-சாட்லியர் தத்துவத்தின்படி, ஒரு வினை பொருளின் செறிவினை அதிகரிப்பதால் ஏற்படும் விளைவினால் சமநிலையானது சேர்க்கப்பட்ட அந்த வினைபொருளை பயன்படுத்தும் திசையில் நகரும்.
பின்வரும் வினையினைக் கருதுக.
H2 (g) + I2 (g) ⇌ 2HI(g)
H2 அல்லது I2 ஆகியவற்றை சமநிலைக் கலவையில் சேர்ப்பதால் சமநிலை பாதிப்படைகிறது. இதனால் ஏற்படும் விளைவினை சிறுமமாக்க, H2 மற்றும் I2 ஐ பயன்படுத்தும் திசையில் சமநிலை நகருகிறது. அதாவது சேர்க்கப்பட்ட வினைபடுபொருளின் செறிவு அதிகரிப்பினை சமன்செய்யும் வகையில் கூடுதலாக HI உருவாகிறது. எனவே சமநிலை மீளவும் அடையும் வகையில் முன்னோக்கு வினை நடைபெறுகிறது. இதைப் போலவே, சமநிலைக்கலவையிலிருந்து விளைபொருளான HIஐ நீக்குவதன் மூலமும் முன்னோக்கு வினை நடைபெற சாதகமான சூழலை ஏற்படுத்தலாம்.
சமநிலைக் கலவையில் HIஐ சேர்ப்பதால், HIன் செறிவு அதிகரிக்கிறது. இச்செறிவு அதிகரிப்பின் விளைவினை ஈடு செய்யும் வகையில் சமநிலை பின்னோக்கிய திசையில் நகரும்.
ஹைட்ரஜன் மற்றும் அயோடினில் இருந்து HI உருவாகும் வினையினைக் கருத்திற்கொண்டு செறிவு மாறுபாட்டினால் ஏற்படும் விளைவினை விளக்கலாம். ஒரு குறிப்பிட்ட வெப்பநிலையில் சமநிலையில் HI, H2 மற்றும் I2 ஆகியவற்றின் செறிவுகள் முறையே 1 M, 0.2M மற்றும் 0.1M எனில்
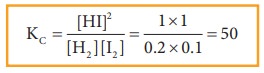
0.1M அயோடினை சமநிலைக் கலவையில் சேர்ப்பதன் மூலம் மேற்கண்டுள்ள சமநிலை பாதிப்படைய செய்யப்படுகிறது. சிறிது நேரத்திற்குப் பின், சமநிலைக் கலவையில் உள்ள HIன் செறிவு 1.092M என கண்டறியப்படுகிறது. இந்நிலையில், லீசாட்லியர் தத்துவப்படி, அமைப்பானது மீளவும் சமநிலையினை அடைந்துள்ளதா என்பதனை சரிபார்ப்போம்.
இப்பொழுது,
HIன் செறிவு = 1 + 2x = 1.092 M
2x = 0.092
x = 0.046 M
எனவே, இந்நிலையில் ஹைட்ரஜன் மற்றும் அயோடினின் செறிவுகள்
[H2] = 0.2 – X = 0.2 – 0.046 = 0.154
[I2] = 0.2 – X = 0.2 – 0.046 = 0.154
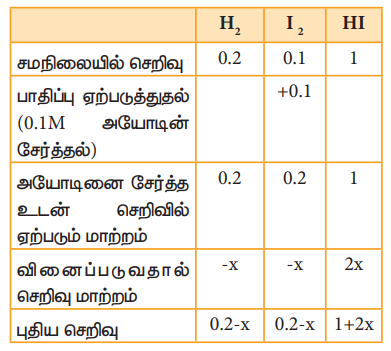
இந்நிலையில், வினைக் குணகம் (Q)ன் மதிப்பு
Q = [HI]2 / [H2] [I2] = 1.092 × 1.092/0.154 × 0.154 ≈ 50
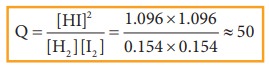
Qன் மதிப்பு Kc மதிப்பிற்குச் சமம்.
எனவே, இந்நிலையில் சமநிலையானது மீளவும் எய்தப்பட்டுள்ளது என்ற முடிவிற்கு நாம் வரலாம். மேலும் அயோடினின் செறிவு அதிகரிப்பினால் சமநிலையில் HI ன் செறிவு அதிகரித்துள்ளது எனவும் அறியமுடிகிறது.
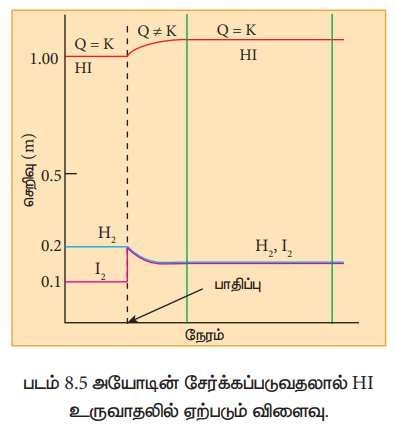
படம் 8.5 அயோடின் சேர்க்கப்படுவதலால் HI உருவாதலில் ஏற்படும் விளைவு.
உங்களுக்குத் தெரியுமா?
CaCO3ல் இருந்து பெருமளவு CaO தயாரிக்கும் வினையில் உருவாகும். CO2 ஆனது தொடர்ந்து வினைக் கலனில் இருந்து சீராக நீக்கப்படுவதால் வினை முற்றிலும் நடைபெறுதலை நோக்கி சமநிலை நகர்த்தப்படுவதற்கு காரணமாக அமைகிறது. இதைப் போலவே அம்மோனியா தயாரிக்கப்படும் ஹேபர்முறையில் உருவாகும் அம்மோனியா திரவமாக்கி நீக்கப்படுவதால் வினை தொடர்ந்து முன்னோக்கு திசையில் நிகழ்த்தச் செய்யப்படுகின்றது.
2. அழுத்தத்தால் ஏற்படும் விளைவு
வாயு நிலைமையில் காணப்படும் வினைப்பொருள்களை கொண்டுள்ள சமநிலை அமைப்புகளின் மீது மட்டுமே அழுத்த அதிகரிப்பு குறிப்பிடத்தக்க விளைவினை ஏற்படுத்துகிறது. அமைப்பின் மீதான அழுத்தம் அதிகரிக்கப்படும்போது அதற்கு இணையான அளவில் கனஅளவு குறைகிறது. இதனை சமன் செய்யும் வகையில் குறைவான மோல்கள் எண்ணிக்கையுடைய வாயு வினை பொருள்கள் உள்ள திசையை நோக்கி சமநிலை நகர்கிறது. நைட்ரஜன் மற்றும் ஹைட்ரஜனிலிருந்து அம்மோனியா தொகுக்கப்படும் வினையைக் கருதுக.
N2(g) + 3H2 (g) ⇌ 2NH3 (g)
மூடிய உந்துத் தண்டுடன் கூடிய உருளை கலனில் அமைப்பானது சமநிலை அடைய அனுமதிக்கப்படுவதாகக் கருதுவோம். அழுத்தத்தை அதிகரிக்கும் பொருட்டு உந்துத் தண்டை உள்நோக்கி நகர்த்தும்போது கனஅளவு குறைகிறது. இந்த விளைவினை சமன் செய்யும் பொருட்டு வாயு மூலக்கூறுகளின் எண்ணிக்கை குறையும் வகையில் அமைப்பானது தன்னை மாற்றிக் கொள்ளும் பொருட்டு அம்மோனியா உருவாகும் திசையில் நகருகிறது உந்துத் தண்டை நாம் மேல்நோக்கி நகர்த்தி, அழுத்தத்தை குறைத்தால், கனஅளவு அதிகரிக்கும். இந்நிலையில் அம்மோனியா சிதைவடைதல் ஆதரிக்கப்படுகிறது.

எனினும், வாயு நிலைமையில் உள்ள வினைபடு பொருட்களின் மோல்களின் எண்ணிக்கையும், வினைவிளைபொருட்களின் மோல்களின் எண்ணிக்கையும் சமமாக உள்ளபோது (Δng = 0) அழுத்த மாறுபாடானது அத்தகைய அமைப்புகளின் மீது எத்தகைய விளைவுகளையும் ஏற்படுத்துவதில்லை.
உதாரணமாக பின்வரும் வினையினைக் கருதுக.
H2(g) + I2 (g) ⇌ 2HI(g)
2 மோல்கள் வினைபடு பொருட்கள் ⇒ 2 மோல்கள் வினைவிளை பொருட்கள்

இங்கு வினைபடு பொருட்களின் மோல்களின் மொத்த எண்ணிக்கை, வினைவிளை பொருட்களின் மோல்களின் மொத்த எண்ணிக்கைக்கு சமமாக உள்ளது. (Δng = 0) எனவே, இச்சமநிலையின் மீது அழுத்த மாறுபாடு எவ்வித பாதிப்பினையும் ஏற்படுத்துவதில்லை.
3. வெப்பநிலையின் விளைவு
சமநிலையில் உள்ள ஒரு அமைப்பின் வெப்பநிலையினை மாற்றியமைக்கும் போது, அதனால் ஏற்படும் விளைவினை சமன் செய்யும் திசையில் சமநிலை நகரும்.
அம்மோனியா உருவாகும் வினையை நாம் கருதுவோம்.
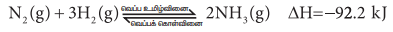
இச்சமநிலையில், முன்னோக்கு வினை வெப்ப உமிழ்வினை அதாவது வினையின் போது வெப்ப ஆற்றல் வெளியிடப்படுகிறது. அதே நேரத்தில் பின்னோக்கு வினை வெப்பம் உறிஞ்சும் வெப்பக் கொள்வினையாகும்.
வெப்ப ஆற்றலை அமைப்பிற்கு வழங்குவதன் மூலம் அமைப்பின் வெப்பநிலையை உயர்த்தினால், அதனை ஈடு செய்யும் வகையில் வெப்பக் கொள்வினை நிகழும் அதாவது பின்னோக்கு வினையில் சில அம்மோனியா மூலக்கூறுகள் சிதைவடைந்து நைட்ரஜன் மற்றும் ஹைட்ரஜன் மூலக்கூறுகளை உருவாக்கும் இதைப் போலவே, வெப்பநிலையை குறைக்கும் போது, வெப்ப உமிழ்வினையான அம்மோனியா உருவாதல் நிகழும்.
அழுத்தம் மற்றும் செறிவுகளில் மாற்றம் ஏற்படுத்தும்போது சமநிலை மாறிலி மாறாதிருக்கும் வகையில் சமநிலைச் செறிவுகளில் மாற்றம் ஏற்படும் என நாம் முன்னரே கற்றறிந்துள்ளோம். எனினும், வெப்பநிலையில் மாற்றம் ஏற்படுத்தப்படும்போது, சமநிலை மீளவும் எய்தப்படும். ஆனால் இப்புதிய சமநிலையின் சமநிலை மாறிலியின் மதிப்பு மாறுபட்டிருக்கும். அதாவது சமநிலை மாறிலியின் மதிப்பு வெப்ப நிலையைப் பொறுத்து அமையும்.
4. வினைவேக மாற்றியின் விளைவு
வினைவேக மாற்றியை சேர்ப்பதன் மூலம் சமநிலையில் எவ்வித பாதிப்பும் ஏற்படுவதில்லை. வினைவேக மாற்றியானது முன்னோக்கிய வினையையும் பின்னோக்கிய வினையையும் ஒரே அளவிற்கு பாதிக்கின்றது. எனவே, இது சமநிலைக் கலவையின் இயைபினை மாற்றியமைப்பதில்லை. எனினும் குறைவான கிளர்வு ஆற்றல் உடைய வினை வழியினை உருவாக்குவதன் மூலம் சமநிலை விரைவாக எய்துவதற்கு வினைவேக மாற்றி காரணமாக அமைகிறது.
எடுத்துக்காட்டாக, ஹேபர் முறையில் அம்மோனியா தயாரிக்கும் செயல்முறையில் வினைவேக இரும்பு (Fe) வினைவேக மாற்றியாக செயல்படுகிறது. இதைப் போலவே, தொடு முறையில், SO3 பெருமளவில் தயாரிக்கும் முறையில் பிளாட்டினம் (அல்லது) V2O5 வினைவேக மாற்றியாக பயன்படுத்தப்படுகிறது.
5. மந்தவாயுவின் விளைவு
மாறாத கனஅளவில், சமநிலையில் உள்ள ஒரு அமைப்பில் ஒரு மந்தவாயு (அதாவது சமநிலைக் கலவையில் உள்ள எந்த ஒரு வினைபொருளுடனும் வினைபுரியாத வாயு), சேர்க்கப்படும் போது, அக்கலனில் உள்ள வாயு மூலக்கூறுகளின் மொத்த எண்ணிக்கை அதிகரிக்கிறது. அதவாது வாயுக்களின் மொத்த அழுத்தம் அதிகரிக்கிறது. ஆனால் வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்களின் பகுதி அழுத்தங்கள் அதிகரிப்பதில்லை. எனவே, மாறாத கனஅளவில் மந்த வாயுவினை சமநிலையில் உள்ள ஒரு அமைப்பில் சேர்ப்பதால் அது சமநிலையில் எவ்வித பாதிப்பினையும் ஏற்படுத்துவதில்லை.
அட்டவணை 8.3 செறிவு அழுத்தம், வெப்பநிலை, வினைவேக மாற்றி மற்றும் மந்த வாயுக்களை சேர்த்தல் ஆகியனவற்றால் சமநிலையின் மீது ஏற்படும் விளைவு.