11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
பார்ன் - ஹேபர்சுற்று இதிலிருந்து NaCl படிகத்தின்படிகக் கூடு ஆற்றலை கணக்கிடலாம்.
பார்ன் - ஹேபர்சுற்று
ஒரு வினையின் ஆற்றல்களை ஆய்ந்தறிவதற்கான ஒரு அணுகுமுறையே பார்ன் - ஹேபர் சுற்று ஆகும். இச்சுற்றை உருவாக்கிய ஜெர்மன் அறிவியலாளர்கள் மேக்ஸ்பார்ன் மற்றும் ஃபிரிட்ச்ஹேபர் ஆகியோர் பெயரால் இச்சுற்று அழைக்கப்படுகிறது. ஒரு உலோகம் ஹேலஜனுடனோ அல்லது ஆக்ஸிஜன் போன்ற அலோகத்துடனோ சேர்ந்து அயனிச் சேர்மங்கள் உருவாகும் வினைகளை இச்சுற்று கருத்தில் கொள்கிறது. வேறு எந்த முறையிலும் நேரடியாக கணக்கிடமுடியாத படிககூடு ஆற்றலை கணக்கிட பார்ன் - ஹேபர் சுற்று பயன்படுகிறது. இச்சுற்றில் படிக்கூடு என்தால்பியை கணக்கிட ஹெஸ் விதி பயன்படுகிறது. எடுத்துக்காட்டாக எளிய கார உலோக ஹாலைடு MX போன்ற அயனிப்படிகங்கள் உருவாதலுக்கு பின்வரும் படிகளைக் கருத்திற் கொள்வோம்.
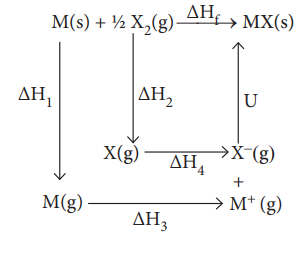
ΔH1 – M (s) லிருந்து M (g) ஆக பதங்கமாதலின் வெப்பம்
ΔH2 – 1 / 2 X2 (g) லிருந்து X (g) ஆக பிரிகையுறும் ஆற்றல்
ΔH3 – M (g) விருந்து M+ (g) ஆகமாற தேவைப்படும் அயனியாக்க ஆற்றல்
ΔH4 – X (g) ஆனது X- (g) ஆக மாற்றமடையும் செயல்முறையின் எலக்ட்ரான் நாட்ட மதிப்பு.
U - திண்ம MX உருவாதலின் படிக்கூடு ஆற்றல்.
ΔHf - தனிமங்களிலிருந்து நேரடியாக MX உருவாகும் வினையின் என்தால்பி மாற்றம் (உருவாதல் என்தால்பி).
ஹெஸ்ஸின் வெப்பம் மாறா கூட்டல் விதிப்படி
ΔHf = ΔH1 + ΔH2 + ΔH3 + ΔH4 + U
NaCl படிகத்தின் படிகக்கூடு ஆற்றலை கணக்கிடுவதற்கு பார்ன் - ஹேபர் சுற்றை பின்வருமாறு பயன்படுத்துவோம்.
வினையில் ஈடுபடும் வினைபடு பொருட்கள் தனிமநிலையிலும், விளை பொருட்கள் தங்களின் திட்ட நிலைகளிலும் உள்ளதால் 1 bar அழுத்தத்தில் வினையில் ஏற்படும் மொத்த என்தால்பி மாற்றம் NaCl படிகத்தின் உருவாதல் என்தால்பி எனவும் அழைக்கப்படுகிறது. மேலும் NaCl உருவாகும் வினை ஐந்து படிகளில் நிகழ்வதாக கருதுவோம். ஒவ்வொரு படியிலும் நிகழும் என்தால்பி மாற்றங்களின் கூடுதல் வினையின் மொத்த என்தால்பி மாற்றத்திற்குச் சமம்.
இதிலிருந்து NaCl படிகத்தின்படிகக் கூடு ஆற்றலை கணக்கிடலாம்.
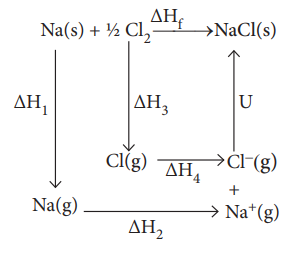
ΔHf = சோடியம் குளோரைடின் உருவாதல் வெப்பம் = - 411.3 kJ mol-1
ΔH1 = Na (S) ன் பதங்கமாதல் வெப்பம் = 108.7 kJ mol-1
ΔH2 = Na (g) ன் அயனியாக்கும் ஆற்றல் = 495.0 kJ mol-1
ΔH3 = Cl2 (g) ன் பிரிகை ஆற்றல் = 244 kJ mol-1
ΔH4 = Cl (g) ன் எலக்ட்ரான் நாட்டம் = - 349.0 kJ mol-1
U = NaCl ன் படிக்கூடு ஆற்றல்
ΔHf = ΔH1 + ΔH2 + (1 / 2) ΔH3 + ΔH4 + U
∴ U = (ΔHf) – (ΔH1 + ΔH2 + (1 / 2) ΔH3 + ΔH4)
⇒ U = (- 411.3) - (108.7 + 495.0 + 122 - 349)
U = (- 411.3) - (376.7)
∴ U = - 788 kJ mol-1
படிகக்கூடு ஆற்றல் மதிப்பிலுள்ள இந்த எதிர்குறியானது, வாயுநிலையிலுள்ள Na+ மற்றும் Cl- அயனிகளிலிருந்து NaCl உருவாகும்போது ஆற்றல் வெளிப்படுகிறது என்பதை குறிக்கிறது.