11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
வெப்ப வேதிச்சமன்பாடுகள் (Thermochemical equations)
வெப்ப வேதிச்சமன்பாடுகள் (Thermo chemical equations)
வெப்ப வேதிச்சமன்பாடுகள் என்பவை என்தால்பி மாற்ற (ΔH) மதிப்புகளுடன் கூடிய சமன் செய்யப்பட்ட வேதிவினைக் கூறு விகித சமன்பாடு (Stoichiometric Equation) ஆகும். வெப்ப வேதிச் சமன்பாடுகளில் பின்வரும் நடைமுறைகள் பின்பற்றப்படுகின்றன.
(i) சமன்படுத்தப்பட்ட வெப்ப வேதிச் சமன்பாடுகளில் உள்ள வினை குணகங்கள், வினையில் ஈடுபடும் வினைபடு மற்றும் வினைவிளை பொருட்களின் மோல்களின் எண்ணிக்கையினைக் குறிப்பிடுகின்றன.
ii) ஒரு வேதிவினையின் என்தால்பி மாற்றம் ΔHr ஆனது தகுந்த குறியீட்டு மற்றும் அலகுடன் குறிப்பிடப்பட வேண்டும்.
(iii) ஒரு வேதிவினையின் மறுதலை வினையை (reverse reaction) கருதும்போது, அவ்வினையின் ΔHன் எண் மதிப்பை மாற்றாமல், குறியீட்டை மட்டும் மாற்றி குறிப்பிடப்படுகிறது.
(iv) ஒரு வினையின் ΔH மதிப்பானது அவ்வினையில் ஈடுபடும் வினைப் பொருள்களின் இயற் நிலைமைகளை பொறுத்து அமைவதால், அவ்வேதி வினையில் ஈடுபடும் அனைத்து பொருட்களின் இயற் நிலைமைகளும் முக்கியமானவை மற்றும் அவற்றை [வாயு(g), நீர்மம்(l), நீர்மகரைசல் (aq), திண்மம் (s) முதலியன அடைப்புக் குறிக்குள்] வெப்ப வேதிச் சமன்பாடுகளில் கண்டிப்பாக குறிப்பிட வேண்டும்.
(v) ஒரு வெப்ப வேதிச் சமன்பாடு முழுவதுமாக ஒரு குறிப்பிட்ட எண்ணால் பெருக்கப்படும் போது, அதன் என்தால்பி மதிப்பும் அதே எண்ணால் பெருக்கப்படுகிறது.
(vi) ஒருவினையின் ΔHr0 மதிப்பு எதிர் குறியை பெற்றிருந்தால் அவ்வினை வெப்பம் உமிழ் வினை எனவும், ΔHr0 மதிப்பு நேர்குறியை பெற்றிருந்தால் வெப்பம் கொள்வினை எனவும் அறியலாம்.
எடுத்துக்காட்டாக பின்வரும் வினைகளைக் கருதுவோம்
2H2 (g) + O2 (g) → 2 H2O (g)
ΔHr0 = - 967.4 kJ
2 H2O (g) → 2H2 (g) + O2 (g)
ΔHr0 = + 967.4 kJ
ஒரு வினையின் திட்டவினை என்தால்பி (ΔHr0) மதிப்பினை, திட்ட உருவாதல் என்தால்பி (ΔHf0) மதிப்புகளிலிருந்து பெறுதல்.
அனைத்து வினைபடு பொருட்கள் மற்றும் வினைவிளை பொருட்களும் அவற்றின், திட்ட நிலைகளில் உள்ளபோது, அவ்வினையின் என்தால்பி மாற்றம், திட்டவினை என்தால்பி எனப்படுகிறது. இவை ΔH குறியீட்டிற்கு 0-வை மேல் ஒட்டாக சேர்த்து ΔH0 என்ற குறியீட்டால் குறிக்கப்படுகிறது.
வினையில் ஈடுபடும் பல்வேறு வினைபடு பொருட்கள், மற்றும் வினைவிளை பொருட்கள் ஆகியனவற்றின் திட்ட உருவாதல் என்தால்பி மதிப்புகளிலிருந்து, திட்ட நிலையில் அவ்வினையின் என்தால்பி மதிப்பினை நாம் கணக்கிடமுடியும்.
வினை விளைப் பொருட்களின் திட்ட உருவாதல் என்தால்பி மதிப்புகளிலிருந்து வினைபடு பொருட்களின் திட்ட உருவாதல் என்தால்பி மதிப்புகளைக் கழித்துக் கிடைப்பது அவ்வினையின் திட்டவினை என்தால்பி மதிப்பிற்குச் சமம்.
ΔHr0 = Σ ΔHf0(வினைப் பொருள்) - Σ ΔHf0(வினைப்படுபொருள்)
ஒரு பொதுவான வினைக்கு
aA + bB → cC + dD
ΔHf0 = Σ ΔHf0(வினைப் பொருள்) - Σ ΔHf0(வினைப்படுபொருள்)
ΔHf0 = {c ΔHf0 (C) + d ΔHf0 (D)} - {a ΔHf0 (A) + b ΔHf0 (B)}
கணக்கு 7.2
C2H5OH (l) + 3O2 (g) → 2CO2 (g) + 3 H2O (l)
என்ற வினைக்கு திட்ட என்தால்பி மாற்ற மதிப்பை கணக்கிடுக. C2H5OH (l), CO2 (g) மற்றும் H2O (l) ஆகியவற்றின் திட்ட உருவாதல் என்தால்பி மதிப்புகள் முறையே 277, -393.5 மற்றும் -285.5 kJ mol-1 வரையறையின் படி O2(g) ன் திட்ட உருவாதல் என்தால்பி மதிப்பு பூஜ்ஜியமாகும்.
தீர்வு
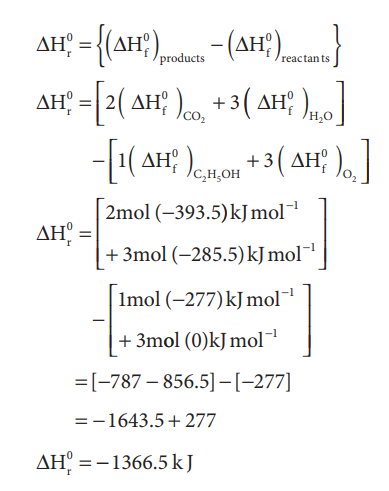
= [-787 - 856.5] - [-277]
= -1643.5 + 277
ΔHr0 = -1366.5 kJ
தன்மதிப்பீடு
1) CO2 (g) + H2 (g) → CO (g) + H2O (g)
என்ற வினைக்கு திட்ட வினை என்தால்பி மதிப்பினைக் கணக்கிடுக. கொடுக்கப்பட்டுள்ளவை: CO2 (g), CO (g) மற்றும் H2O (g) ஆகியவற்றின் ΔHf0 மதிப்புகள் முறையே - 393.5, - 111.31 மற்றும் - 242 kJ mol-1,
தீர்வு:
கொடுக்கப்பட்டவை
∆H0f CO2 = −393.5kJ mol−1
∆H0f CO = −111.31kJmol−1
∆H0r (H2O) = −242kJmol−1
CO2(g) + H2(g) → CO(g) + H2O(g) ∆H0r = ?
∆H0r = ∑ (∆Hf) வினைவிளைப்பொருள் − ∑ (∆Hf) வினைபடுபொருள்
∆H0r = [∆Hf (CO) + ∆Hf (H2O)] − [∆Hf (CO2) + ∆Hf (H2)]
∆H0r = [−111.31 + (−242)] − [−393.5 + (0)]
∆H0r = [−353.31] + 393.5
∆H0r = 40.19
∆H0r = +40.19kJ mol−1
எரிதல் வெப்பம்
“ஒரு மோல் சேர்மமானது அதிகளவு காற்று அல்லது ஆக்ஸிஜனில் முழுமையாக எரிக்கப்படும் போது ஏற்படும் என்தால்பி மாற்றம், அச்சேர்மத்தின் எரிதல் வெப்பம் என வரையறுக்கப்படுகிறது. இது ΔHC என குறிப்பிடப்படுகிறது. எடுத்துக்காட்டாக மீத்தேனின் எரிதல் வெப்பம் - 87.78 kJ mol-1
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l)
ΔHC = - 87.78 kJ mol-1
கார்பனின் எரிதல் வினைக்கு.
C (s) + O2 (g) → CO2 (g)
ΔHC = - 394.55 kJ mol-1
எரிதல் வினைகள் எப்பொழுதும் வெப்பம் உமிழ் வினைகளாகும். எனவே எரிதல் என்தால்பி மாற்றம் எப்பொழுதும் எதிர்குறியினைப் பெற்றிருக்கும்.
மோலார் வெப்ப ஏற்புத் திறன்கள்:
ஒரு அமைப்பிற்கு வெப்பம் கொடுக்கப்படும் போது, அவ்வமைப்பிலுள்ள மூலக்கூறுகள் வெப்ப ஆற்றலை (q) உறிஞ்சுகின்றன, எனவே அவைகளின் இயக்க ஆற்றல் அதிகரிக்கின்றது. இதன் விளைவாக அமைப்பின் வெப்பநிலை T1 லிருந்து T2 க்கு உயருகிறது.
இந்த வெப்பநிலை உயர்வு (T2 - T1) ஆனது. உறிஞ்சப்பட்ட வெப்பத்தின் (q) அளவிற்கு நேர்விகிதத்திலும், பொருளின் நிறைக்கு (m) எதிர்விகிதத்திலும் இருக்கும்.
q α mΔT
q = c mΔT
c = q / m(ΔT)
இங்கு c என்பது வெப்ப ஏற்புத்திறன்
c = (q / [m (T2 - T1)] ) ---------- (7.18)
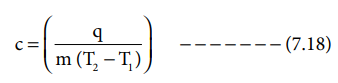
m = 1 kg மற்றும் (T2 - T1) = 1 K எனும் போது வெப்ப ஏற்புத்திறனானது, தன் வெப்ப ஏற்புத்திறன் எனப்படுகிறது. மேலும் சமன்பாடு 7.18 ஆனது பின்வருமாறு மாற்றமடைகிறது.
c = q
அதாவது, ஒரு குறிப்பிட்ட வெப்பநிலையில், 1 கிலோ கிராம் நிறையுள்ள பொருள் ஒன்றின் வெப்பநிலையை, ஒரு கெல்வின் உயர்த்த அப்பொருளால் உறிஞ்சிப்படும் வெப்ப ஆற்றலின் அளவானது, அவ்வமைப்பின் தன்வெப்ப ஏற்புத்திறன் என வரையறுக்கப்படுகிறது.
ஒரு மோல் சேர்மத்திற்கான வெப்ப ஏற்புத்திறன் மோலார் வெப்ப ஏற்புத்திறன் (cm) என்றழைக்கப்படுகிறது "ஒரு மோல் சேர்மத்தின் வெப்பநிலையை ஒரு கெல்வின் உயர்த்த அச்சேர்மத்தால் உறிஞ்சிப்படும் வெப்ப ஆற்றலின் அளவு அதன் மோலார் வெப்ப ஏற்புத்திறன் என வரையறுக்கப்படுகிறது.
வெப்ப ஏற்புத்திறனின் அலகுகள்:
மோலார் வெப்ப ஏற்புத்திறனின் SI அலகு JK-1 mol-1
மோலார் வெப்ப ஏற்புத்திறன்கள் மாறாத கனஅளவு (CV) மற்றும் மாறாத அழுத்தம் (CP) என இருவகைகளில் குறிப்பிடப்படுகின்றன.
வெப்ப இயக்கவியலின் முதல் விதிப்படி
U = q + w அல்லது U = q - PdV
q = U + PdV ---------- (7.19)
சமன்பாடு (7.19)ஐ மாறாத கன அளவில், வெப்ப நிலையை பொறுத்து வகையீடு செய்ய
(∂q / ∂T)V = (∂U / ∂T)V
CV = (∂U / ∂T)V ---------- (7.20)
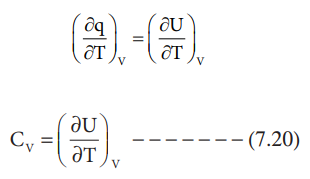
எனவே மாறா கன அளவில் மோலார் வெப்ப ஏற்புத்திறன் (CV) என்பது மாறாத கனஅளவில், வெப்பநிலையைப் பொறுத்து அக ஆற்றலின் மாறுபாட்டு வீதம் என வரையறுக்கப்படுகிறது.
இதைப் போலவே, மாறா அழுத்தத்தில் மோலார் வெப்ப ஏற்புத்திறன் (cp) என்பது மாறாத அழுத்தத்தில் வெப்பநிலையை பொறுத்து என்தால்பியின் மாறுபாட்டு வீதம் என வரையறுக்கப்படுகிறது.
Cp = (∂H / ∂T)P ---------- (7.21)
ஒரு நல்லியல்பு வாயுவிற்கான cp மற்றும் cV ஆகியவற்றிற் கிடையேயான தொடர்பு:
என்தால்பிக்கான வரையறைப்படி
H = U + PV ---------- (7.8)
நல்லியல்பு வாயுச் சமன்பாட்டின் படி
PV = nRT ---------- (7.22)
சமன்பாடு 7.22 ஐ 7.8 ல் பிரதியிட
H = U + nRT ---------- (7.23)
இச்சமன்பாட்டை பொறுத்து வகையீடு செய்ய
∂H / ∂T = (∂U / ∂T) + nR (∂T / ∂T)
CP = CV + nR (1)
CP - CV = nR ----- (7.24) [ ∵ (∂H / ∂T)P = Cp மற்றும் (∂U / ∂T)V = CV ]
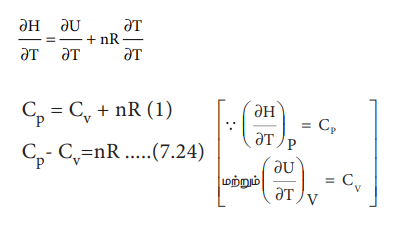
அழுத்தம் மாறா செயல்முறைகளில் அமைப்பானது சூழலுக்கு எதிராக வேலை செய்கிறது. எனவே கனஅளவு மாறாத செயல்முறையைக் காட்டிலும், ஒரு குறிப்பிட்ட வெப்பநிலை உயர்வை அடைய அமைப்பிற்கு அதிகளவு வெப்பம் தேவைப்படுகிறது. எனவே Cp மதிப்பு எப்பொழுதும் CV ஐ விட அதிகம்.
ΔU மற்றும் ΔH கணக்கிடல்
1 மோல் நல்லியல்பு வாயுவிற்கு
CV = dU / dT
dU = CV dT
வரையறுக்கப்பட்ட மாற்றம் நிகழும் போது
ΔU = CV ΔT
ΔU = CV (T2 – T1)
n மோல்கள் நல்லியல்பு வாயுக்களுக்கு
ΔU = n CV (T2 – T1) ---------- (7.25)
இதேபோல n மோல்கள் நல்லியல்பு வாயுக்களுக்கு, ΔH மற்றும் CP தொடர்பு பின்வருமாறு.
ΔΗ = n Cp (T2 – T1) ---------- (7.26)
கணக்கு 7.3
128.0 கிராம் ஆக்ஸிஜனை 0°C லிருந்து 100°C க்கு வெப்பப்படுத்தும் போது ΔU மற்றும் ΔH மதிப்புகளை கணக்கிடுக. தோராயமாக CV மற்றும் CP மதிப்புகள் முறையே 21 J mol-1 K-1 மற்றும் 29 J mol-1 K-1 (வேறுபாடானது 8 J mo-1 K-1 இது தோராயமாக R மதிப்பிற்குச் சமம்)
தீர்வு
இங்கு
ΔU = n CV (T2 – T1)
ΔH = n CP (T2 – T1)
மேலும்
n = 128 / 32 = 4 மோல்கள்
T2 = 100°C = 373K ; T1 = 0°C = 273K
ΔU = n CV (T2 – T1)
ΔU = 4 × 21 × (373 - 273)
ΔU = 8400 J
ΔU = 8.4 kJ
ΔH = n CP (T2 – T1)
ΔH = 4 × 29 × (373 - 273)
ΔH = 11600 J
ΔH = 11.6 kJ
தன்மதிப்பீடு
2) 180 கிராம் நீரின் வெப்பநிலையை 25°C லிருந்து 100°C க்கு மாற்றத் தேவைப்படும் வெப்பத்தை கணக்கிடுக. நீரின் மோலார் வெப்ப ஏற்புத்திறன் மதிப்பு 75.3 J mol-1 K-1.
தீர்வு:
நீரின் மோல்களின் எண்ணிக்கை
n = 180g /18gmol−1 = 10 mol
நீரின் மோலார் வெப்ப ஏற்புத்திறன் Cp = 75.3JK−1mol−1
T2 =100°C = 373K
T1 = 25°C = 298K
∆H = ?
∆H = nCp(T2 −T1)
∆H = 10mol × 75.3Jmol−1 K−1 × (373 − 298)K
∆H = 56475J
∆H = 56.475kJ