11 வது வேதியியல் : அலகு 8 : இயற் மற்றும் வேதிச்சமநிலை
பின்வரும் வினாக்களுக்கு சுருக்கமாக விடையளி
26. சமநிலை செறிவில் எவ்வித மாற்றமும் இல்லை எனினும் சமநிலையானது ஏன் இயங்குச் சமநிலை என கருதப்படுகிறது?
விடை :
● சமநிலையை அடைந்த பின்னர் மீள் வினைகள் நிகழாமல் நின்று விடுவதில்லை.
● சமநிலையில் முன்னோக்கு மற்றும் பின்னோக்கு வினைகள் இரண்டும் ஒரே சமயத்தில் சமமான வேகத்தில் நிகழ்ந்து கொண்டிருக்கின்றன.
● மேலும் பெரிய அளவில் மாற்றங்கள் ஏதும் உணரப்படுவதில்லை.
● எனவே வேதிச்சமநிலை இயங்குச் சமநிலை என கருதப்படுகிறது.
27. ஒரு குறிப்பிட்ட வெப்பநிலையில் ஒரு வினையில், சமநிலை மாறிலி மாறாத மதிப்பினை பெற்றிருக்கிறது. Qன் மதிப்பும் மாறிலியாக இருக்குமா? விவரி.
விடை :
● Q ன் மதிப்பு மாறாமல் இருக்காது.
● வினை தொடர்ந்து நிகழும்போது, வினைபடுபொருள்கள் மற்றும் வினை விளைபொருள்களின் செறிவு மற்றும் Q ன் மதிப்பும் சமநிலை அடையும் வரை மாறிக் கொண்டே இருக்கும்.
● ஒரு குறிப்பிட்ட வெப்பநிலையில் Q-ன் மதிப்பு KC க்கு சமமாகிறது.
● சமநிலை அடைந்த பின்னர் Q-ன் மதிப்பில் மாற்றம் ஏதும் ஏற்படுவதில்லை.
28. Kp மற்றும் Kc க்கு இடையேயான தொடர்பு யாது? Kpமதிப்பானது Kcக்கு சமமாக உள்ளவாறு ஒரு எடுத்துக்காட்டினை தருக.
விடை :
Kp = KC (RT)Δng
Δng = (np – nr)g
np = nr எனில் Δng = 0, எனவே Kp = KC
எ.கா. H2(g) + I2(g) ⇌ 2HI(g)
Δng = 2-2 = 0, எனவே Kp = KC
29. வாயுக்களின் ஒருபடித்தான சமநிலை வினையில் வினைவிளை பொருள்களின் மோல்களின் எண்ணிக்கையானது வினைபடு பொருள்களின் மோல்களின் எண்ணிக்கையை விட அதிகமாக இருந்தால் KC ஆனது Kpயை விட அதிகமாக இருக்குமா அல்லது குறைவாக இருக்குமா?
விடை :
● np > nr எனில் Δng = +ve எனவே KC ஆனது Kp யை விட குறைவாக இருக்கும்.
● எ.கா. PCl5(g) = PCl3(g) + Cl2(g)
Δng = 2 – 1 = 1
ஃ Kp = KC (RT)1
Kp > KC
30. வினைகுணகத்தின் (Q) எண்மதிப்பு சமநிலைமாறிலியின் எண் மதிப்பை விட அதிகமாக இருந்தால், வினையானது சமநிலையை அடைய எந்த திசையினை நோக்கி நகரும்?
விடை :
● Q > KC எனில் வினை பின்னோக்கு திசையில் நிகழ்கிறது.
● அதாவது வினைபடு பொருள் உருவாகிறது.
31. A2(g) + B2(g) ⇌ 2AB(g); ΔH –எதிர்குறி என்ற வினையில் கீழே கொடுக்கப்பட்டுள்ளவை வினை பொருட்களின் மூலக்கூறுகளை குறித்துக் காட்டுகின்றன. (A - நீலம், B - சிவப்பு)
மூடிய அமைப்பு
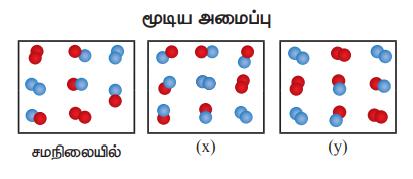
i) Kp மற்றும் KC சமநிலை மாறிலியினை கணக்கிடுக.
ii) காட்சி (x), (y) ஆகியவற்றால் குறிக்கப்படும் வினைக்கலவையில் வினையானது எந்த திசையில் நடைப்பெறும்
iii) சமநிலையில் உள்ள கலவையில் அழுத்தத்தை அதிகரித்தால் என்ன விளைவு நிகழும்.
விடை :
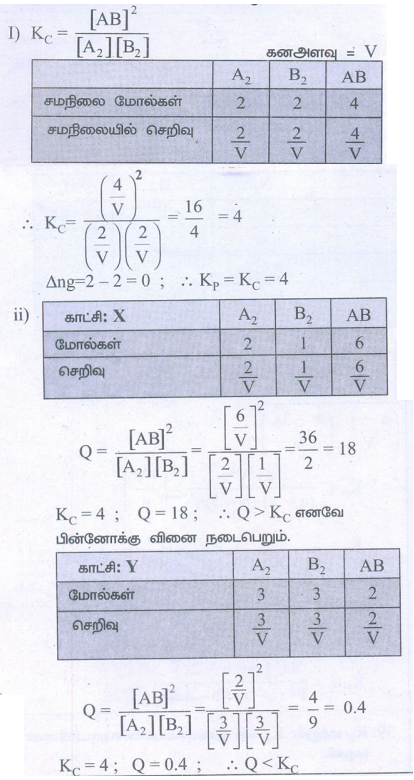
எனவே முன்னோக்கு வினை நடைபெறும்.
iii) சமநிலையில் np = nr = 2; ஃ Δng = 2 – 2 = 0
எனவே அழுத்தத்தை அதிகரிப்பது சமநிலையில் எவ்வித பாதிப்பையும் ஏற்படுத்துவதில்லை.
32. லீ - சாட்லியர் தத்துவம் வரையறு.
விடை :
சமநிலையில் உள்ள அமைப்பின் மீது ஒரு பாதிப்பினை ஏற்படுத்தும்போது, சமநிலையானது அப்பாதிப்பினால் ஏற்படும் விளைவினை ஈடு செய்யும் திசையில் தானே நகர்ந்து அவ்விளைவினை சரி செய்து கொள்ளும்.
33. கீழ்கண்டுள்ள வினைகளைக் கருதுக
a) H2 (g) + I2 (g) ⇌ 2 HI
b) CaCO3 (s) ⇌ CaO (s) + CO2 (g)
c) S(s) + 3F2 (g) ⇌ SF6 (g)
மேற்குறிப்பிட்டுள்ள ஒவ்வொரு வினைகளிலும், பெறப்படும் வினைவிளை பொருளின் அளவினை அதிகரிக்க கன அளவினை அதிகரிக்க அல்லது குறைக்க வேண்டுமா என்பதைக் கண்டுபிடி.
விடை :
a) Δng = 2 – 2 = 0; எனவே கனஅளவை அதிகரிப்பதாலோ அல்லது குறைப்பதாலோ சமநிலையில் எவ்வித மாற்றமுமில்லை.
b) Δng = 1 – 0 = 1; Δng = +ve எனவே கனஅளவை அதிகரிப்பதால் வினை முன்னோக்கி நகர்ந்து அதிக அளவு விளைபொருளை உருவாக்கும்.
c) Δng = 1 – 3 = - 2; Δng = -ve எனவே கன அளவை குறைப்பதால் வினை முன்னோக்கி நகர்ந்து அதிக அளவு விளைபொருளை உருவாக்கும்.
34. நிறைதாக்க விதியினை வரையறு.
விடை :
எந்த ஒரு நேரத்திலும், கொடுக்கப்பட்ட வெப்பநிலையில், ஒரு வேதிவினையின் வேகம் என்பது அந்நேரத்தில் உள்ள வினைபடு பொருள்களின் மோலார் செறிவுகளின் பெருக்கற் பலனுக்கு நேர்விகிதத்தில் இருக்கும்.
வினைவேகம் α [வினைபடுபொருள்]x
35. சமநிலை வினையின் திசையினை எவ்வாறு கணிப்பாய் என்பதை விவரி.
விடை :
Qன் மதிப்பை KC உடன் ஒப்பிட்டு நாம் வினையின் திசையினைத் தீர்மானிக்க இயலும்.
36. 3H2(g) + N2 (g) ⇌ 2NH3(g) என்ற வினையின் சமநிலை மாறிலி Kp மற்றும் Kc க்கான பொதுவான சமன்பாட்டினை வருவி.
விடை :
'a' மோல் நைட்ரஜன் மற்றும் ‘b' மோல் ஹைட்ரஜன் ஆகியன 'V' கனஅளவுள்ள ஒரு கலனில் எடுத்துக் கொள்ளப்பட்டு அம்மோனியா உருவாக்கப்படும் வினையைக் கருதுக. 'x' மோல் நைட்ரஜன் '3x' மோல் ஹைட்ரஜனுடன் வினைபுரிந்து 2x மோல் அம்மோனியா உருவாகிறது என்க.
N2(g) + 3H2(g) ⇌ 2NH3(g)

37. சமநிலை மாறிலி மதிப்பு
Kc = [NH3]4 [O2]5 / [NO]4 [H2O]6
கொண்ட ஒரு சமநிலை வினைக்கான, தகுந்த சமன்செய்யப்பட்ட வேதி சமன்பாட்டை தருக.
விடை :
4NO + 6H2O ⇌ 4NH3 + 5O2
38. சமநிலையில் உள்ள ஒரு வினையில், மாறாத கனஅளவில் மந்த வாயுக்களை சேர்ப்பதால் நிகழும்விளைவு என்ன?
விடை :
● மாறாத கன அளவில், சமநிலையில் உள்ள ஒரு அமைப்பில் ஒரு மந்த வாயு சேர்க்கப்படும் போது, கலனில் உள்ள வாயு மூலக்கூறுகளின் மொத்த எண்ணிக்கை அதிகரிக்கிறது.
● அதாவது வாயுக்களின் மொத்த அழுத்தம் அதிகரிக்கிறது.
● ஆனால் வினைபடுபொருட்கள் மற்றும் விளைபொருட்களின் பகுதி அழுத்தங்கள் அதிகரிப்பதில்லை.
● எனவே சமநிலையில் எவ்வித பாதிப்பும் ஏற்படுவதில்லை.
39. Kp மற்றும் KC க்கு இடையேயான தொடர்பினை வருவி.
விடை :
Kp மற்றும் KC ஆகியவற்றிக்கு இடையேயான தொடர்பு: வினைபடு பொருள்கள் மற்றும் வினைவிளை பொருள்கள் ஆகிய அனைத்தும் நல்லியல்பு வாயு நிலைமையில் உள்ள பின்வரும் பொதுவான வினை ஒன்றை நாம் கருதுவோம்.
xA + yB ⇌ lC + mD
சமநிலை மாறிலி KC ன் மதிப்பு
KC = [C]l [D]m / [A]x [B]y ....... (1)
மற்றும் Kp ன் மதிப்பு
Kp = PCl × PDm / PAx × PDm....... (2)

நல்லியல்பு வாயுச் சமன்பாட்டின் படி
PV = nRT or P = n/v RT எனவே, பகுதி அழுத்தம் P = மோலார் செறிவு × (RT) மேற்கண்டுள்ளதன் அடிப்படையில் வினைபடு பொருள்கள் மற்றும் வினைவிளைப் பொருள்களின் பகுதி அழுத்தங்களை பின்வருமாறு எழுத இயலும்.
PxA = [A]x [RT] x
Py B = [B]y [RT] y
Pl C = [C]l [RT]l
PmD = [D]m [RT] m
சமன்பாடு (2) ல் பிரதியிட

சமன்பாடு ( 1 ) மற்றும் ( 4 ) ஐ ஒப்பிடும்போது,
kp = Kc (RT)(Δng) ....... (5)
இங்கு,
Δng என்பது வாயு நிலைமையில் உள்ள வினைவிளைப்பொருள்களின் மோல்களின் எண்ணிக்கைக்கும், வினைபடுபொருள்களின் மோல்களின் எண்ணிக்கைக்கும் இடையேயான வேறுபாடாகும்.
எனவே, பின்வரும் தொடர்புகளை நாம் பெறலாம்.
Δng = 0 எனும்போது, Kp = KC (RT)° = KC
உதாரணம்: H2(g) + I2(g) ⇌ 2HI(g)
Δng ஆனது நேர்குறி மதிப்பை பெறும் போது
Kp = KC (RT)+ve
Kp > KC
PCl5(g) ⇌ PCl3(g) + Cl2(g)
Δng ஆனது எதிர்குறி மதிப்பை பெறும் போது
Kp = KC (RT)-ve
Kp < KC
எடுத்துக்காட்டு: 2SO2(g) +O 2(g) ⇌ 2SO3(g)
40. ஒரு லிட்டர் கனஅளவுடைய ஒரு மூடியகலனில், ஒரு மோல் PCl5 வெப்பப்படுத்தப்படுகிறது. சமநிலையில் 0.6 மோல் குளோரின் இருந்தால் சமநிலைமாறிலியின் மதிப்பினைகணக்கிடுக.
விடை :
கனஅளவு 1லி
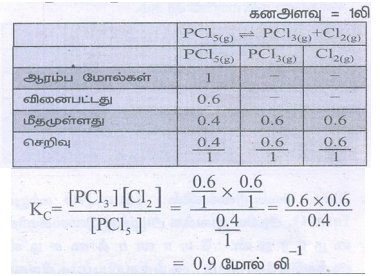
= 0.9 மோல் லி-1
41. SrCO3 (s) ⇌ SrO (s) + CO2(g), என்ற வினையில், 1002K ல் சமநிலை மாறிலி மதிப்பு Kp = 2.2 × 10-4. வினைக்கான KC மதிப்பினைக் கணக்கிடுக.
விடை :
SrCO3(s) ⇌ SrO(s) + CO2(g)
Kp = 2.2 × 10-4 ; Δng = 1 – 0 = 1 ; Kc = ?
T = 1002K; R = 0.0821 lit atm K-1 mol-1
Kp = Kc (RT)Δng
Kp = Kc (RT)
ஃ KC = Kp /RT
= 2.2 × 10-4 / 0.0821 × 1002
= 0.0267 × 10-4
= 2.67 × 10-6 mol lit-1
42. HI சிதைவடைதலை அறிந்து கொள்ள, ஒரு மாணவன் காற்று நீக்கப்பட்ட 3L குடுவையில் 0.3 மோல் HI வாயுவினை நிரப்புகிறான், 500°C ல் வினையினை நிகழ்த்துகிறான். சமநிலையில் HIன் செறிவு 0.05M என அவன் அறிந்துகொள்கிறான். இவ்வினைக்கு Kp மற்றும் KC மதிப்புகளை கணக்கிடுக.
விடை :
V = 3L
HIன் ஆரம்ப மோல்கள் = 0.3
ஃ HI ன் ஆரம்ப செறிவு = 0.3/3 = 0.1M
சமநிலையில் HIன் செறிவு = 0.05 M
வினைப்பட்ட HIன் செறிவு = 0.1 - 0.05
= 0.05 M
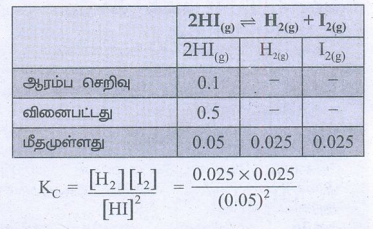
Kc = 0.25
Δng = 2 - 2 = 0
ஃ Kp = KC = 0.25
43. 500ml குடுவையில் 1 மோல் CH4 , 1மோல் CS2 , 2 மோல் H2S மற்றும் 2 மோல் H2 கலக்கப்படுகிறது. இவ்வினையின் சமநிலை மாறிலி KC = 4×10-2 mol2 lit-2. இவ்வினையானது சமநிலையை அடைய எந்த திசையில் நகரும்?
விடை :
CH4(g) + 2H2S(g) ⇌ CS2(g) + 4H2(g)
KC = 4 × 10-2 mol2 lit-2 V = 500ml = ½ L
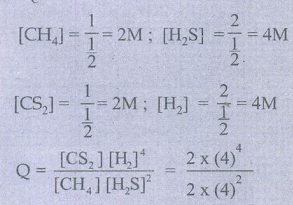
Q = 16
Q = 16 ; KC = 4 × 10-2
ஃ Q > KC எனவே வினை பின்னோக்கு திசையை நோக்கி நகரும்.
44. H2S(g) ⇌ H2(g) + ½ S2 (g) என்ற வினையில் ஒரு குறிப்பிட்ட வெப்பநிலையில் KC = 4 × 10-2 எனில்.
i) 2H2S (g) ⇌ 2H2 (g) + S2 (g)
ii) 3H2S (g) ⇌ 3H2 (g) + 3/2 S2 (g)
ஆகிய கொடுக்கப்பட்டுள்ள வினைகளுக்கு Kc மதிப்புகளைக் கணக்கிடுக.
விடை :
H2S(g) ⇌ H2(g) + ½ S2(g)
i) 2H2S(g) ⇌ 2H2(g) + S2(g)
ii) 3H2S (g) ⇌ 3H2(g) + 3/2 S2 (g)
KC
K1C = (KC)2
K11C = (KC)3
KC = 4 × 10-2
எனவே K1C = (KC)2 = (4 × 10-2)2 = 16 × 10-4
K11C = (KC)3 = (4 × 10-2)3 = 64 × 10-6
45. 1 L மூடிய கலனில் 28g N2 மற்றும் 6g H2 கலக்கப்படுகிறது. சமநிலையில் 17g NH3 உருவாகிறது. நைட்ரஜன் மற்றும் ஹைட்ரஜனின் எடையினை சமநிலையில் கணக்கிடுக.
விடை :
mN2 = 28g; mH2 = 6g ; mNH3 = 17g; V = 1L

சமநிலையில் N2 ன் எடை = சமநிலையில் மோல் எண்ணிக்கை × மோலார் நிறை
= 0.5 × 28 = 14g
சமநிலையில் H2 ன் எடை = சமநிலையில் மோல் எண்ணிக்கை × மோலார் நிறை
= 1.5 × 2 = 3g
46. XY2 சிதைவடைதலின், சமநிலை இவ்வாறு கொடுக்கப்பட்டுள்ளது
2XY2 (g) ⇌ 2XY (g) + Y2 (g)
பிரிகை வீதம் x ஒன்றை விட மிகச்சிறிதாக இருந்தால் 2Kp = PX3 என நிருபி. இங்கு P ஆனது மொத்த அழுத்தம் மற்றும் Kp என்பது, XY2 ன் சிதைவடைதல் மாறிலி ஆகும்.
விடை :

47. மொத்த அழுத்தம் 1.00 bar மற்றும் 800Kல் 1 மோல் A2(g) மற்றும் மோல்B2 (g)யினை கொண்டு ஒரு மூடிய கலன் நிரப்பப்படுகிறது. சமநிலையில், கலவையிலுள்ள பகுதிப் பொருள்களின் அளவினை கணக்கிடுக. (கொடுக்கப்பட்டவை: வினையின் Kp மதிப்பு 1)
A2 (g) + B2 (g) ⇌ 2AB(g)
விடை :

[A2] = 1 – x = 1 – 0.33 = 0.67
[B2] = 1 – x = 1 – 0.33 = 0.67
[AB] = 2x = 2 × 0.33 = 0.66
48. வான்ட் ஹாஃப் சமன்பாட்டினை வருவி.
விடை :
சமநிலை மாறிலியின் மதிப்பு வெப்பநிலையினைப் பொறுத்து அமைவதற்கான அளவியல் தொடர்பினை இச்சமன்பாடு தருகிறது. திட்டக்கட்டிலா ஆற்றல் மாற்றத்திற்கும் சமநிலைமாறிலிக்கும் இடையேயான தொடர்பு.
ΔG° = -RT ln K........... (1)
ΔG° = ΔH° - T Δ S° ........ (2)
என நாம் அறிவோம்.
(2) ஐ (1) ல் பிரதியிட
-RT ln K = ΔH° - T Δ S° மாற்றியமைக்க
ln K = -ΔH°/RT + ΔS°/R ....... (3)
சமன்பாடு (3) ஐ வெப்ப நிலையினைப் பொறுத்து வகையீடு செய்ய,
d(ln K) / dT = ΔH°/RT2....... (4)
சமன்பாடு (4) ஆனது வாண்ட்ஹாஃப் சமன்பாட்டின் வகையீட்டு வடிவம் எனப்படுகிறது.
சமன்பாடு (4) ஐ T1 மற்றும் T2 மற்றும் அவ்வெப்ப நிலைகள் சமநிலை மாறிலிகள் முறையே K1 மற்றும் K2 ஆகிய எல்லைகளுக்கிடையே தொகையீடு செய்க.
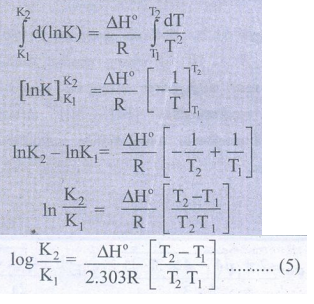
சமன்பாடு (5) ஆனது வாண்ட் ஹாஃப் சமன் பாட்டின் தொகையீட்டு வடிவமாகும்.
49. N2 (g) + 3H2 (g) ⇌ 2NH3(g) என்ற வினையில் 298K ல் Kp ன் மதிப்பு 8.19×102 மற்றும் 498K-ல் 4.6 × 10-1 ஆகும். வினைக்கான ΔHo னை கணக்கிடுக.
விடை :
Kp1 = 8.19 × 102 ; T1 = 298 K
Kp2 = 4.6 × 10-1 ; T2 = 498 K
ΔH° = ? R = 8.314 JK-1 mol-1

ΔH° = -46,182 J mol-1
ΔH° = - 46.182 KJ mol-1
50. 500°C வெப்பநிலையில், CaCO3 (S) ⇌ CaO (s) + CO2 (g) என்ற வினையில் CO2 ன் பகுதி அழுத்தம் 1.017×10-3 atm ஆகும். இவ்வினையில் 600°Cல், Kp க்கான மதிப்பினை கணக்கிடுக. இவ்வினையின் ΔH மதிப்பு 181KJ mol-1 மேலும் கொடுக்கப்பட்டுள்ள வெப்பநிலை எல்லையில் இதன் மதிப்பு மாறுவதில்லை.
விடை :
PCO2 = 1.017 × 10-3 atm
Kp = ? T1 = 500oC + 273 = 773K
T2 = 600oC + 273 = 873K
ΔH = 181 KJ mol-1
CaCO3(s) ⇌ CaO(s) + CO2(g)
Kp = PCO2
Kp1 = PCO2 = 1.017 × 10-3 atm ; T1 = 773K
Kp2 = ? T2 = 873 K ; R = 8.314 JK-1 mol-1
ΔHo = 181 KJ mol-1 = 181 × 103 Jmol-1

Kp2 = 25.12 × 1.017 × 10-3
Kp2 = 25.54 × 10-3 atm