கேள்விகளுக்கான பதில்கள் - சரியான விடையைத் தெரிவு செய்க | 11th Chemistry : UNIT 7 : Thermodynamics
11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
சரியான விடையைத் தெரிவு செய்க
மதிப்பீடு
I சரியான விடையைத் தெரிவு செய்க.
1. மாறாத வெப்பநிலை மற்றும் அழுத்தத்தில் சூழலுடன் பரிமாறிக் கொள்ளப்படும் வெப்பத்தின் அளவு
அ) ΔE
ஆ) ΔH
இ) ΔS
ஈ) ΔG
[விடை: ஆ) ∆H]
2. இயற்கையில் நிகழும் அனைத்து செயல்முறைகளும் __________ திசையில் நடக்கின்றன.
அ. என்ட்ரோபி குறையும்
ஆ. என்தால்பி அதிகரிக்கும்
இ) கட்டிலா ஆற்றல் அதிகரிக்கும்
ஈ) கட்டிலா ஆற்றல் குறையும்
[விடை: ஈ) கட்டிலா ஆற்றல் குறையும்.]
3. வெப்பம் மாறா செயல்முறையில் பின்வருவனவற்றுள் எது உண்மை?
அ) q = w
ஆ) q = 0
இ) ΔE = q
ஈ) PΔV = 0
[விடை: ஆ) q = 0]
4. ஒரு மீள் செயல்முறையில் அண்டத்தின் என்ட்ரோபி மாற்றம்
அ) > 0
ஆ) ≥ 0
இ) < 0
ஈ) = 0
[விடை: ஈ) = 0]
5. ஒரு நல்லியல்பு வாயு வெப்பம் மாறா முறையில் விரிவடைதலில்
அ) w = - Δu
ஆ) w = Δu + ΔH
இ) Δu = 0
ஈ) w = 0
[விடை: அ) w = −∆u]
6. பின்வரும் அளவீடுகளில் பொருண்மைசாரா பண்பு
அ) நிறை
ஆ) கனஅளவு
இ) என்தால்பி
ஈ) நிறை / கனஅளவு
[விடை: ஈ) நிறை /கனஅளவு]
7. 300 K வெப்பநிலையில் 1 × 10-3 m3 கன அளவிலிருந்து 1 × 10-2 m3 கனஅளவிற்கு 1 × 105 Nm2 அளவுள்ள மாறா அழுத்தத்தில் ஒரு நல்லியல்பு வாயு விரிவடையும் போது செய்யப்பட்ட வேலையின் அளவு
அ) -900 J
ஆ) 900 kJ
இ) 270 kJ
ஈ) - 900 kJ
[விடை: அ) − 900J ]
தீர்வு:
w = − P∆V
w = − (1 × 105 Nm−2) (1 × 10−2m3 −1 × 10−3m3)
w = −105 (10−2 − 10−3) Nm
w = −105 (10 − 1) 10−3) J
w = − 105 (9 × 10−3) J
w = − 9 × 10 2 J
w = − 900 J
8. எரிதல் வெப்பம் எப்பொழுதும்
அ) நேர்குறி மதிப்பு உடையது
ஆ) எதிர்குறி மதிப்பு உடையது
இ) பூஜ்ஜியம்
ஈ) நேர்குறி அல்லது எதிர்குறி மதிப்பு உடையது
[விடை: ஆ) எதிர்குறி மதிப்பு உடையது]
9. CO மற்றும் CO2 ஆகியவற்றின் உருவாதல் வெப்ப மதிப்புகள் முறையே -26.4 kCal மற்றும் -94 kCal, கார்பன் மோனாக்ஸைடின் எரிதல் வெப்ப மதிப்பு
அ) + 26.4 kcal
ஆ) - 67.6 kcal
இ) - 120.6 kcal
ஈ) + 52.8 kcal
[விடை: ஆ) −67.6 kcal]
தீர்வு:
CO(g) + ½ O2(g) → CO2(g)
∆HC0 (CO) = ∆Hf(CO2) – ∆Hf(CO) + ∆Hf (O2)
∆HC0 (CO) = −94KCal − [− 26.4KCal + 0]
∆HC0 (CO) = −94KCal + 26.4KCal
∆HC0 (CO) = −67.4KCal
10. C (வைரம்) → C (கிராஃபைட்), ΔH எதிர் குறியுடையது இது குறிப்பிடுவது
அ) வைரத்தை விட கிராஃபைட் அதிக நிலைப்புதன்மை கொண்டது.
ஆ) வைரத்தைவிட கிராஃபைட் அதிக ஆற்றலை கொண்டுள்ளது.
இ) இரண்டும் சமநிலைப்புத் தன்மை கொண்டவை.
ஈ) நிலைப்புத் தன்மையை நிர்ணயிக்க இயலாது.
[விடை: அ) வைரத்தை விட கிராஃபைட் அதிக நிலைப்புத் தன்மை கொண்டது]
11. Al2O3 மற்றும் Cr2O3 ஆகியவற்றின் உருவாதல் என்தால்பி மதிப்புகள் முறையே -1596 kJ மற்றும் –1134 kJ, எனில் 2Al + Cr2O3 → 2Cr + Al2O3 என்ற வினைக்கு ΔH மதிப்பு
அ) -1365 kJ
ஆ) 2730 kJ
இ) -2730 kJ
ஈ) - 462 kJ
[விடை: ஈ) −462kJ]
தீர்வு:
2Al + Cr2O3 → 2Cr + Al2O3
∆Hr0 = [2 ∆Hf(Cr) + ∆Hf (Al2O3)] − [2∆Hf (Al) + ∆Hf (Cr2O3)]
∆Hr0 = [0 + (−1596KJ)] − [0 + (−1134)]
∆Hr0 = −1596KJ + 1134 KJ
∆Hr0 = −462KJ
12. பின்வருவனவற்றுள் எது வெப்ப இயக்கவியல் சார்பு அல்ல?
அ) அகஆற்றல்
ஆ) என்தால்பி
இ) என்ட்ரோபி
ஈ) உராய்வு ஆற்றல்
[விடை: ஈ) உராய்வு ஆற்றல்]
13. ஒரு மூடிய கலனில், ஒரு மோல் அமோனியா மற்றும் ஒரு மோல் ஹைட்ரஜன் குளோரைடு கலக்கப்பட்டு அமோனியம் குளோரைடு உருவாக்கப்பட்டால் இவ்வினையில்
அ) ΔH > ΔU
ஆ) ΔH - ΔU = 0
இ) ΔH + ΔU = 0
ஈ) ΔH < ΔU
[விடை: ஈ) ∆H < ∆U]
14. ஒரு அமைப்பின் மீது 4kJ அளவு வேலை செய்யப்படுகிறது, மேலும் 1 kJ அளவு வெப்பமானது அமைப்பினால் வெளியேற்றப்படுகிறது எனில், அக ஆற்றலில் ஏற்படும் மாற்றம்
அ) + 1 kJ
ஆ) - 5 kJ
இ) + 3 kJ
ஈ) - 3 kJ
[விடை: இ) +3kJ]
தீர்வு:
∆U = q + w
∆U = − 1kJ + 4kJ
∆U = +3kJ
15. 25°C வெப்பநிலையில், திறந்த முகவையில் உள்ள ஹைட்ரோ குளோரிக் அமிலத்துடன், 55.85 கிராம் இரும்பு (மோலார் நிறை 55.85 கிராம் மோல்-1) வினைப்பட்டு வெளியேறும் ஹைட்ரஜன் வாயுவினால் செய்யப்பட்ட வேலை
அ) - 2.48 kJ
ஆ) - 2.22 kJ
இ) + 2.22 kJ
ஈ) + 2.48 kJ
[விடை: அ) − 2.48kJ]
தீர்வு:
Fe + 2HCl → FeCl2 + H2
ஒரு மோல் இரும்பு 1 மோல் ஹைட்ரஜன் வாயுவை வெளியேற்றுகிறது.
55.85 கி இரும்பு = 1மோல் இரும்பு
∴ n = 1
T = 25°C = 298K
w = −P∆V
w = −P [nRT/P]
w = −nRT
w = −1 × 8.314 × 298J
w = −2477.57J
w = −2.48kJ
16. 2 மோல்கள் நல்லியல்பு ஓரணு வாயுவை மாறா அழுத்தத்தில் 125° C லிருந்து 25° C க்கு குளிர்விக்கும்போது ΔHன் மதிப்பு [ கொடுக்கப்பட்டது CP = (5 / 2) R ]
அ) - 250 R
ஆ) - 500 R
இ) 500 R
ஈ) +250 R
[விடை: ஆ) −500 R ]
தீர்வு:
Ti = 125 °C = 398K
Tf = 25°C = 298K
∆H = nCp(Tf − Ti)
∆H = 2 × 5/2 R(298 − 398)
∆H = −500R
17. C (g) + O2 (g) → CO2 (g) ΔH° = - a kJ; 2CO (g) + O2 (g) → 2CO2 (g) ΔH° = - b kJ; எனில் C(g) + 1/2 O2 (g) → CO (g) என்ற வினைக்கு ΔH0 மதிப்பு
அ) (b + 2a) / 2
ஆ) 2a-b
இ) (2a – b) / 2
ஈ) (b - 2a) / 2
[விடை: ஈ) (b − 2a)/2]
தீர்வு:
C + O2 → CO2 ∆H0 = − a kJ …........(i)
2CO + O2 → 2CO2 ∆H0 = −b kJ......(ii))
C + ½ O2 → CO ∆H0 = ?
(i) × 2
2C + 2O2 → 2CO2 ∆H0 = −2a kJ....(iii)
சமன்பாடு (ii) ஐ திருப்பி எழுதுக
2CO2 → 2CO + O2 ∆H0 = + b kJ.....(iv)
(iii) + (iv),
2C + O2 → 2CO ∆H0 = b − 2a kJ.....(v)
(v) + 2
C + O2 → CO ∆H0 = (b − 2a)/2 kJ
18. 0°C வெப்பநிலை மற்றும் 1 atm அழுத்தத்தில் 15.68 L மீத்தேன் மற்றும் புரப்பேன் கலந்த வாயுக்கலவையை முற்றிலுமாக எரிக்க, அதே வெப்ப அழுத்தநிலையில் 32 L ஆக்ஸிஜன் தேவைப்படுகிறது, எனில் இந்த எரிதல் வினையில் வெளிப்படும் வெப்பத்தின் அளவு kJ அலகில்.
அ) - 889 kJ
ஆ) – 1390 kJ
இ) -3180 kJ
ஈ) - 632.68 kJ
[விடை: ஈ) - 632.68 kJ]
தீர்வு:
கொடுக்கப்பட்டவை
AHC(CH4) = -890 kJ mol−1
∆HC(C3H8) = -2220 kJ mol−1
கலவையானது x லிட்டர் மீத்தேனையும் (15.68 − x) லிட்டர் புரப்பேனையும் கொண்டு இருப்பதாகக் கருதுக.
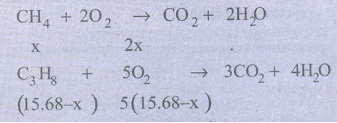
வினைப்பட்ட ஆக்சிஜனின் கனஅளவு = 2x + 78.4 – 5x = 32 லிட்டர்
78.4 – 3x = 32
3x = 46.4 லிட்டர்
x = 15.47 லிட்டர்
கொடுக்கப்பட்டுள்ள கலவையானது 15.47 லிட்டர் மீத்தேனையும் 0.213 லிட்டர் புரப்பேனையும் கொண்டுள்ளது, எனவே

∆HC = −635.47 kJmol−1
19. மீத்தேன் மற்றும் ஈத்தேன் ஆகியவற்றின் பிணைப்பு பிளத்தல் ஆற்றல்கள் முறையே, 360 kJ mol-1 மற்றும் 620 kJ mol-1 எனில் C-C ஒற்றை பிணைப்பின் பிளத்தல் ஆற்றல்.
அ) 170 kJ mol-1
ஆ) 50 kJ mol-1
இ) 80 kJ mol-1
ஈ) 220 kJ mol-1
[விடை: இ) 80kJ mol−1]
தீர்வு:
4EC−H = 360 kJ mol−1
EC−H = 90 kJ mol−1
EC−C + 6 EC−H = 620 kJ mol−1
EC−C + 6 × 90 = 620 kJ mol−1
EC−C + 540 = 620 kJ mol−1
EC−C = 80 kJ mol−1
20. அனைத்து வெப்பநிலைகளிலும், ஒரு தன்னிச்சையான வினைக்கு சரியான வெப்ப இயக்கவியல் நிபந்தனைகள்
அ) ΔH < 0 மற்றும் ΔS > 0
ஆ) ΔH < 0 மற்றும் ΔS < 0
இ) ΔH > 0 மற்றும் ΔS = 0
ஈ) ΔH > 0 மற்றும் ΔS > 0
[விடை: அ) ∆H < O மற்றும் ∆S > 0 ]
21. ஒரு அமைப்பின் வெப்பநிலை பின்வரும் __________ ல் குறைகிறது.
அ) வெப்பநிலை மாறா விரிவடைதல்
ஆ) வெப்பநிலை மாறா சுருங்குதல்
இ) வெப்பம் மாறா விரிவடைதல்
ஈ) வெப்பம் மாறா சுருங்குதல்
[விடை: இ) வெப்பம் மாறா விரிவடைதல்]
22. ஒரு நல்லியல்பு வாயுவின் வெப்பநிலை மாறா மீள்சுருங்குதல் செயல்முறையில், q, ΔS மற்றும் w ஆகியவற்றின் குறிகள் முறையே
அ) +, -, -
ஆ) -, +, -
இ) +, -, +
ஈ) -, -, +
[விடை: ஈ) −, −, +]
23. ஒரு திரவத்தின் மோலார் ஆவியாதல் வெப்பம் 4.8 kJ mol-1, அதன் என்ட்ரோபி மாற்ற மதிப்பு 16 J K-1 mol-1 எனில் அந்த திரவத்தின் கொதிநிலை
அ) 323 K
ஆ) 27° C
இ) 164 K
ஈ) 0.3 K
[விடை: ஆ) 27°C]
தீர்வு:
ΔSV = ΔΗV/Тb
Тb = ΔΗV / ΔSV = 4800Jmol−1 /16Jmol−1K−1 = 300K = 27° C

24. பின்வரும் வினைகளில் எது அதிகபட்ச என்ட்ரோபி மாற்றத்தை கொண்டிருக்கும்?
அ) Ca (S) + 1/2 O2 (g) → CaO (S)
ஆ) C (S) + O2 (g) → CO2 (g)
இ) N2 (g) + O2 (g) → 2NO (g)
ஈ) CaCO3 (S) → CaO (S) + CO2 (g)
[விடை: ஈ) CaCO3(S) → CaO(S) + CO2(g)]
தீர்வு:
CaCO3(s) → CaO(s) + CO2(g) மட்டும் ∆S நேர்குறி (அ) மற்றும் (ஆ) ∆S எதிர்குறி (இ) ∆S = 0
25. ஒரு குறிப்பிட்ட வினையின் ΔH மற்றும் ΔS மதிப்புகள் முறையே 30 kJ mol-1 மற்றும் 100 JK-1 mol-1 எனில், எந்த வெப்பநிலைக்கு மேல் வினையானது தன்னிச்சையாக நிகழும்.
அ) 300 K
ஆ) 30 K
இ) 100 K
ஈ) 20° C
[விடை: அ) 300 K ]
தீர்வு:
∆G = ∆H − T∆S
At 300K
∆G = 30000Jmol−1 − (300K × 100JK−1 mol−1)
∆G = 0
300 K மேல் ∆G ஆனது எதிர்குறி மதிப்பினைப் பெறுகிறது. மேலும் வினை தன்னிச்சையானது.