வேதியியல் - என்தால்பி (H) | 11th Chemistry : UNIT 7 : Thermodynamics
11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
என்தால்பி (H)
என்தால்பி (H)
என்தால்பி என்பது அமைப்பின் ஒரு வெப்ப இயக்கவியல் பண்பு. ஒரு அமைப்பின் அகஆற்றல் (U), மற்றும் அவ்வமைப்பின் அழுத்தம் மற்றும் கனஅளவின் பெருக்கற்பலன் (PV) ஆகியவற்றின் கூடுதல் என்தால்பி என வரையறுக்கப்படுகிறது. அதாவது,
H = U + PV ---------- (7.8)
இது அமைப்பின் வேலை செய்யும் திறன் மற்றும் அமைப்பின் வெப்பத்தை வெளிவிடும் திறன் ஆகியவற்றை குறிப்பிடுகிறது. மாறாத அழுத்தத்தில் ஒரு செயல்முறை நிகழும்போது, வெளிப்படும் அல்லது உறிஞ்சப்படும் வெப்பத்தின் அளவு என்தால்பி மாற்றத்திற்கு சமம்.
என்தால்பி ஒருநிலைச் சார்பாகும், இது அமைப்பின் நிலை மாறிகளான T, P மற்றும் U ஆகியவற்றை மட்டுமே பொறுத்து அமைகிறது. மாறாத அழுத்தத்தில் ஒரு அமைப்பின் ஆரம்ப மற்றும் இறுதி நிலைகளுக்கிடையேயான என்தால்பியில் ஏற்படும் மாற்றமாகவே (ΔH) என்தால்பி (H) குறிக்கப்படுகிறது.
ΔH = ΔU + PΔV ---------- (7.9)
மாறாத அழுத்தத்தில் ஒரு அமைப்பிற்கு கொடுக்கப்படும் வெப்பம் (q ) அதன் என்தால்பி மாற்றத்திற்குச் சமம் (அமைப்பானது வேறெந்த கூடுதல் வேலையும் செய்யாத வரையில்)
ΔH = qp
ஒரு வெப்பம்கொள் வினையில் அமைப்பினால் சூழலில் இருந்து வெப்பம் உறிஞ்சப்படுகிறது. அதாவது q > 0 (நேர்குறி மதிப்பு). எனவே ΔH மதிப்பும் நேர்குறியை பெறுகிறது. ஒரு வெப்பம் உமிழ்வினையில் அமைப்பிலிருந்து சூழலுக்கு வெப்பம் வெளியேற்றப்படுகிறது. அதாவது q < 0 (எதிர்குறி மதிப்பு). எனவே ΔH மதிப்பும் எதிர்குறியை பெறுகிறது.
1. என்தால்பி (H) மற்றும் அகஆற்றல் (U) ஆகியவற்றிற்கு இடையேயான தொடர்பு
ஒரு அமைப்பானது மாறாத அழுத்தத்தில், ஆரம்ப நிலையிலிருந்து (H1, U1, V1, மற்றும் P) இறுதிநிலைக்கு (H2, U2, V2 மற்றும் P) மாற்றத்திற்குட்படும் போது ஏற்படும் என்தால்பி மாற்றத்தை ΔH, பின்வருமாறு கணக்கிட முடியும்.
H = U + PV
ஆரம்ப நிலையில்
H1 = U1 + PV1 ---------- (7.10)
இறுதி நிலையில்
H2 = U2 + PV2 ---------- (7.11)
என்தால்பியில் ஏற்படும் மாற்றம் (7.11) - (7.10)
(H2 – H1) = (U2 – U1) + P (V2 – V1)
ΔH = ΔU + PΔV ---------- (7.12)
வெப்ப இயக்கவியல் முதல் விதிப்படி
ΔU = q + w
சமன்பாடு 7.12 ல் பிரதியிட
ΔH = q + w + PΔV
w = - PΔV
ΔH = qp - PΔV + PΔV
ΔH = qp --------- (7.13)
qp - என்பது மாறாத அழுத்த நிலையில் உறிஞ்சப்பட்ட வெப்பம், இது உள்ளுறை வெப்பம் அல்லது வெப்ப அடக்கம் எனப்படுகிறது.
மாறாத வெப்ப அழுத்த நிலைகளில் ஒன்றுடன் ஒன்று வேதிவினை புரிந்து வாயு நிலையுள்ள விளைபொருட்களை தரும் வாயுக்கள் அடங்கிய மூடிய அமைப்பு ஒன்றைக் கருதுக. வினைபடு வாயுக்களின் ஆரம்ப கனஅளவு Vi எனவும் வினைவிளை வாயுக்களின் கனஅளவு Vf, எனவும் அவற்றின் மோல் எண்ணிக்கை முறையே ni மற்றும் nf எனக் கொண்டால்
வினைபடு பொருட்களுக்கு (ஆரம்ப நிலை)
PVi = ni RT ---------- (7.14)
விளை பொருட்களுக்கு (இறுதி நிலை) :
PVf = nf RT ---------- (7.15)
(7.15) - (7.14)
P (Vf – Vi) = (nf – ni) RT
PΔV = Δn(g) RT ---------- (7.16)
சமன்பாடு 7.16 ஐ சமன்பாடு 7.12 ல் பிரதியிட
ΔΗ = ΔU + Δn(g) RT ---------- (7.17)
2. பல்வேறு வகை வினைகள் மற்றும் நிலைமை மாற்றங்களுக்கான என்தால்பி மாற்றங்கள்:
ஒரு வேதிவினையோடு தொடர்புடைய வெப்பம் அல்லது என்தால்பி மாற்றமானது வினையின் இயல்பினை பொருத்து வெவ்வேறு வகைகளில் குறிப்பிடப்படுகிறது. அவைகளை பின்வருமாறு விளக்கலாம்.
திட்ட உருவாதல் வெப்பம்:
ஒரு மோல் சேர்மமானது, திட்ட வெப்ப, அழுத்த நிலைகளில் (298 K மற்றும் 1 bar அழுத்தம்) உள்ள அதன் தனிமங்களிலிருந்து உருவாகும் போது ஏற்படும் என்தால்பி மாற்றம் அச்சேர்மத்தின் திட்ட உருவாதல் வெப்பம் என வரையறுக்கப்படுகிறது.
நடைமுறையில் அனைத்து தனிமங்களின் திட்ட உருவாதல் வெப்பம் பூஜ்ஜியம் என எடுத்துக் கொள்ளப்படுகிறது.
Fe (s) + S (s) → FeS (s)
ΔHf0 = - 100.42 kJ mol−1
2C (s) + H2 (g) → C2H2 (g)
ΔHf0 = + 222.33 kJ mol−1
1/2 Cl2 (g) + 1/2 H2 (g) → HCl (g)
ΔHf0 = - 92.4 kJ mol−1
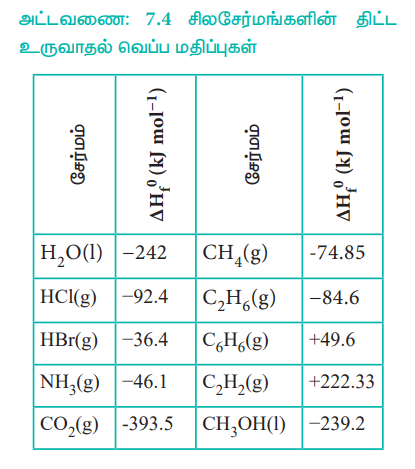
சில சேர்மங்களின் திட்ட உருவாதல் வெப்ப மதிப்புகள் அட்டவணை 7.4 ல் கொடுக்கப்பட்டுள்ளன.
அட்டவணை: 7.4 சிலசேர்மங்களின் திட்ட உருவாதல் வெப்ப மதிப்புகள்