பெயரிடுதல், தயாரித்தல் முறைகள், இயற் மற்றும் வேதிப் பண்புகள், பயன்கள் - ஹேலோஆல்கேன்கள் | 11th Chemistry : UNIT 14 : Haloalkanes and Haloarenes
11 வது வேதியியல் : அலகு 14 : ஹேலோ ஆல்கேன்கள் மற்றும் ஹேலோ அரீன்கள்
ஹேலோஆல்கேன்கள்
ஹேலோஆல்கேன்கள்
ஆல்கேன்களின் மோனோஹேலோ பெறுதிகள் ஹேலோ ஆல்கேன்கள் என அழைக்கப்படுகின்றன. ஹேலோ ஆல்கேன்கள் R - X, என்ற பொதுவான வாய்ப்பாட்டினால் குறிக்கப்படுகின்றன. இங்க (Cn H2n+1) என்பது ஆல்கைல் தொகுதியையும் X என்பது (X=F, Cl, Br அல்லது I) ஹாலஜன் அணுவினையும் குறிப்பிடுகின்றது.
எடுத்துக்காட்டு :
ஓரிணையை ஹேலோ ஆல்கேன்கள்

ஈரிணைய ஹேலோ ஆல்கேன்கள்

மூவிணைய ஹேலோ ஆல்கேன்கள்

1. பெயரிடுதல்
பொதுவான பெயரிடும் முறை
வழக்கமான முறையில், ஹேலோ ஆல்கேன்கள் ஆல்கைல் ஹாலைடுகள் என பெயரிடப்படுகின்றன. பெயரிடும்போது ஆல்கைல் தொகுதியின் பெயரிடுதலைத் தொடர்ந்து ஹேலைஷன் பெயர் எழுதப்படுகிறது.
IUPAC முறை
அலகு எண் 11 ல் விளக்கப்பட்டுள்ள IUPAC முறையினைப் பின்பற்றி பின்வரும் ஹேலோ ஆல்கேன்களுக்கு நாம் பெயரிடுவோம்.
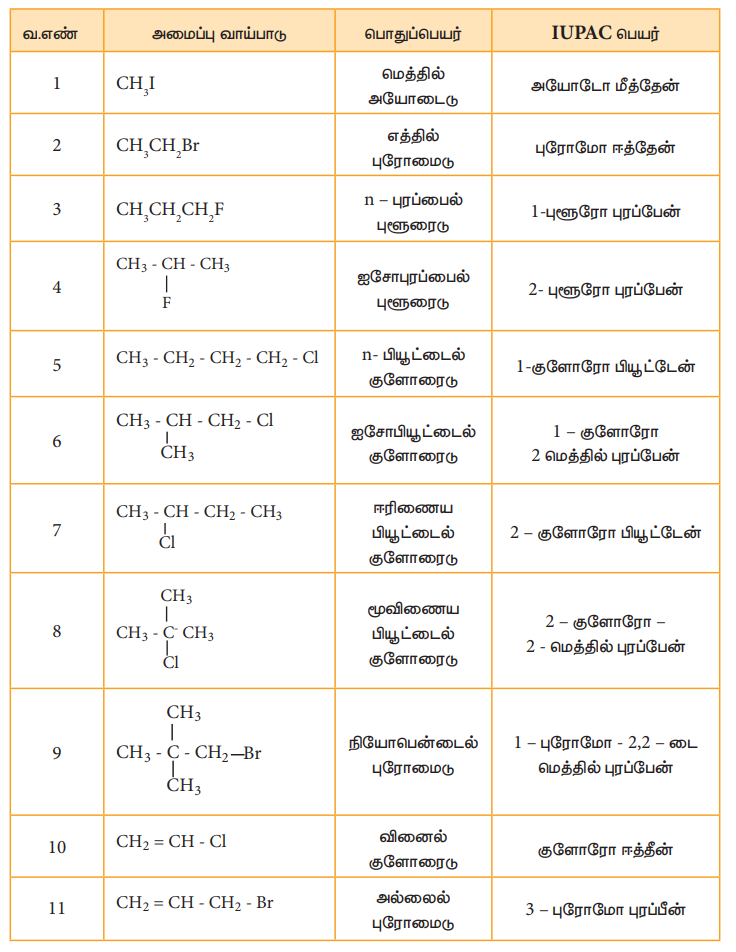
பல ஹாலஜன் சேர்மங்கள்
சில பாலி ஹாலஜன் சேர்மங்களுக்கான IUPAC பெயர் பின்வருமாறு
தன் மதிப்பீடு
1) பின்வருவற்றிற்கு IUPAC முறையில் பெயரிடுக.

தீர்வு:

தன் மதிப்பீடு
2) பின்வரும் சேர்மங்களுக்கு அமைப்பு வாய்பாட்டினை எழுதுக
i) 1 - புரோமோ - 4 - எத்தில் சைக்ளோஹெக்ஸேன்
ii) 1,4 - டைகுளோரோ பியூட் - 2 - ஈன்
iii) 2 - குளோரோ - 3 - மெத்தில் பென்டேன்
தீர்வு:

2. ஹேலோ ஆல்கேனின் C – X பிணைப்பின் தன்மை
ஹாலஜனானது கார்பனைக் காட்டிலும் அதிக எலக்ட்ரான் கவர் தன்மை உடையது. ஆதலால் கார்பன் - ஹாலஜன் பிணைப்பானது முனைவுத் தன்மையைக் கொண்டுள்ளது. கார்பன் அணுவானது பகுதி நேர்மின் தன்மையினையும் (δ+) ஹாலஜன் அணுவானது பகுதி எதிர்மின் தன்மையினையும் (δ-)பெற்றுள்ளது.
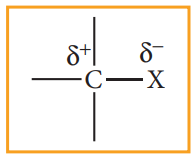
கார்பனின் sp3 இனக்கலப்பு ஆர்பிட்டாலுடன், ஹேலஜன் அணுவின் சரிபாதி நிரப்பப்பட்ட p-ஆர்பிட்டால் மேற்பொருந்துவதால் C-X பிணைப்பு உருவாகிறது. புளூரினிலிருந்து அயோடினை நோக்கிச் செல்லும்போது ஹேலஜன் அணுவின் உருவளவு அதிகரிக்கின்றது. இதனால் C-X பிணைப்பு நீளமும் அதிகரிக்கின்றது. உருவளவு அதிகமாக இருப்பின், பிணைப்பு நீளமும் அதிகமாக இருக்கும், மேலும் உருவாகும் பிணைப்பின் வலிமை குறைவாக இருக்கும். CH2-Xல் C-X பிணைப்பின் வலிமை C-F லிருந்து C-Iஐ நோக்கிச் செல்ல குறையும். C-F லிருந்து C-I ஐ நோக்கிச் செல்லும் போது, பிணைப்பு நீளம், பிணைப்பு ஆற்றல் மற்றும் பிணைப்பின் முனைவு ஆகியவற்றில் ஏற்படும் மாறுபாடுகள் பின்வரும் அட்டவணையில் தரப்பட்டுள்ளன.
கார்பன் - ஹாலஜன் பிணைப்பு நீளம், பிணைப்பு ஆற்றல் மற்றும் பிணைப்பின் முனைவினைக் காட்டும் அட்டவணை:

3. தயாரித்தல் முறைகள்
ஹேலோ ஆல்கேன்களை பின்வரும் முறைகளில் தயாரிக்கலாம்.
1) ஆல்கஹால்களிலிருந்து
பின்வரும் ஏதேனும் ஒரு வினைக் காரணிகளுடன் ஆல்கஹாலை வினைப்படுத்துவதன் மூலம் அதனை ஆல்கைல் ஹேலைடுகளாக மாற்றலாம்.
● ஹைட்ரஜன் ஹேலைடு
● பாஸ்பரஸ் ஹேலைடுகள்
● தயோனைல் குளோரைடு
அ. ஹைட்ரஜன் ஹேலைடுடன் வினை

அடர் HCl மற்றும் நீரற்ற ZnCl2 ஆகியவற்றின் கலவை லூகாஸ் வினைப்பொருள் எனப்படுகிறது.

ஹேலோ அமிலங்கள், ஆல்கஹாலுடன் புரியும் வினையின் வேகம் பின்வரும் வரிசையில் அமையும் HI > HBr > HCl ஆல்கஹால்கள் ஹேலோ அமிலங்களுடன் வினைபுரியும் வினைத் திறனின் வரிசை: மூவிணைய ஆல்கஹால் > ஈரிணைய ஆல்கஹால் > ஓரிணைய ஆல்கஹால்.
ஆ. பாஸ்பரஸ் ஹாலைடுகளுடன் வினை
ஆல்கஹால்கள் PX5 அல்லது PX3 உடன் வினைபுரிந்து ஹேலோ ஆல்கேன்களைத் தருகின்றன. PBr3 மற்றும் PI3 ஆகியன வழக்கமாக சிவப்பு பாஸ்பரஸை புரோமின் மற்றும் அயோடினுடன் முறையே வினைப்படுத்தி, வினைநிகழும் வினைக் கலவையிலேயே உருவாக்கப்படுகின்றன.
எடுத்துக்காட்டு

இ) தயோனைல் குளோரைடுடன் வினை
எடுத்துக்காட்டு

இவ்வினை டார்சனின் ஹேலஜனேற்ற வினை எனப்படுகிறது.
2) ஆல்கீன்களிலிருந்து பெறுதல்
ஆல்கீன்கள் ஹேலஜன் அமிலங்கள் (HCl,HBr,HI) உடன் வினைபட்டு ஹேலோ ஆல்கேன்களைத் தருகின்றன. சேர்க்கை வினையானது மார்கோனிகாப் விதியினைப் பின்பற்றி நிகழ்கிறது.
3) ஆல்கேன்களிலிருந்து பெறுதல்
ஆல்கேன்கள் ஹேலஜனுடன் (Cl2 அல்லது Br2) UV ஒளி முன்னிலையில் வினைபட்டு ஹேலோ ஆல்கேன்களைத் தருகிறது. இவ்வினை தனிஉறுப்பு பதிலீட்டு வினையாகும். மேலும் வினையில் மோனோ, டை அல்லது பல பதிலிடப்பட்ட ஹேலோ ஆல்கேன்கள் உருவாகின்றன.
எடுத்துக்காட்டு
மீத்தேனை குளோரினேற்றம் செய்யும் போது வெவ்வேறு கொதிநிலை உடைய விளைப் பொருள்கள் உருவாகின்றன. எனவே இவைகளை பின்னவாலை வடித்தல் முறையில் பிரிக்க இயலும்.

4) ஹாலஜன் பரிமாற்ற வினைகள்
அ) ஃபின்கெல்ஸ்டீன் வினை
குளோரோ அல்லது புரோமோ ஆல்கேன்களை உலர் அசிட்டோனில் உள்ள செறிவு மிகுந்த சோடியம் அயோடைடுடன் வெப்பப்படுத்தும் போது அயோடோ ஆல்கேன்கள் உருவாகின்றன. இவ்வினை ஃபின்கெல்ஸ்டீன் வினை என்றழைக்கப்படுகிறது. (SN2வினை).

ஆ. ஸ்வார்ட்ஸ் வினை
குளோரோ அல்லது புரோமோ ஆல்கேன்களை, AgF, SbF3 அல்லது Hg2F2 ஆகிய உலோக புளூரைடுகளுடன் வெப்பப்படுத்தும் போது புளூரோ ஆல்கேன்கள் உருவாகின்றன. இவ்வினை ஸ்வார்ட்ஸ் வினை எனப்படும்.
எடுத்துக்காட்டு

5) கொழுப்பு அமிலங்களின் வெள்ளி உப்புகளிலிருந்து பெறுதல் (ஹன்ஸ்டைக்கர் வினை)
கொழுப்பு அமிலங்களின் சில்வர் உப்புகளை CCl4 ல் உள்ள புரோமினுடன் வினைப்படுத்த புரோமோ ஆல்கேன் உருவாகிறது.

4. இயற்பண்புகள்
1. தூய ஹேலோ ஆல்கேன்கள் நிறமற்றவை. ஒளியின் முன்னிலையில் புரோமோ மற்றும் அயோடோ ஆல்கேன்கள் நிறமுடையவை.
2. ஒன்று, இரண்டு அல்லது மூன்று கார்பன்களைப் பெற்றுள்ள ஹேலோ ஆல்கேன்கள் அறை வெப்பநிலையில் வாயுநிலையில் காணப்படுகின்றன. மூன்றிற்கும் மேற்பட்ட கார்பன் அணுக்களைப் பெற்றுள்ள ஹேலோ ஆல்கேன்கள் திரவ அல்லது திட நிலையில் காணப்படுகின்றன.
3. கொதிநிலை மற்றும் உருகுநிலை:
i) ஹேலோ ஆல்கேன்கள் அவைகளின் மூல ஆல்கேன்களைக் காட்டிலும் அதிக கொதிநிலை மற்றும் உருகுநிலையைப் பெற்றுள்ளன. ஏனெனில் ஹேலோ ஆல்கேன்களில் மூலக்கூறுகளுக்கிடையேயான கவர்ச்சிவிசை (இருமுனை-இருமுனை விசை மற்றும் வாண்டர் வால்ஸ் விசை) வலிமையானவை.
ii) ஹேலஜன்களைப் பொறுத்து ஹேலோ ஆல்கேன்களின் கொதிநிலை மற்றும் உருகுநிலை பின்வரும் வரிசையில் அமையும்.
எடுத்துக்காட்டு
CH3I > CH3Br > CH3CI > CH3F
iii) ஹேலஜன் அணுக்களின் எண்ணிக்கை அதிகரிப்பின் ஹேலோ ஆல்கேன்களின் கொதிநிலையும் அதிகரிக்கும்.
எடுத்துக்காட்டு
CCl4 > CHCl3 > CH2Cl2 > CH3Cl
iv) கார்பன் அணுக்களின் எண்ணிக்கை அதிகரிப்பின், மோனோஹேலோ ஆல்கேன்களின் கொதிநிலை மற்றும் உருகுநிலை அதிகரிக்கும்.
எடுத்துக்காட்டு
CH3 CH2 CH2 Cl > CH3 CH2 Cl > CH3 Cl
v) மாற்றிய ஹாலைடுகளுக்கிடையே ஆல்கைல் தொகுதியின் பக்க சங்கிலிகளைப் பொறுத்து கொதிநிலை அமைகின்றது. பக்க சங்கிலிகள் அதிகரிக்கும் போது மூலக்கூறானது குறைவான புறப்பரப்பு உடைய கோளக வடிவத்தினைப் பெறுகிறது. எனவே மூலக்கூறுகளுக்கு இடையேயான விசை குறைவதால் கொதிநிலை குறைகின்றது.
எடுத்துக்காட்டு
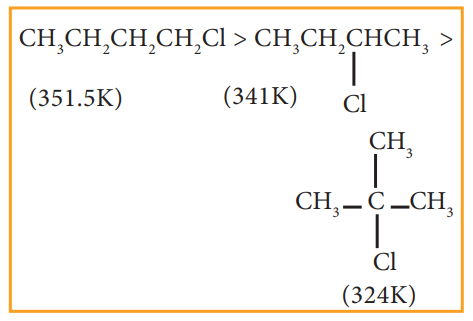
4. கரை திறன்
ஹேலோ ஆல்கேன்கள் முனைவுற்ற சகப்பிணைப்புச் சேர்மங்களாகும். இவை கரிமக் கரைப்பான்களில் கரைகின்றன. ஆனால் நீரில் கரைவதில்லை. ஏனெனில் இவைகளால் நீருடன் ஹைட்ரஜன் பிணைப்பினை ஏற்படுத்த இயலாது.
5. அடர்த்தி:
ஒப்பிடத்தக்க மூலக்கூறு எடை உடைய ஹைட்ரோ கார்பன்களைக் காட்டிலும் திரவ நிலையில் உள்ள ஆல்கைல்ஹேலைடுகளின் அடர்த்தி அதிகம்.
தன் மதிப்பீடு
3) C5H11Cl என்ற மூலக்கூறு வாய்பாடுடைய சேர்மத்திற்கு சாத்தியமான அனைத்து சங்கிலி மாற்றியங்களையும் எழுதுக.
தீர்வு:
அனைத்து சாத்தியமான சங்கிலி மாற்றியங்கள்:

5. வேதிப் பண்புகள்
கரிமச் சேர்மங்களில், ஹேலோ ஆல்கேன்கள் ஒரு முக்கிய வினைபுரியும் சேர்மமாகும். இவைகளில் முனைவுற்ற கார்பன் - ஹேலஜன் பிணைப்பு காணப்படுவதால் இவை அதிக வினைதிறனைப் பெற்றுள்ளன.
ஹேலோ ஆல்கேன்களின் வினைகளை பின்வருமாறு வகைப்படுத்தலாம்.
i. கருக்கவர் பொருள் பதிலீட்டு வினைகள்
ii. நீக்க வினைகள்
iii. உலோகங்களுடன் வினை
iv. ஒடுக்க வினை.
1) கருக்கவர் பொருள் பதிலீட்டு வினைகள்
C δ+ - X δ - பிணைப்பானது முனைவுற்றது என நாம் அறிவோம். எனவே கருக்கவர் காரணிகள் பகுதி நேர்மின்சுமை உடைய கார்பன் அணுவினால் கவரப்படுகின்றன. இதனால் பதிலீட்டு வினை நடைபெறுகிறது.
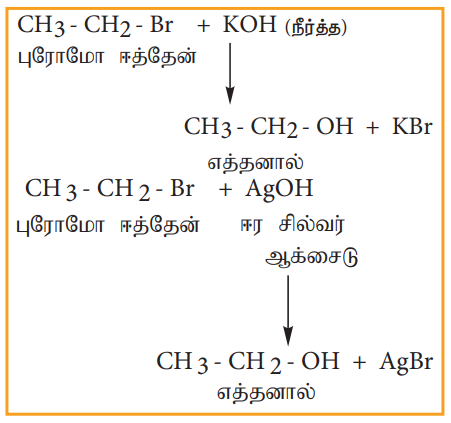
நீர்த்த காரங்கள் அல்லது ஈரமான சில்வர் ஆக்சைடுடன் வினை (நீராற்பகுப்பு)
ஹேலோ ஆல்கேன்கள் நீர்த்த KOH அல்லது ஈரமான சில்வர் ஆக்ஸைடுடன் (Ag2O/H2O) வினைபுரிந்து ஆல்கஹாலைத் தருகின்றன.
எடுத்துக்காட்டு
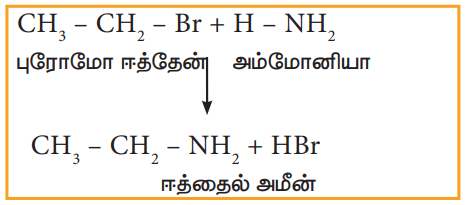
i) ஆல்கஹால் கலந்த அம்மோனியாவுடன் வினை (அம்மோனியா ஏற்றம்)
ஹேலோ ஆல்கேன்கள் ஆல்கஹால் கலந்த அம்மோனியாவுடன் வினைப்பட்டு ஆல்கைல் அமீன்களைத் தருகின்றன.
எடுத்துக்காட்டு
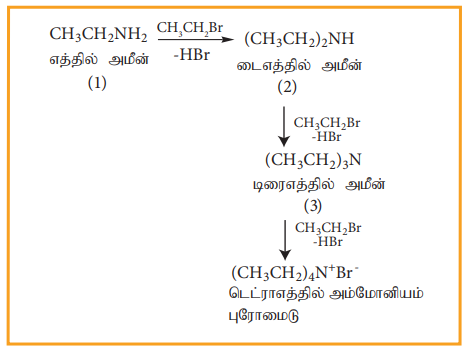
எனினும், ஹேலோ ஆல்கேன்கள் அதிகளவில் இருப்பின் ஈரிணைய மற்றும் மூவிணைய அமீன்களுடன் நான்கிணைய அம்மோனியம் உப்புகளும் உருவாகின்றன.
இருமைத் தன்மை உடைய கருக்கவர் பொருட்கள்
சயனைடு மற்றும் நைட்ரேட் அயனி போன்றவை கருக்கவர் மையத்தினை இரு அணுக்களின் வழியாகவும் தாக்கும் இயல்பினைப் பெற்றுள்ளன. இத்தகைய கருக்கவர் பொருட்கள் இருமைத் தன்மை உடைய கருக்கவர் பொருட்கள் என அழைக்கப்படுகின்றன.
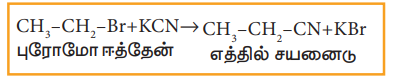
ii) ஆல்கஹால் கலந்த KCN உடன் வினை
ஹேலோ ஆல்கேன்கள் ஆல்கஹால் கலந்த KCN கரைசலுடன் வினைபுரிந்து ஆல்கைல் சயனைடுகளைத் தருகின்றன.
எடுத்துக்காட்டு
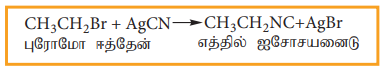
iii) ஆல்கஹால் கலந்த AgCN உடன் வினை
ஹேலோ ஆல்கேன்கள் ஆல்கஹால் கலந்த AgCN உடன் வினைபுரிந்து ஆல்கைல் ஐசோ சயனைடைத் தருகிறது.
எடுத்துக்காட்டு
iv) சோடியம் அல்லது பொட்டாசியம் நைட்ரைட்டுடன் வினை
ஹேலோ ஆல்கேன்கள் ஆல்கஹால் கலந்த NaNO2 அல்லது KNO2 உடன் வினைபுரிந்து ஆல்கைல் நைட்ரைட்டுகளைத் தருகின்றன.
எடுத்துக்காட்டு
CH3CH2Br + KNO2 → CH3CH2 - O-N = O + KBr
புரோமோ ஈத்தேன் எத்தில் நைட்ரைட்
v) சில்வர் நைட்ரைட்டுடன் வினை
ஹேலோ ஆல்கேன்கள் ஆல்கஹால் கலந்த AgNO2 உடன் வினைபுரிந்து நைட்ரோ ஆல்கேன்களைத் தருகின்றன.
எடுத்துக்காட்டு
CH3CH2Br + AgNO2 →CH3CH2NO2 + AgBr
புரோமோ ஈத்தேன் நைட்ரோ ஈத்தேன்
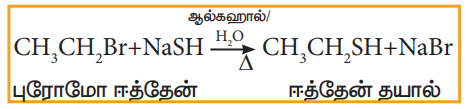
vi) சோடியம் அல்லது பொட்டாசியம் ஹைட்ரஜன் சல்பைடுடன் வினை
ஹேலோ ஆல்கேன்கள் சோடியம் (அல்லது) பொட்டாசியம் ஹைட்ரஜன் சல்பைடுடன் வினைப்பட்டு தயோ ஆல்கஹால்களைத் தருகின்றன.
எடுத்துக்காட்டு
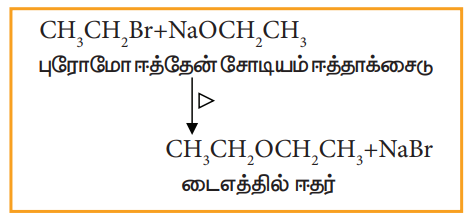
vii) வில்லியம்சனின் ஈதர் தொகுப்பு
ஹேலோ ஆல்கேன்களை சோடியம் ஈத்தாக்ஸைடுடன் கொதிக்க வைக்கும்போது அதற்கு இணையான ஈதர்கள் உருவாகின்றன. இம்முறையினை சீர்மையற்ற ஈதர் தயாரிக்கவும் பயன்படுத்தலாம்.
எடுத்துக்காட்டு
கருக்கவர்பொருள் பதிலீட்டு வினைகளின் வினைவழி முறை
கருக்கவர் பொருள் பதிலீட்டு வினையின் வினைவழி முறையினை பின்வருமாறு வகைப்படுத்தலாம்.
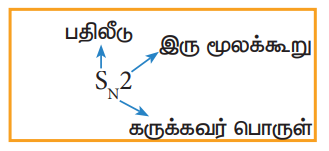
a) இரு மூலக்கூறு கருக்கவர் பொருள் பதிலீட்டு வினை (SN2)
b) ஒரு மூலக்கூறு கருக்கவர் பொருள் பதிலீட்டு வினை (SN1)
SN2 வினை வழிமுறை
SN2 வினையின் வினைவேகமானது ஆல்கைல்ஹேலைடு மற்றும் கருக்கவர் பொருள் ஆகிய இரண்டின் செறிவினையும் பொருத்து அமைகின்றது.
வினையின் வேகம்
= K2 [ஆல்கைல் ஹேலைடு] [கருக்கவர் பொருள்]
இவ்வினை இரண்டாம்வகை வினைவேகவியலை பின்பற்றுகிறது.
மேலும் ஒரே படியில் நிகழ்கிறது. இவ்வினையில் இரு வினைபடு மூலக்கூறுகளும் ஒன்றோடொன்று பகுதி பிணைப்பால் பிணைக்கப்பட்டு இடைநிலை உருவாகிறது. கருக்கவர் பொருள் தாக்குதலானது ஹேலஜன் அமைந்துள்ள இடத்திற்கு நேர் எதிர் புறத்தில் நிகழ்கிறது. இப்பதிலீட்டினால் பெறப்படும் அமைப்பானது வேகமாக காற்று வீசும் போது ஒரு குடை தலை கீழாக திருப்பிக் கொள்வதைப் போன்ற அமைப்பினைப் பெற்றிருக்கும். எனவே கார்பனின் புறவெளி அமைப்பு தலைகீழ் மாற்றமடைகிறது. பால் வால்டன், SN2 வினைகளில் இந்த தலைகீழ் மாற்றமடைந்த அமைப்பை கண்டறிந்தார். இது வால்டன் தலைகீழ் மாற்றம் என அழைக்கப்படுகிறது.
ஒளி சுழற்றும் தன்மையுடைய ஹேலோ ஆல்கேன் SN2 வினையில் ஈடுபடும்போது அந்த ஹேலோ ஆல்கேனிலுள்ள சீர்மையற்ற கார்பனின் புறவெளி அமைப்பு தலைகீழ் மாற்றமடைகிறது. பின்வரும் எடுத்துக்காட்டைக் கருதுவோம்.
ஒளி சுழற்றும் தன்மையுடைய 2-புரோமோ ஆக்டேன், சோடியம் ஹைட்ராக்ஸைடுடன் புரியும் வினை.
(-)-2-புரோமோ ஆக்டேனை சோடியம் ஹைட்ராக்ஸைடுடன் வெப்பப்படுத்தும் போது (+)-2-ஆக்டனாலைத் தருகிறது. இதில் -OH தொகுதியானது புரோமின் இடம் பெற்றிருந்த இடத்திற்கு நேர் எதிரே அமைந்துள்ளது.
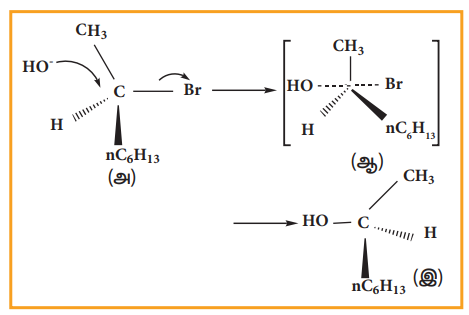
(அ) (-)-2-புரோமோ ஆக்டேன்
(ஆ) இடைநிலை
(ஐ) (+) -2-ஆக்டனால் (விளைபொருள்)
SN1 வினை வழிமுறை
SN1 என்பது ஒரு மூலக்கூறு கருக்கவர் பொருள் பதிலீட்டு வினையினைக் குறிப்பிடுகின்றது
'S' என்பது பதிலீட்டினைக் குறிப்பிடுகின்றது
‘N’ என்பது கருக்கவர் பொருளைக் குறிப்பிடுகின்றது
‘1’ என்பது ஒரு மூலக்கூறு வினையைக் குறிப்பிடுகின்றது (வினை வேகத்தை தீர்மானிக்கும் படியில் ஒரு மூலக்கூறு மட்டும் இடம் பெறுகிறது)
பின்வரும் SNl வினையின் வினைவேகமானது ஆல்கைல் ஹேலைடின் செறிவினை மட்டுமே பொறுத்து அமைகிறது. மேலும் கருக்கவர் பொருளான (OH-ன்) செறிவினைப் பொறுத்து அமைவதில்லை.
எனவே வினையின் வேகம்
= K [ஆல்கைல் ஹேலைடு]
R-Cl + OH- → R - OH + Cl-
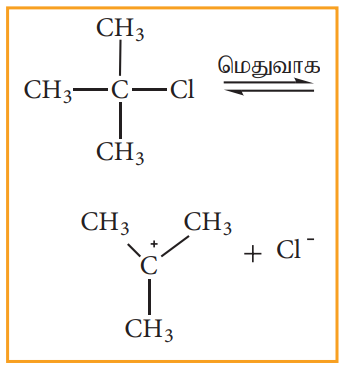
SNl வினையானது முதல்வகை வினைவேகவியலைப் பின்பற்றுகிறது. மேலும் இரு படிகளில் நிகழ்கிறது. மூவிணைய பியூட்டைல் புரோமைடானது நீர்த்த KOH உடன் பரியும் வினையினை எடுத்துக்காட்டாகக் கொண்டு SNl வினையின் வினைவழி முறையினை புரிந்து கொள்வோம்.
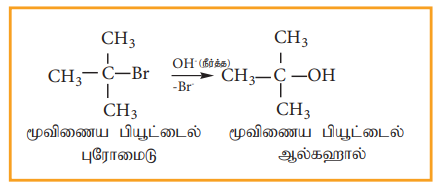
இவ்வினை இரு படிகளில் பின்வருமாறு நிகழ்கிறது.
படி1- கார்பன் நேர் அயனி உருவாதல்
முனைவுள்ள C-Br பிணைப்பானது பிளக்கப்பட்டு கார்பன் நேர் அயனி மற்றும் புரோமைடு அயனி உருவாகின்றன. இந்தப்படியானது மெதுவாக நடைபெறுகிறது. எனவே இதுவே வினைவேகத்தினை தீர்மானிக்கும் படியாகும்
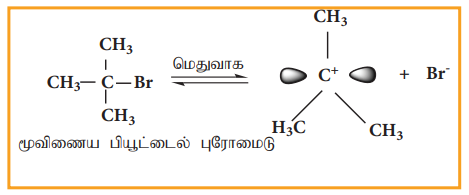
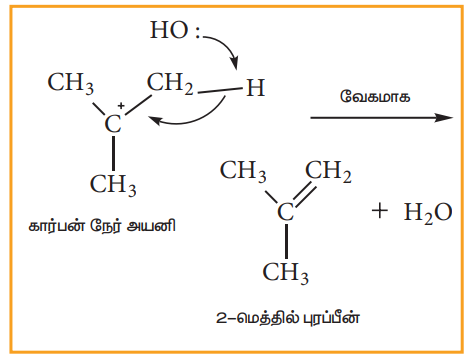
கார்பன் நேர் அயனியானது இரு காலியான 2p ஆர்பிட்டால்களின் சமான மடல்களைப் பெற்றுள்ளது எனவே இது இரு புறங்களின் வழியேயும் சமமாக விரைந்து வினைபுரிகின்றது.
படி-2
கருக்கவர் பொருளானது, கார்பன் நேர் அயனியுடன் வினைபுரிகிறது. இந்தப் படியானது விரைவாக நிகழ்வதாகும். எனவே வினையின் வேகத்தினை பாதிப்பதில்லை.
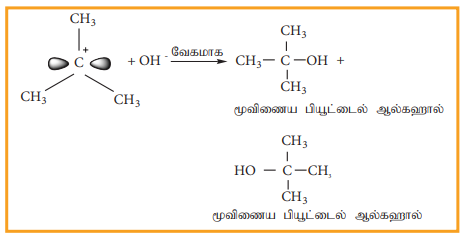
மேற்கண்டுள்ளவாறு, OH- அயனியானது கார்பன் நேர் அயனியை இரு புறங்களின் வழியே தாக்குகின்றது. மேற்கண்டுள்ள எடுத்துக்காட்டில் மூவிணைய பியூட்டைல் புரோமைடானது ஒளிசுழற்றும் தன்மை அற்றது. எனவே உருவாகும் விளைபொருளானது ஒளிசுழற்றும் தன்மை அற்றதாக உள்ளது. வினையில் ஈடுபடும் ஆல்கைல் ஹாலைடு ஒளிசுழற்றும் தன்மை பெற்றிருப்பின் உருவாகும் விளைபொருள் ஒளிசுழற்றும் தன்மையற்ற சுழிமாய்க்கலவையாகும். கருக்கவர் பொருளான OH- அயனியானது கார்பன் நேர் அயனியை இரு புறங்களிலும் தாக்குவதால் சம கோணங்களில் வலஞ்சுழி மற்றும் இடஞ்சுழி திசைகளில் தள முனைவுற்ற ஒளியை சுழற்றும் தன்மையுடைய மாற்றியங்கள் சம அளவில் உருவாகின்றன. இதன் விளைவாக ஒளிசுழற்றும் தன்மையற்ற சுழிமாய்க் கலவை உருவாகின்றது.
எடுத்துக்காட்டு
ஒளி சுழற்றும் தன்மையுடைய 2-புரோமோ பியூட்டேனை நீராற்பகுக்கும்போது (+) பியூட்டேன்-2-ஆல் மற்றும் (-) பியூட்டேன்-2-ஆல் கலந்த சுழிமாய்க் கலவை உருவாகிறது.
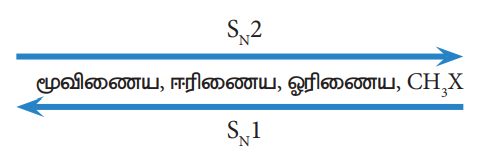
SN1 மற்றும் SN2 வினைகளில் ஹேலோ ஆல்கேன்களின் வினைத் திறன் வரிசை பின்வருமாறு அமைகிறது.
தன் மதிப்பிடு
4) நியோபென்டைல் புரோமைடின் பதிலீட்டு வினை மெதுவாக நடைபெறுகிறது-நியாயப்படுத்துக
தீர்வு:
நியோ பென்டைல் புரோமைடின் பதிலீட்டு வினை மெதுவாக நடைபெறுவதன் காரணங்கள்:
● C - Br பிணைப்பு பிளவுற்று நிலைப்புத்தன்மை குறைவான ஓரிணைய கார்பன் நேர் அயனி உருவாகிறது. எனவே. SN1 வினை மெதுவாக நிகழ்கிறது.
● SN2 வினையில் கருக்கவர் பொருள் தாக்குதலானது ஹோலஜன் அமைந்துள்ள இடத்திற்குநேர் எதிர் புறத்தில் நிகழ்வது கடினம். ஏனெனில் ஆல்கைல் தொகுதிகளின் கொள்ளிட தடைகாரணமாக SN2 வினை மெதுவாக நிகழ்கிறது.
2) நீக்க வினைகள்
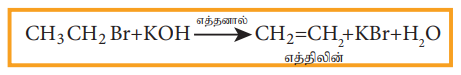
β-ஹைட்ரஜனைக் கொண்டுள்ள ஹேலோ ஆல்கேனை எத்தனால் கலந்த பொட்டாசியம் ஹைட்ராக்ஸைடுடன் வினைப்படுத்தும் போது ஒரு ஆல்கீன் உருவாகிறது. இவ்வினையில் α கார்பனுடன் இணைக்கப்பட்டுள்ள ஹேலஜனும், β-கார்பனுடன் இணைக்கப்பட்டிருக்கும் ஹைட்ரஜனும் நீக்கமடைவதால் α மற்றும் β கார்பன்களுக்கு இடையே ஓர் இரட்டைப் பிணைப்பு உருவாகிறது. இவ்வினை β-நீக்கவினை (ஹைட்ரோ ஹேலஜன் நீக்கவினை) என அழைக்கப்படுகிறது. சில ஹேலோ ஆல்கேன்கள் வெவ்வேறு விகிதங்களில் ஆல்கீன்களைத் தருகின்றன. செயிட்செவ் விதியின் அடிப்படையில் இதனை விளக்கலாம். இவ்விதியின்படி, ஹைட்ரோஹேலஜன் நீக்க வினைகளில், இரட்டைப்பிணைப்பால் பிணைக்கப்பட்டுள்ள கார்பனுடன் பிணைக்கப்பட்டிருக்கும் ஆல்கைல் தொகுதிகளின் எண்ணிக்கை அதிகமாக உள்ள ஆல்கீன் உருவாவதற்கான வாய்ப்புகள் அதிகம் (அதிக பதிலிகள் உள்ள இரட்டைப்பிணைப்பு உருவாகிறது)
எடுத்துக்காட்டு
நீக்க வினையானது E1 மற்றும் E2 ஆகிய வெவ்வேறு வினைவழிமுறைகளைப் பின்பற்றி நிகழ்கிறது.
எடுத்துக்காட்டு
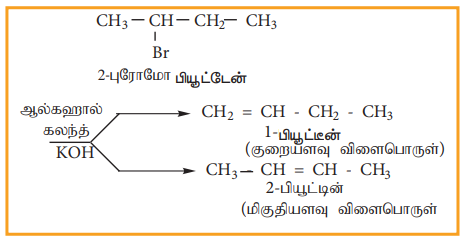
நீக்க வினையானது E1 மற்றும் E2 ஆகிய வெவ்வேறு வினைவழி முறைகளைப் பின்பற்றி நிகழ்கிறது.
E2 வினைவழி முறை

E2 வினையின் வினைவேகமானது ஆல்கைல் ஹேலைடு மற்றும் காரம் ஆகிய இரண்டின் செறிவுகளைப் பொறுத்து அமையும்.
வினைவேகம் = k [ஆல்கைல் ஹேலைடு] [காரம்]
எனவே, இவ்வினை இரண்டாம் வகை வினையாகும். பொதுவாக ஓரிணைய ஆல்கைல் ஹேலைடுகள், ஆல்கஹால் கலந்த KOH முன்னிலையில் இவ் வினைவழிமுறையைப் பின்பற்றி வினைபுரிகின்றன. இவ்வினை ஒரே படியில் நிகழும் வினையாகும். இவ்வினையில் β-கார்பனில் இருந்து புரோட்டான் கவரப்படுகின்றது. மேலும் அதே நேரத்தில் α- கார்பனில் இருந்து ஹேலைடு அயனியானது நீக்கப்படுகிறது.
வினைவழிமுறை பின்வருமாறு.
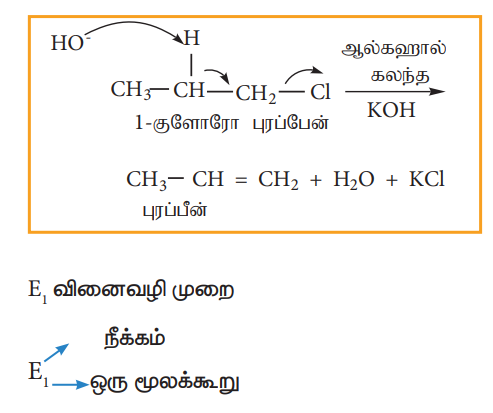
பொதுவாக, மூவிணைய ஆல்கைல் ஹேலைடுகள் இவ்வினை வழிமுறையினைப் பின்பற்றி ஆல்கஹால் கலந்த KOH முன்னிலையில் நீக்க வினையில் ஈடுபடுகின்றன. இவ்வினை முதல்வகை வினைவேகவியலைப் பின்பற்றுகிறது. பின்வரும் நீக்க வினையினைக் கருதுவோம்.
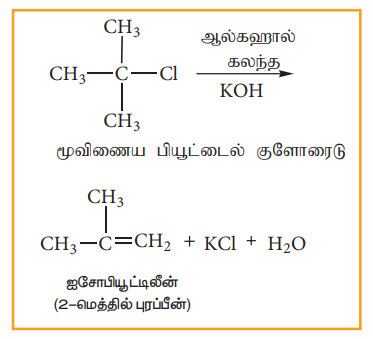
படி 1: சீர்மையற்ற பிளப்பின் காரணமாக கார்பன் நேர் அயனி உருவாகிறது.
படி 1: β - கார்பனிலிருந்து புரோட்டான் நீக்கமடைவதால் ஆல்கீன் உருவாகிறது.
3) உலோகத்துடன் வினை
ஹேலோ ஆல்கேன்கள் உலோகங்களுடன் வினைபுரிந்து கார்பன்- உலோகம் பிணைப்பை உருவாக்கும். சேர்மங்கள் கரிம உலோகச் சேர்மங்கள் என்றழைக்கப்படுகின்றன.
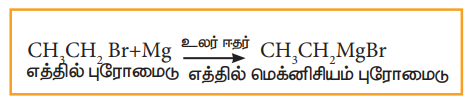
அ) கிரிக்னார்டு வினை
ஹேலோ ஆல்கேனின் ஈதர் கரைசலை மெக்னீசியத்துடன் வினைப்படுத்தும் போது, கிரிக்னார்டு காரணி என்றழைக்கப்படும் ஆல்கைல் மெக்னீசியம் ஹேலைடு பெறப்படுகின்றது.
எடுத்துக்காட்டு
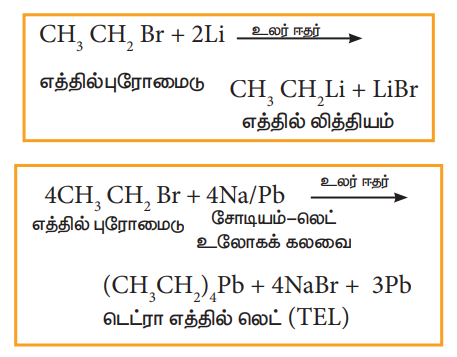
ஆ) சோடியம், காரீயம் போன்ற வினைதிறன்மிக்க உலோகங்களுடன் வினைப்படுத்துதல்.
ஹேலோ ஆல்கேன்கள் சோடியம், காரீயம் போன்ற உலோகங்களுடன் உலர் ஈதரின் முன்னிலையில் வினைபுரிந்து கரிம உலோகச் சேர்மங்களைத் தருகின்றன.
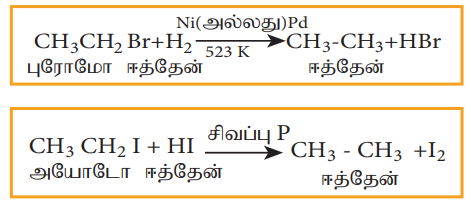
4) ஒடுக்க வினைகள்:
ஹேலோ ஆல்கேன்களை நிக்கல், பெல்லேடியம் போன்றவற்றின் முன்னிலையில் ஹைட்ரஜனுடன் அல்லது சிவப்பு பாஸ்பரஸ் முன்னிலையில் ஹைட்ரோ அயோடிக் அமிலத்துடன் வினைபுரியச் செய்யும் போது ஆல்கேன்களாக ஒடுக்கப்படுகிறது.
6. ஹேலோ ஆல்கேன்களின் பயன்கள்
குளோரோஃபார்ம்:
1. மருந்தாக்க தொழிற்சாலைகளில் கரைப்பானாகப் பயன்படுகிறது.
2. பூச்சிக்கொல்லிகள் தயாரிப்பில் பயன்படுகிறது.
3. உணர்வு நீக்கும் மருந்துப் பொருளாக பயன்படுகிறது.
4. உள்ளுறுப்பு மாதிரிகளை பாதுகாக்கும் பொருளாகவும் பயன்படுகிறது.
அயடோஃபார்ம்:
காயங்களுக்கு புரை தடுப்பானாகப் பயன்படுகிறது.
கார்பன் டெட்ரா குளோரைடு:
1. உலர் சலவை காரணியாக பயன்படுகிறது.
2. எண்ணெய், கொழுப்பு மற்றும் மெழுகு ஆகியவற்றிற்கு கரைப்பானாகப் பயன்படுகிறது.
3. ஆவிநிலையில் உள்ள CCl4 ஆனது தீப்பற்றி எரியாத தன்மையுடையது. எண்ணெய் அல்லது பெட்ரோல் தீயை அணைக்க தீத்தடுப்பானாகப் பயன்படுகிறது