ஹேலோ அரீன்களுக்குப் பெயரிடுதல், தயாரித்தல் முறைகள், இயற் மற்றும் வேதிப் பண்புகள், - ஹேலோ அரீன்கள் | 11th Chemistry : UNIT 14 : Haloalkanes and Haloarenes
11 வது வேதியியல் : அலகு 14 : ஹேலோ ஆல்கேன்கள் மற்றும் ஹேலோ அரீன்கள்
ஹேலோ அரீன்கள்
ஹேலோ அரீன்கள்
ஹேலஜன் அணுவானது பென்சீன் வளையத்துடன் நேரடியாக இணைக்கப்பட்டுள்ள கரிமச் சேர்மங்கள் ஹேலோ அரீன்கள் எனப்படுகின்றன.

1. ஹேலோ அரீன்களுக்குப் பெயரிடுதல்
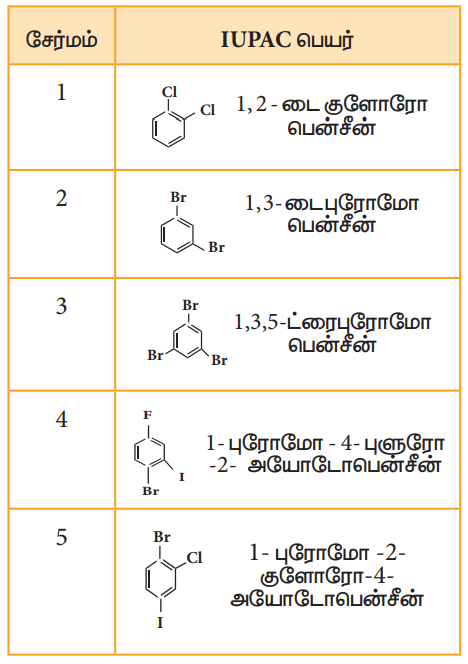
IUPAC பெயரிடும் முறையில், அரோமேட்டிக் ஹைட்ரோ கார்பனின் பெயருக்கு முன்னால் ஹேலோ எனும் முன்னொட்டு சேர்த்து பெயரெழுதப்படுகிறது. இரு பதிலீடு செய்யப்பட்ட அரீன்களுக்குப் பெயரிடும் போது பதிலிகளின் ஆர்த்தோ, மெட்டா மற்றும் பாரா இட அமைவுகள் முறையே 1, 2; 1, 3 மற்றும் 1, 4 என குறிக்கப்படுகின்றன.
பல ஹேலஜன்களைக் கொண்டுள்ள ஹேலோ அரீன்களுக்கு எண் இடும்போது பதிலிகளுக்கு குறைவான எண் அமையும் வகையில் எண்ணிட வேண்டும். மேலும் ஹேலஜன்கள் ஆங்கில அகர வரிசைப்படி எழுதப்பெற வேண்டும்.
பின்வரும் எடுத்துக்காட்டுகள் மூலம் பெயரிடுதலை நன்கு புரிந்து கொள்ள முடியும்.
2. ஹேலோ அரீன்களில் காணப்படும் C-X பிணைப்பின் தன்மை
ஹேலோ அரீன்களின் கார்பன் அணுவானது sp2 இனக்கலப்பு நிலையில் காணப்படுகிறது. இந்த sp2 இனக்கலப்படைந்த ஆர்பிட்டால்கள் குட்டையானவை. மேலும் பிணைப்பு எலக்ட்ரான் இரட்டையினை இறுக்கமாக பிணைத்து வைத்துள்ளன.
ஹேலஜன் அணுவானது தனித்த இரட்டை எலக்ட்ரான்களைக் கொண்டுள்ள p-ஆர்பிட்டாலைப் பெற்றுள்ளது. இது பென்சீன் வளையத்தில் உள்ள π-ஆர்பிட்டால்களுடன் இடையீடு செய்வதால் π-ஆர்பிட்டால்களின் நீட்டிக்கப்பட்ட உடனிசைவு நிகழ்கிறது. இந்த எலக்ட்ரான்களின் உள்ளடங்காத் தன்மையானது C-X பிணைப்பிற்கு இரட்டைப் பிணைப்பு பண்பினைத் தருகிறது. ஹேலோ பென்சீனின் உடனிசைவு அமைப்புகள் பின்வருமாறு.

C-X பிணைப்பின் இந்த இரட்டை பிணைப்பு தன்மையினால், பிணைப்பு நீளம் குறைவாகவும் ஹேலோ ஆல்கேன்களைக் காட்டிலும் அதிக வலிமையுடையதாகவும் உள்ளது.
எடுத்துக்காட்டு

3. தயாரித்தல் முறைகள்
1) நேரடி ஹேலஜனேற்றம்
FeCl3 போன்ற லூயி அமில வினைவேக மாற்றியின் முன்னிலையில் பென்சீன் நேரடி குளோரினேற்றம் அடைந்து குளோரோ பென்சீனைத் தருகிறது.

2) பென்சீன் டையசோனியம் குளோரைடிலிருந்து பெறுதல்
சாண்ட்மேயர் வினை அல்லது காட்டர்மான் வினையினைப் பயன்படுத்தி பென்சீன் டையசோனியம் குளோரைடிலிருந்து குளோரோ பென்சீனை தயாரிக்கலாம்.
(i) சாண்ட்மேயர் வினை
பென்சீன்டையசோனியம் குளோரைடின் நீரிய கரைசலை Cu2Cl2/HCl உடன் வெப்பப்படுத்தும் போது குளோரோ பென்சீன் உருவாகிறது.

3) அயடோபென்சீன் தயாரித்தல்
பென்சீன் டையசோனியம் குளோரைடை நீர்த்த KI கரைசலுடன் மிதமாக வெப்பப்படுத்தும் போது அயோடோ பென்சீன் உருவாகிறது.

4) புளுரோ பென்சீன் தயாரித்தல்
பென்சீன் டையசோனியம் குளோரைடை புளூரோ போரிக் அமிலத்துடன் வினைபடுத்தும் போது புளுரோ பென்சீன் உருவாகிறது. இவ்வினையில் டையசோனியம் புளூரோ போரேட் உருவாகிறது. இதனை வெப்பப்படுத்தும் போது புளூரோ பென்சீன் உருவாகிறது. இவ்வினை பால்-ஷைமேன் வினை என்றழைக்கப்படுகிறது.

5) குளோரோ பென்சீனை வணிகரீதியில் தயாரித்தல் (ராஷ் செயல் முறை)
ஆவி நிலையிலுள்ள பென்சீன், காற்று மற்றும் HCl கலந்த கலவையை சூடாக்கப்பட்ட குப்ரிக் குளோரைடின் மீது செலுத்தி வணிக ரீதியில் குளோரோ பென்சீன் தயாரிக்கப்படுகிறது. இவ்வினை ராஷ் செயல்முறை எனப்படுகிறது.

4. இயற்பண்புகள்:
1. உருகு நிலை மற்றும் கொதிநிலை
திரவ நிலையில் உள்ள மோனோ ஹாலோ பென்சீனின் கொதிநிலையானது பின்வரும் வரிசையில் அமையும்.
அயோடோ > புரோமோ > குளோரோ
டைஹேலோ பென்சீனின் மாற்றியங்கள் ஏறத்தாழ சமமான கொதிநிலைகளைப் பெற்றுள்ளன. ஆர்த்தோ மற்றும் மெட்டா மாற்றியங்களைக் காட்டிலும், பாரா மாற்றியமானது அதிக உருகு நிலையைக் கொண்டுள்ளது. p-மாற்றியத்தின் அதிக உருகுநிலைக்குக் காரணம் அதன் சீர்மைத் தன்மையாகும். இதன் விளைவாக படிகத்தில் அதன் மூலக்கூறுகள் நெருங்கி பொதிந்துள்ளன. மேலும் மூலக்கூறுகளுக்கிடையேயான கவர்ச்சி விசை அதிகமாக உள்ளது. எனவே உருக்குவதற்கு அதிக ஆற்றல் தேவைப்படும்.
p-டைஹேலோ பென்சீன் > o-டைஹேலோ பென்சீன் > m-டை ஹேலோ பென்சீன்
2. கரைதிறன்
ஹேலோ அரீன்கன் நீரில் கரையாத் தன்மையைப் பெற்றிருக்கும். ஏனெனில் அவைகள் நீருடன் ஹைட்ரஜன் பிணைப்பினை ஏற்படுத்துவதில்லை. ஆனால் கரிமக் கரைப்பான்களில் கரைகின்றன.
3. அடர்த்தி
ஹேலோ அரீன்கள் நீரினைக் காட்டிலும் அதிக அடர்த்தி உடையவை. அவைகளின் அடர்த்தி வரிசை பின்வருமாறு
அயோடோ பென்சீன் > புரோமோ பென்சீன் > குளோரோ பென்சீன்
5. வேதிப் பண்புகள்
A. ஹேலஜன் அணு இடம்பெறும் வினைகள்
1. அரோமேட்டிக் கருக்கவர் பொருள் பதிலீட்டு வினைகள்:
ஹேலோ அரீன்கள் எளிதில் கருக்கவர் பொருள் பதிலீட்டு வினைக்கு உட்படுவதில்லை. ஏனெனில் அரைல் ஹேலைடுகளில் காணப்படும் C-X பிணைப்பு குட்டையானது. மேலும் வலிமையுடையது மற்றும் அரோமேட்டிக் வளையமானது அதிக எலக்ட்ரான் அடர்வு மையத்தினைக் கொண்டுள்ளது.
ஹேலோ அரீன்களில் உள்ள ஹேலஜனானது OH-, NH2-அல்லது CN- போன்ற கருக்கவர் காரணிகளால் அதிக வெப்பநிலை மற்றும் அழுத்தத்தில் பதிலீடு செய்யப்படுகின்றன.
எடுத்துக்காட்டு
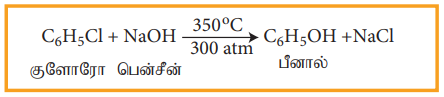
இவ்வினை டௌ முறை எனப்படுகிறது

2. உலோகங்களுடன் வினை
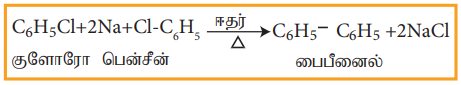
a) உர்ட்ஸ்-ஃபிட்டிக் வினை
ஹேலோ அரீன்கள், ஹேலோ ஆல்கேன்களுடன் ஈதரில் உள்ள சோடியக் கரைசலுடன் வினைபட்டு ஆல்கைல் பென்சீனைத் தருகிறது. இவ்வினை உர்ட்ஸ்- ஃபிட்டிக் வினை எனப்படும்.

b) ஃபிட்டிக் வினை
ஹேலோ அரீன்களை உலர் ஈதரில் உள்ள சோடியத்துடன் வினைப்படுத்தும் போது இரு அரைல் தொகுதிகள் இணைந்து பைஅரைல் சேர்மங்களைத் தருகின்றன. இவ்வினை ஃபிட்டிக் வினை எனப்படும்.
B) அரோமேட்டிக் வளையம் இடம்பெறும் வினைகள்
3. எலக்ட்ரான்கவர் பொருள் பதிலீட்டு வினைகள்
ஹேலோ அரீன்கள் எலக்ட்ரான் கவர் பொருள் பதிலீட்டு வினைக்கு உட்படுகின்றன. பென்சீனின் எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினையின் வினைவேகத்தைக் காட்டிலும் ஹேலோ பென்சீனின் வினைவேகம் குறைவானதாகும். ஹேலோஜனின் -I விளைவினால் அது ஒரு கிளர்வு நீக்கும் தொகுதியாகும். குளோரினின் தனித்த இரட்டை எலக்ட்ரான் பென்சீன் வளையத்துடன் உடனிசைவில் ஈடுபடுகிறது. இதன் விளைவாக ஆர்த்தோ மற்றும் பாரா இடங்களில் எலக்ட்ரான் அடர்வு அதிகரிக்கின்றது. எனவே, பென்சீன் வளையத்துடன் இணைக்கப்பட்டுள்ள ஹேலஜன், புதிதாக உள்வரும் எலக்ட்ரான் கவர் பொருளை ஆர்த்தோ அல்லது பாரா இடங்களில் சென்று பதிலீடு அடையுமாறு ஆற்றுப்படுத்துகிறது.

டொலுயீன்
4) ஒடுக்க வினை
ஹேலோ அரீன்களை, Ni-Al உலோகக் கலவையுடன், NaOH உடன் வினைப்படுத்தும் போது தொடர்புடைய அரீன்களைத் தருகின்றது.

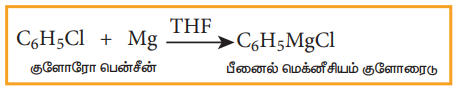
5) கிரிக்னார்டு வினைபொருள் உருவாதல்
ஹேலோ அரீன்கள் மெக்னீசியத்துடன், டெட்ரா ஹைட்ரோ பியூரானில் (THF) கிரிக்னார்டு வினைபொருளை தருகிறது.
6. குளோரோ பென்சீனின் பயன்கள்
1. DDT போன்ற பூச்சிக்கொல்லிகள், தயாரிப்பில் பயன்படுகிறது.
2. கரிம தொகுப்பு வினைகளில், அதிக கொதிநிலை கரைப்பானாகப் பயன்படுகிறது.
3. துணி பதப்படுத்துதலில், இழை தடிமனாக்கும் காரணியாகப் பயன்படுகிறது.
தன் மதிப்பீடு
6) ஹேலோ ஆல்கேன்கள் கருக்கவர் பொருள் பதிலீட்டு வினையில் ஈடுபடுகின்றன. அவ்வாறான நிலையில், ஹேலோ அரீன்கள் எலக்ட்ரான் கவர்பொருள் பதிலீட்டு வினைகளில் ஈடுபடுகின்றன - கருத்துரைக்க.
தீர்வு:
● ஹேலோ ஆல்கேன்களில் முனைவற்ற கார்பன் ஹோலஜன் பிணைப்பு (Cδ+ - Xδ-) இருப்பதால், கருக்கவர் காரணிகள் பகுதி நேர்மின் சுமை உடைய கார்பன் அணுவினால் கவரப்படுவதால் பதிலீட்டு வினைக்கு உட்படுகின்றன.
● ஹேலோ அரீன்களில், ஹேலோஜன் –I விளைவினால் பென்சீன் உடனிசைவில் ஈடுபடுகிறது. இதனால் எலக்ட்ரான் அடர்வு பென்சீன் வளையத்தில் அதிகரிக்கின்றதால் எலக்ட்ரான் கவர் பொருள் பதிலீட்டு வினைக்கு உட்படுகின்றன.