11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
கலோரி மீட்டர் முறையினை பயன்படுத்தி ΔU மற்றும் ΔH மதிப்புகளை அளவிடல்
கலோரி மீட்டர் முறையினை பயன்படுத்தி ΔU மற்றும் ΔH மதிப்புகளை அளவிடல்
இயற் அல்லது வேதி மாற்றங்களில், ஏற்படும் வெப்பமாற்ற அளவினை அளந்தறிய கலோரிமீட்டர் பயன்படுகிறது கலோரி மீட்டர் முறையில், ஒரு செயல்முறையில் ஏற்படும் வெப்பநிலை மாற்றமானது அளந்தறியப்படுகிறது. இது வெப்ப மாற்றத்திற்கு எதிர்விகித்திலிருக்கும். C = q / mΔT என்ற சமன்பாட்டை பயன்படுத்தி ஒரு செயல்முறையின் வெப்பமாற்ற அளவை நாம் கணக்கிட முடியும். கலோரி மீட்டர் அளவீடுகளை இருவேறு நிபந்தனைகளில் கீழ் அளந்தறியலாம்.
i) மாறாத கன அளவில் (qV)
ii) மாறாத அழுத்தத்தில் (qP)
(அ) ΔU அளவிடுதல்
மாறாத கனஅளவில், வேதி வினைகளில், வெளிப்படும் வெப்பம் பாம் கலோரிமீட்டர் கொண்டு அளவிடப்படுகிறது.
பாம் கலோரிமீட்டரின் உள்கலன் (பாம்) மற்றும் மூடி ஆகியன வலிமையான எஃகினால் செய்யப்பட்டுள்ளது. உலோக மூடியானது, திருகாணிகள் மூலம் இறுக்கமாக பொருத்தப்பட்டுள்ளது.
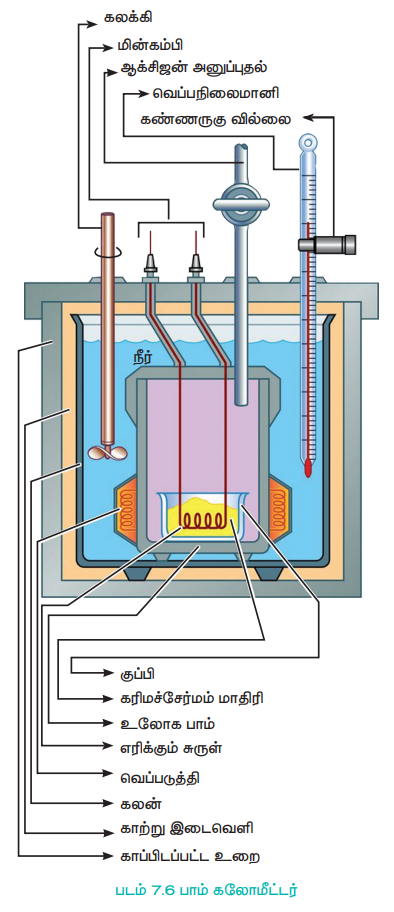
படம் 7.6 பாம் கலோமீட்டர்
எடையிடப்பட்ட (wகி) கரிம சேர்மமானது ஒரு பிளாட்டின தட்டில் எடுத்துக் கொள்ளப்படுகிறது. இத்தட்டானது மின்பாய்தல் மூலம் உடனடியாக எரிதலை தூண்டுவதற்காக மின்கம்பிகளுடன் பொருத்தப்பட்டுள்ளது உள் கலனில் அதிகளவு ஆக்ஸிஜன் செலுத்தி அழுத்தப்பட்டு இறுக்கமாக மூடப்படுகிறது. உள் கலன் (பாம்) ஆனது கலோரிமீட்டரினுள் உள்ள நீரில் அமிழ்த்தி வைக்கப்பட்டுள்ளது. வினையில் உருவாகும் வெப்பம் நீர் முழுவதும் சீராக பரவச் செய்ய கலோரிமீட்டரின் சுவர்களுக்கும், உள்கலனிற்கும் (பாம்) இடையே ஒரு கலக்கி உள்ளது. மின்வில்லை உருவாக்கி சேர்மம் எரிக்கப்படுகிறது.
கலோரி மீட்டரின் உள்கலனில் (பாம்), எடையிடப்பட்ட, எரியக்கூடிய கரிம சேர்மம், ஆக்ஸிஜன் சேர்த்து எரிக்கப்படுகிறது. சேர்மம் எரிக்கப்படும் போது உருவாகும் வெப்பம், கலோரி மீட்டர் மற்றும் அதைச் சூழ்ந்துள்ள நீரினால் உறிஞ்சப்படுகிறது. வெப்பநிலை மாற்றத்தை அளவிட பெக்மென் வெப்பநிலைமானி பொருத்தப்பட்டுள்ளது. பாம் கலோரி மீட்டர் மூடப்பட்டுள்ளதால், அதன் கனஅளவில் மாற்றம் ஏற்படுவதில்லை. எனவே வெப்ப அளவீடுகளானது மாறாத கனஅளவில் எரிதல் வெப்பத்திற்குச் (ΔUC0) சமம்.
இவ்வினையில் உருவான வெப்பத்தின் அளவானது (ΔUC0), கலோரி மீட்டர் மற்றும் நிரால் உறிஞ்சப்பட்ட வைப்ப மதிப்புகளின் கூடுதலுக்குச்சமம்.
கலோரி மீட்டரால் உறிஞ்சப்பட்ட வெப்பம்
q1 = k.ΔT
இங்கு k என்பது கலோரி மீட்டர் மாறிலி எனப்படுகிறது. மேலும் k = mC CC
mC = கலோரி மீட்டரின் நிறை
CC = கலோரி மீட்டரின் வெப்ப ஏற்புதிறன்
நீரால் உறிஞ்சப்பட்ட வெப்பம் q2 = mW CW ΔT
இங்கு mW என்பது நீரின் மோலார் நிறை,
CW நீரின் மோலார் வெப்ப ஏற்புத்திறன் (75.29 J K-1 mol-1)
எனவே ΔUc = q1 + q2
= k.ΔT + mw CW ΔT
= (k + mW CW) ΔT
ஒரு தெரிந்த அளவுடைய திட்ட பொருளை (பென்சாயிக் அமிலம்) எரிப்பதன் மூலம், கலோரி மீட்டர் மாறிலியின் (k) மதிப்பினை தீர்மானிக்க முடியும். பென்சாயிக் அமிலத்தின் எரிதல் வினை வெப்பம் - 3227 kJ mol-1 என்ற தெரிந்த ஒரு மதிப்பாகும்.
மாறா அழுத்தத்தில் என்தால்பி மாற்றத்தை சமன்பாடு (7.17)ஐ பயன்படுத்தி கணக்கிடலாம்.
ΔHC0(அழுத்தம்) = ΔUC0(கனஅளவு) + ΔngRT
பாம் கலோரி மீட்டரின் பயன்கள்:
1. எரிதல் வினைகளில் வெளிப்படும் வெப்பத்தை அளவிட பாம்கலோரி மீட்டர் பயன்படுகிறது.
2. உணவுப் பொருட்களின் கலோரி மதிப்பினை நிர்ணயித்திட இது பயன்படுகிறது.
3. வளர்சிதை மாற்ற ஆய்வுகள், உணவு பதப்படுத்துதல், வெடி பொருட்களை சோதித்தறிதல் போன்ற பல்வேறு தொழிற்துறைகளில் பாம்கலோரி மீட்டர் பயன்படுகிறது.
(ஆ) ΔH அளவிடுதல்
மாறாத அழுத்தத்தில் நடைபெறும் (பொதுவாக வளிமண்டல அழுத்தத்தில்) வினைகளில் நிகழும் வெப்ப மாற்றங்களை காஃபி கப் கலோரி மீட்டர் கொண்டு அளவிடலாம். காஃபி கப் கலோரி மீட்டரின் அமைப்பை குறித்துக் காட்டும் படமானது, படம் (7.7) ல் கொடுக்கப்பட்டுள்ளது. இந்த கலோரி மீட்டரில் உலோக கலனிற்கு (பாம்) பதிலாக ஸ்டைரோபோஃம் கப் பயன்படுத்தப்படுகிறது. இது சிறந்த வெப்பம் கடத்தாப் பொருள், வினையில் உருவாகும் வெப்பத்தை சூழலுக்கு கடத்த இப்பொருள் அனுமதிப்பதில்லை. எனவே இங்கு உருவான மொத்த வெப்பமும், கப்பில் உள்ள நீரால் மட்டுமே உறிஞ்சப்படுகிறது. நீரின் வெப்பநிலையில் ஏற்படும் மாற்றமானது அளந்தறியப்படுகிறது, மேலும் இதனைப் பயன்படுத்தி உறிஞ்சப்பட்ட (அ) வெளியிடப்பட்ட வெப்பத்தின் அளவை, பின்வரும் சமன்பாட்டினை பயன்படுத்தி கணக்கிடலாம்.
q = mw Cw ΔT
இங்கு mW என்பது நீரின் மோலார் நிறை,
CW நீரின் மோலார் வெப்ப ஏற்புத்திறனின் மதிப்பு 75.29 J K-1 mol-1
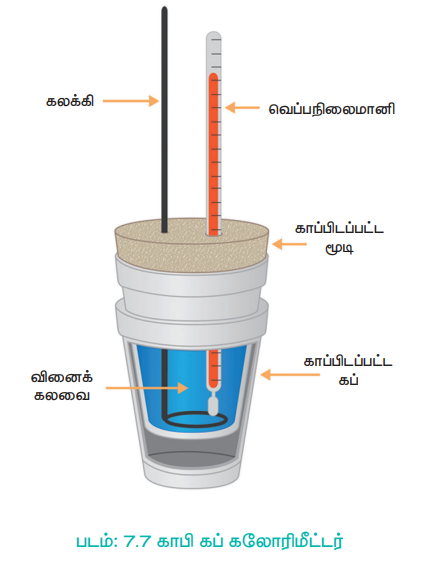
படம்: 7.7 காபி கப் கலோரிமீட்டர்
வினையின் போது குறிப்பிடத்தக்க அளவு கனஅளவில் மாற்றம் ஏற்படாத வினைகளுக்கு இம்முறையினைப் பயன்படுத்த முடியும்.
கணக்கு 7.4
300 K வெப்ப நிலை மற்றும் மாறாத அழுத்தத்தில் எத்திலீன் வாயுவின் எரிதல் என்தால்பி மதிப்பை கணக்கிடுக. மாறாத கனஅளவில் எத்திலீன் வாயுவின் எரிதல் என்தால்பி (ΔU) மதிப்பு -1406 kJ.
தீர்வு:
எத்திலீன் எரிதல் வினையை பின்வருமாறு எழுதலாம்.
C2H4 (g) + 3O2 (g) → 2CO2 (g) + 2H2O (l)
ΔU = -1406 kJ
Δn = np(g) - nr(g)
Δn = 2 – 4 = -2
ΔH = ΔU + RT Δng
ΔΗ = -1406 + [8.314 × 10-3 × 300 × (-2)]
ΔΗ = -1410.9 KJ
தன்மதிப்பீடு
3) மாறாத கனஅளவில் பென்சீனின் எரிதல் வினைக்கான தரவுகள் கொடுக்கப்பட்டுள்ளன. மாறாத அழுத்தத்தில் வினையின் எரிதல் வெப்பத்தை கணக்கிடுக்.
C6H6 (l) + 7 (1/2) O2 (g) → 6 CO2 (g) + 3 H2O (l)
25°C ல் ΔU = - 3268.12 kJ
தீர்வு:
பென்சீன் எரிதல் வினை
C6H6(l) + 7½O2 (g) → 6CO2 (g) + 3H2 O (l)
நாம் அறிந்த படி,
∆H = ∆U + RT ∆ng
∆ng = (∑ np − ∑ nr)g
= 6 − 7 ½
∆ng = − 3/2
∆H = −3268.12 = 8.314 × 10–3 × 298 × (− 3/2)
∆H = −3268.12 − 3.716
∆H = 3271.83kJ
எரிதல் வெப்பத்தின் பயன்பாடுகள்:
(1) உருவாதல் வெப்பத்தை கணக்கிடுதல்:
கரிம சேர்மங்களின் எரிதல் வெப்பத்தை எளிதில் அளவிட முடியும் என்பதால், இதைப் பயன்படுத்தி மற்ற சேர்மங்களின் உருவாதல் வெப்பத்தை கணக்கிடமுடியும்.
எடுத்துக்காட்டாக மீத்தேனின் திட்ட உருவாதல் என்தால்பி (ΔHf0) மதிப்பை கணக்கிடுவோம். H2,C (கிராஃபைட்) மற்றும் CH4 ஆகியவற்றின் எரிதல் என்தால்பி மதிப்புகள் முறையே -285.8, -393.5 மற்றும் -890.4 kJ mol-1.
பின்வருமாறு சமன்பாடுகளை எழுதுவதன் மூலம் உருவாதல் என்தால்பியை விளக்க முடியும். திட்ட வெப்ப அழுத்த நிலைகளில், தூயநிலையிலுள்ள, தனித்த வாயுக்கள் மற்றும் தனிமங்களின் திட்ட உருவாதல் என்தால்பி மதிப்புகள் பூஜ்ஜியம் என எடுத்துக் கொள்ளப்படுகின்றன. மீத்தேன் அதன் தனிமங்களிலிருந்து உருவாவதற்கான வெப்ப வேதிச் சமன்பாடுகள்
C(கிராஃபைட்) + 2H2 (g) → CH4(g)
ΔHf0 = X kJ mol-1 ---------- (i)
கொடுக்கப்பட்ட சேர்மங்களின் எரிதல் வினைக்கான வெப்ப வேதிச் சமன்பாடுகள்
H2 (g) + 1/2 O2 (g) → H2O (l)
ΔH0 = - 285.8 kJ mol-1 ---------- (ii)
C(கிராஃபைட்) (s) + O2 (g) → CO2 (g)
ΔH° = - 393.5 kJ mol-1 ---------- (iii)
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l)
ΔH° = - 890.4 kJ mol-1 ---------- (iv)
தேவைப்படும் சமன்பாடு (i)ல் மீத்தேன், விளைபொருள் பக்கத்தில் இருப்பதால், சமன்பாடு (iv) ன் மறுதலையை (reverse) எழுத வேண்டும்.
CO2 (g) + 2 H2O (l) → CH4 (g) + 2O2
ΔH° = + 890.4 kJ mol-1 ---------- (v)
சமன்பாடு (i) ஐ பெற
(i) = [(ii) × 2] + (iii) + (v)
X = [(- 285.8) × 2] + [- 393.5] + [+ 890.4]
= - 74.7kJ
1 மோல் மீத்தேன் உருவாதலின்போது வெளிப்படும் வெப்பம் = - 74.7 kJ
மித்தேனின் உருவாதல் வெப்பம் = - 74.7 kJmol-1
(2) உணவுப் பொருட்கள் மற்றும் எரிபொருட்களின் கலோரி மதிப்புகளை கணக்கிடுதல்:
ஒரு கிராம் பொருளை முழுமையாக எரிக்கும்போது வெளிப்படும் வெப்பத்தின் அளவு (கலோரிகளில் அல்லது ஜூல்களில்) அச்சேர்மத்தின் கலோரி மதிப்பு என வரையறுக்கப்படுகிறது. இதன் SI அலகு JKg-1. எனினும் இது வழக்கமாக cal g-1 எனும் அலகில் குறிப்பிடப்படுகிறது.
கரைசல் வெப்பம் :
ஒரு பொருள் ஒரு கரைப்பானில் கரைக்கப்படும் போது பொதுவாக வெப்பமாற்றம் உணரப்படுகிறது. குறிப்பிட்ட வெப்பநிலையில், ஒருமோல் சேர்மத்தை, குறிப்பிட்ட அளவுள்ள கரைப்பானில் கரைக்கும் போது ஏற்படும் வெப்பமாற்றம் அச்சேர்மத்தின் கரைசல் வெப்பம் என வரையறுக்கப்படுகிறது.
நடுநிலையாக்கல் வெப்பம்:
நீர்த்தகரைசலில், ஒரு கிராம் சமான நிறை கொண்ட ஒருஅமிலமானது, ஒரு கிராம் சமான நிறை கொண்ட ஒருகாரத்தால் முற்றிலும் நடுநிலையாக்கப்படும் போது, ஏற்படும் என்தால்பி மாற்றம் நடுநிலையாக்கல் வெப்பம் என வரையறுக்கப்படுகிறது.
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l) ΔH = - 57.32 kJ
H+ (aq) + OH- (aq) → H2O (l) ΔH = - 57.32 kJ
எந்த ஒரு வலிமை மிகு அமிலம் மற்றும் வலிமை மிகு காரம் ஆகியவற்றின் நடுநிலையாக்கல் வெப்ப மதிப்பு ஏறக்குறைய - 57.32 kJ. அமிலம் அல்லது காரத்தின் தன்மையை பொறுத்து இம்மதிப்பு மாறுவதில்லை, பின்வரும் எடுத்துக்காட்டுகள் இதற்குச் சான்றாக அமைகின்றன.
HCl (aq) + KOH (aq) → KCl (aq) + H2O (l) ΔH = - 57.32 kJ
HNO3 (aq) + KOH (aq) → KNO3 (aq) + H2O (l) ΔH = - 57.32 kJ
H2SO4 (aq) + 2 KOH (aq) → K2SO4 (aq) + 2 H2O (l) ΔH = - 57.32 kJ × 2
அமில காரங்கள் பற்றிய அர்ஹீனியஸ் கொள்கை மூலம் இதற்கான காரணத்தினை விளக்கமுடியும். இக்கொள்கைப்படி "வலிமை மிகு அமிலங்கள், மற்றும் வலிமை மிகுகாரங்கள் அவற்றின் நீர்க்கரைசல்களில் முற்றிலும் அயனிகளாக பிரிகையுற்று முறையே H+ மற்றும் OH- அயனிகளைத் தருகின்றன. எனவே மேற்கூறிய அனைத்து வினைகளிலும் நிகழும் நடுநிலையாக்கல் வினையினை பின்வருமாறு குறிப்பிடலாம்
H+ (aq) + OH- (aq) → H2O (l) ΔH = - 57.32 kJ
மோலார் உருகுதல் வெப்பம்:
ஒரு மோல் திண்மப்பொருள், அதன் உருகுநிலையில் திரவநிலைக்கு மாற்றப் படும்போது, ஏற்படும் என்தால்பி மாற்றம், அதன் மோலார் உருகுதல் வெப்பம் என வரையறுக்கப்படுகிறது.
எடுத்துக்காட்டாக பனிக்கட்டியின் உருகுதல் வெப்பத்தை பின்வருமாறு குறிப்பிட முடியும்.
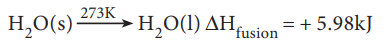
மோலார் ஆவியாதல் வெப்பம்:
ஒரு மோல் நீர்மம், அதன் கொதி நிலையில் ஆவிநிலைக்கு மாற்றப்படும்போது ஏற்படும் என்தால்பி மாற்றம், அதன் மோலார் ஆவியாதல் வெப்பம் என வரையறுக்கப்படுகிறது.
எடுத்துக்காட்டாக நீரின் ஆவியாதல் வெப்பத்தை பின்வருமாறு குறிப்பிட முடியும்
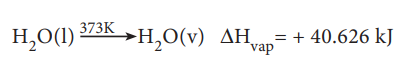
மோலார் பதங்கமாதல் வெப்பம்:
ஒரு திண்மம் அதன் திரவ நிலைக்கு மாறாமல், நேரடியாக வாயு நிலைக்கு மாறும் ஒரு செயல்முறை பதங்கமாதல் எனப்படுகிறது. ஒரு மோல் திண்மப்பொருளை, அதன் பதங்கமாதல் வெப்பநிலையில் நேரடியாக ஆவிநிலைக்கு மாற்றப்படும் போது ஏற்படும் என்தால்பி மாற்றம், அப்பொருளின் மோலார் பதங்கமாதல் வெப்பம் என வரையறுக்கப்படுகிறது. எடுத்துக்காட்டாக அயோடினின் பதங்கமாதல் வெப்பத்தை பின்வருமாறு குறிப்பிடமுடியும்.
I2 (s) → I2 (v) ΔHsub = + 62.42 kJ
மிகக் குறைந்த வெப்பநிலையில் வளிமண்டல அழுத்தத்தில் திண்ம கார்பன் – டை - ஆக்சைடானது வாயுநிலைக்கு மாறுவது, பதங்கமாதல் செயல்முறைக்கு மற்றுமொரு எடுத்துக்காட்டாகும்.
நிலைமாற்ற வெப்பம்:
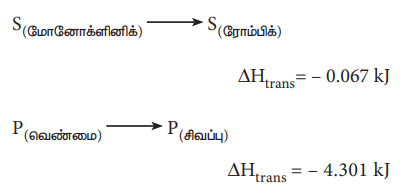
ஒரு மோல் தனிமம், அதன் ஒரு புறவேற்றுமை வடிவத்திலிருந்து, மற்றொரு புறவேற்றுமை வடிவத்திற்கு மாற்றமடையும்போது ஏற்படும் என்தால்பி மாற்றம், நிலைமாற்ற வெப்பம் என வரையறுக்கப்படுகிறது.
எடுத்துக்காட்டாக வைரம் அதன் புறவேற்றுமை வடிவமான கிராஃபைட்டாக மாற்றமடையும் வினையை குறிப்பிடலாம்.

இதைப் போலவே சல்பர் மற்றும் பாஸ்பரஸின் புற வேற்றுமை வடிவங்களுக்குக்கிடையே மாற்றத்தினை பின்வருமாறு குறிப்பிடலாம்..
S(மோனோக்ளினிக்) → S(ரோம்பிக்) ΔHtrans = - 0.067 kJ
P(வெண்மை) → P(சிவப்பு) ΔHtrans = - 4.301 kJ