11 வது வேதியியல் : அலகு 8 : இயற் மற்றும் வேதிச்சமநிலை
இயற் மற்றும் வேதிச் சமநிலை
இயற் மற்றும் வேதிச் சமநிலை:
சமநிலையில் வெவ்வேறு வகைகள் உள்ளன. உதாரணமாக, ஒரே எடையுடைய இருவர் ஒரு ஏற்ற இறக்க ஊசலாட்ட கருவியின் (see Saw) மையப் புள்ளியிலிருந்து சம தூரத்தில் அமர்ந்திருக்கும் நிலையில், கருவியானது ஊசலாடாமல் நிலையாக நேர்கோட்டில் அமைந்திருக்கும். மேலும் இந்நிலை சமநிலை எனப்படுகிறது.
சமநிலைத் தன்மையை அறிந்து கொள்ள கயிறு இழுபறி விளையாட்டை (tug of war) மேலும் ஒரு உதாரணமாக கருதலாம். இவ்விளையாட்டில் இரு அணிகளும் கயிற்றினைச் சம விசையுடன் இழுக்கக் கூடிய நிலை ஏற்படுமாயின், அந்நிலையில் கயிறானது எத்திசையிலும் நகராமல் நிலையாக இருக்கும். அத்தகைய நிலையானது சமநிலை எனப்படும்.

இத்தகைய மீளும் செயல்முறைகளில், ஒரு குறிப்பிட்ட நிலையில் எதிரெதிர் திசைகளில் நடைபெறும் வினைகளின் வினைவேகமானது சமமாகிறது. இந்நிலையில், நேரத்தைப் பொருத்து வினைபடுபொருட்களின் செறிவிலோ அல்லது வினைவிளை பொருட்களின் செறிவிலோ மாற்றம் ஏதும் ஏற்படுவதில்லை. ஆனால் இந்நிலை நிலையான தன்மையுடையது அல்ல, மாறாக இயங்குதன்மை உடையது. ஏனெனில் இந்நிலையிலும் கூட முன்னோக்கு வினை மற்றும் பின்னோக்கு வினை ஆகிய இரண்டும் ஒரே வேகத்தில் தொடர்ந்து நிகழ்ந்து கொண்டேயிருக்கும்.
1. இயற்சமநிலை
ஒரு பொருளானது வெவ்வேறு நிலைமைகளில் காணப்படும் ஒரு அமைப்பில் அப்பொருட்களின் அளவானது நேரத்தைப் பொருத்து மாறாது இருக்குமாயின் அவ்வமைப்பு இயற்சமநிலையில் உள்ளது எனப்படுகிறது. இதில் அமைப்பானது கண்டு உணரத்தக்க இயற் மாற்றங்களுக்கு உட்படுவதில்லை. இத்தகைய இயற் சமநிலையினை புரிந்து கொள்ள பின்வரும் நிலைமை மாற்றங்களை ஆய்ந்தறிவோம்.
திட-திரவச் சமநிலை (Solid liquid equilibrium)
ஒரு மூடிய கலனில் உள்ள பனிக்கட்டி 273K வெப்பநிலையில் உருகுதலைக் கருதுவோம். இச்செயல்முறையில், திட நிலைமையில் காணப்படும் நீரின் அளவும், திரவ நிலைமையில் காணப்படும் நீரின் அளவும் காலத்தைப் பொறுத்து மாறாதிருக்குமாறு ஒரு சமநிலையை அமைப்பு அடையும் இச்செயல் முறையில் எந்த ஒரு நேரத்திலும் திட நிலைமையில் இருந்து திரவநிலைக்குச் செல்லும் நீர் மூலக்கூறுகளின் மொத்த எண்ணிக்கையும், மீளவும் திட நிலைமைக்கு மாறும் நீர் மூலக்கூறுகளின் எண்ணிக்கையும் சமமாக இருக்கும்.
ஒரு வெப்பபரிமாற்றமில்லாக் குடுவையில் (273K வெப்பநிலை மற்றும் 1 atm அழுத்தத்தில்) சில பனிக்கட்டிகள் மற்றும் திரவநிலையில் உள்ள நீர் வைக்கப்பட்டிருக்குமாயின், அந்த அமைப்பில் உள்ள பனிக்கட்டி மற்றும் நீரின் நிறையில் எவ்வித மாற்றமும் ஏற்படுவதில்லை. சமநிலையில்,
பனிக்கட்டி உருகுதலின் வேகம் = நீர் உறைதலின் வேகம்.
H2O (s) ⇌ H2O (l)
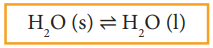
மேற்கண்டுள்ள சமநிலையானது ஒரு குறிப்பிட்ட வெப்ப அழுத்த நிலைகளில் மட்டுமே காணப்படும். ஒரு பொருளின் திட மற்றும் திரவ நிலைமைகளுக்கிடையே எவ்வெப்பநிலையில் சமநிலை காணப்படுகிறதோ அவ்வெப்பநிலை அப்பொருளின் உருகுநிலை அல்லது உறைநிலை என்றழைக்கப்படுகிறது.
திரவ-ஆவி சமநிலை Liquid - Vapour equilibrium
மேற்கண்டுள்ள சமநிலையைப் போன்றே ஒரு பொருளின் திரவ மற்றும் ஆவி நிலைமைகளுக்கிடையேயும் சமநிலை காணப்படுகிறது. எடுத்துக்காட்டாக, ஒரு மூடிய கலனில் 373 K வெப்பநிலை மற்றும் 1atm அழுத்தத்தில் திரவ நிலைமையில் உள்ள நீரானது அதன் ஆவி நிலைமையுடன் (நீராவியுடன்) சமநிலையில் காணப்படும்.
H2O (l) ⇌ H2O (g)
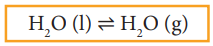
இங்கு,
ஆவியாதலின் வேகம் = சுருங்குதலின் வேகம்.
எந்த ஒரு வெப்பநிலையில் ஒரு பொருளின் திரவ மற்றும் ஆவி நிலைமைகளுக்கிடையே சமநிலை காணப்படுகிறதோ அவ்வெப்பநிலை அப்பொருளின் கொதிநிலைப் புள்ளி அல்லது சுருங்குதல் புள்ளி என அழைக்கப்படுகிறது.
திட - ஆவி சமநிலை (Solid - Vapour equilibrium)
திடப்பொருளானது ஆவி நிலைமைக்கு பதங்கமாகும் ஒரு மூடிய அமைப்பினைக் கருதுக. இச்செயல்முறையிலும் இவ்விரு நிலைமைகளுக்கிடையே சமநிலையை உருவாக்க இயலும். ஒரு மூடிய தெளிவாக கண்டுணர இயலும் கலனில் சிறிதளவு திட நிலையில் உள்ள அயோடின் எடுத்துக்கொள்ளப்படும்போது, சிறிது நேரத்திற்குப் பின்னர் அக்கலன் முழுவதும் அயோடினின் பதங்கமாதல் காரணமாக ஊதா நிற ஆவியால் நிறைந்திருக்கும். துவக்கத்தில் ஊதா நிறத்தின் செறிவு அதிகரிக்கும், சிறிது நேரத்திற்குப் பின்னர் அதன் நிறச்செறிவு குறையத் துவங்கும் இறுதியாக பின்வரும் சமநிலை உருவாவதால் நிறச் செறிவில் எவ்வித மாற்றமும் ஏற்படாத நிலை காணப்படும்.
அயோடின் (s) ⇌ அயோடின் (g)
I2 (s) ⇌ I2 (g)

மேலும் சில எடுத்துக்காட்டுகள்:
கற்பூரம் (s) ⇌ கற்பூரம் (g)
NH4Cl(s) ⇌ NH4 Cl (g)
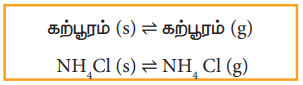
2. திடப்பொருள் அல்லது வாயுக்கள் திரவத்தில் கரைவதால் ஏற்படும் சமநிலை திரவத்தில் திடப்பொருள்
ஒரு குறிப்பிட்ட வெப்பநிலையில் சர்க்கரையை நீரில் சேர்க்கும் போது அது கரைந்து சர்க்கரைக் கரைசலை உருவாக்குகிறது. இக்கரைசலுடன் அதிகளவு சர்க்கரையை தொடர்ந்து நீங்கள் சேர்க்கும் போது, ஒரு குறிப்பிட்ட நிலையில் சேர்க்கப்பட்ட சர்க்கரை கரையாமல் திட நிலைமையிலேயே இருக்கும் ஒரு நிலையை நீங்கள் அடைவீர்கள். மேலும் இதன் விளைவாக உருவான கரைசல் தெவிட்டிய கரைசல் (saturated solution) என்றழைக்கப்படுகிறது. இச்செயல் முறையிலும் திடமற்றும் கரைசல் நிலைமைகளில் காணப்படும் கரைப்பொருள் மூலக்கூறுகளுக்களுக்கிடையே இயங்குச்சமநிலை உருவாகிறது
சர்க்கரை (திண்மம்) ⇌ சர்க்கரை (கரைசல்)
இச் செயல்முறையில்,
{கரைபொருளின் கரைதல் வேகம்} = {கரைபொருளின் படிகமாதல் வேகம்}
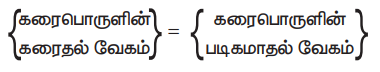
திரவத்தில் வாயு
கொடுக்கப்பட்ட அழுத்தத்தில், ஒரு வாயுவானது, ஒரு திரவத்தில் கரையும் போது, வாயு நிலைமையில் உள்ள வாயு மூலக்கூறுகளுக்கும், திரவத்தில் கரைந்துள்ள வாயு மூலக்கூறுகளுக்கும் இடையே சமநிலை காணப்படுகிறது.
எடுத்துக்காட்டு
கார்பன்-டை-ஆக்சைடு கரைந்துள்ள பானங்களில் பின்வரும் சமநிலை காணப்படுகிறது.
CO2(g) ⇌ CO2 (கரைசல்)
இத்தகைய வாயு - கரைசல் சமநிலையினை விளக்குவதற்கு ஹென்றியின் விதி பயன்படுத்தப்படுகிறது.