எடுத்துக்காட்டு, தயாரித்தல், இயற் மற்றும் வேதிப் பண்புகள், பயன்கள் - பல ஹாலஜன் சேர்மங்கள் | 11th Chemistry : UNIT 14 : Haloalkanes and Haloarenes
11 வது வேதியியல் : அலகு 14 : ஹேலோ ஆல்கேன்கள் மற்றும் ஹேலோ அரீன்கள்
பல ஹாலஜன் சேர்மங்கள்
பல ஹாலஜன் சேர்மங்கள்
ஒன்றிற்கும் மேற்பட்ட ஹாலஜன் அணுக்களை கொண்டுள்ள கார்பன் சேர்மங்கள் பல ஹாலஜன் சேர்மங்கள் என அழைக்கப்படுகின்றன. சில முக்கியமான பல ஹாலஜன் சேர்மங்கள் இப்பகுதியில் விவரிக்கப்பட்டுள்ளன. இவைகள் பின்வருமாறு வகைப்படுத்தப்படுகின்றன.
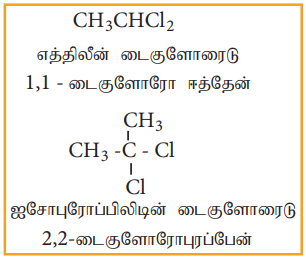
அ) ஜெம் டை ஹாலைடுகள்
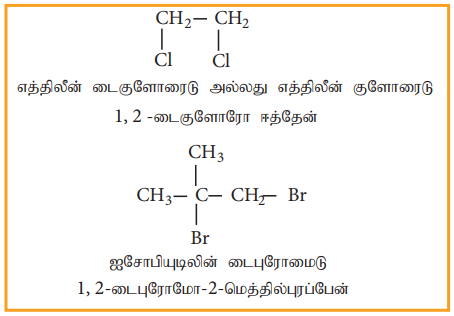
ஆ) விசினைல் டை ஹாலைடுகள்
எடுத்துக்காட்டு
1. தயாரித்தல்
அ) ஜெம் டை ஹாலைடுகள்
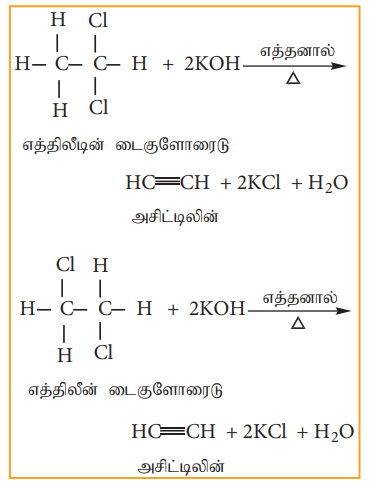
எத்திலிடின் டை குளோரைடு (1,1- டைகுளோரோ ஈத்தேன்) பின்வருமாறு தயாரிக்கப்படுகிறது.
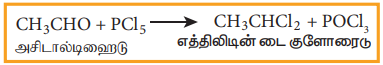
(i) அசிட்டால்டிஹைடை PCl5 உடன் வினைப்படுத்துதல்
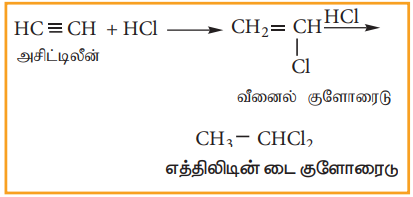
(ii) அசிட்டிலீனுடன் HCl சேர்க்கை வினை
ஆ) விசினைல் டை ஹாலைடுகள்
எத்திலீன் டை குளோரைடை (1,2- டை- குளோரோ ஈத்தேன்) பின்வரும் முறைகளில் தயாரிக்கலாம்.
i) எத்திலீனுடன் குளோரினின் சேர்க்கைவினை
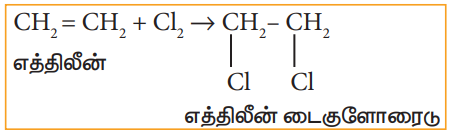
ii) PCl5 (அல்லது HCl), எத்திலீன் கிளைக்காலுடன் வினை
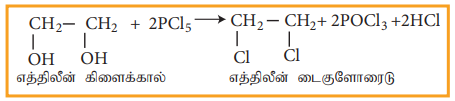
பண்புகள்
இயற்பண்புகள்
(i) இவை இனிப்பு மணமுடையவை, நிறமற்ற திரவங்கள், அதிக கொதிநிலையைப் பெற்றுள்ளன.
(ii) எத்திலீன் டை குளோரைடைக் காட்டிலும் எத்திலீடின் குளோரைடின் கொதிநிலை அதிகம்.
வேதிப்பண்புகள்
1) நீர்த்த NaOH அல்லது பொட்டாசியம் ஹைட்ராக்ஸைடுடன் நீராற்பகுப்பு.
ஜெம் டை ஹாலைடுகளை நீர்த்த KOH ஆல் நீராற்பகுக்கும் போது ஆல்டிஹைடு அல்லது கீட்டோனைத் தருகின்றது. விசினைல் டை ஹாலைடுகளை நீர்த்த KOH ஆல் நீராற்பகுக்கும் போது கிளைக்கால்களைத் தருகின்றன.
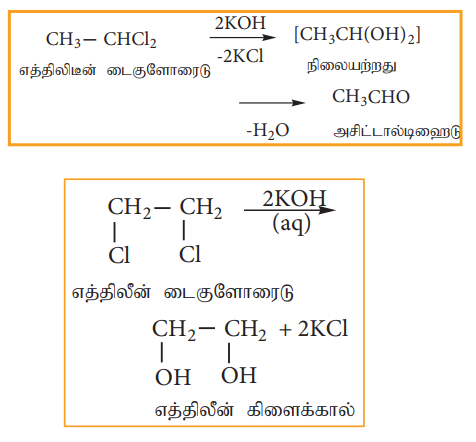
ஜெம் மற்றும் விசினைல் டை ஹாலைடுகளை வேறுபடுத்தி அறிய இவ்வினை பயன்படுகிறது.
2) துத்தநாகத்துடன் வினை (ஹாலஜன் நீக்க வினை)
ஜெம் மற்றும் விசினைல் டை ஹாலைடுகளை மெத்தனாலில் உள்ள துத்தநாகத் தூளுடன் வினைபடுத்தும் போது ஆல்கீன்கள் பெறப்படுகின்றன.
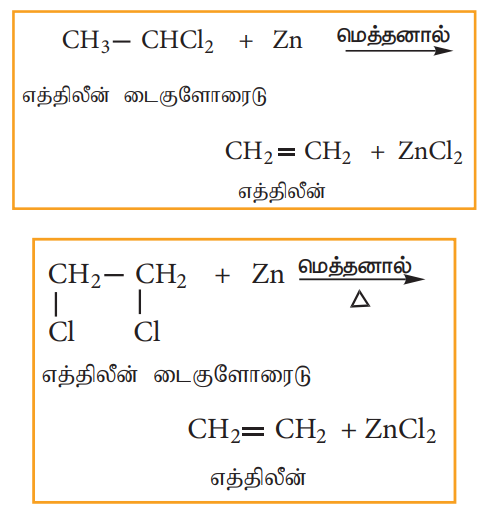
3) ஆல்கஹால் கலந்த KOH உடன் வினை (ஹைட்ரோ ஹாலஜன் நீக்க வினை)
ஜெம் டை ஹாலைடு மற்றும் விசினைல் டைஹாலைடுகள் ஆல்கஹால் கலந்த KOH உடன் வினைபுரிந்து ஆல்கைனைத் தருகின்றன.
மெத்திலீன் குளோரைடு (டைகுளோரோ மீத்தேன்)
தயாரித்தல்
மெத்திலீன் குளோரைடை பின்வரும் முறைகளில் தயாரிக்கலாம்.
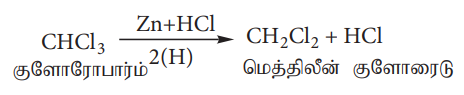
1) குளோரோஃபார்மின் ஒடுக்க வினை
a) Zn/HCl ஐப் பயன்படுத்தி ஒடுக்கம் செய்தல்
Zn+HCl உடன் குளோரோஃபார்மை ஒடுக்க வினைக்கு உட்படுத்தும் போது மெத்திலீன் குளோரைடு உருவாகிறது.
b) H2/Ni ஐப் பயன்படுத்தி ஒடுக்கம் செய்தல்
H2/Ni உடன் குளோரோஃபார்மை ஒடுக்க வினைக்கு உட்படுத்தும் போது மெத்திலீன் குளோரைடு உருவாகிறது.

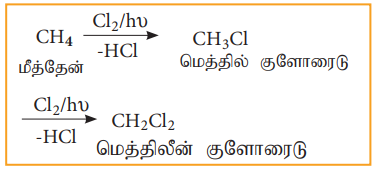
2) மீத்தேனின் குளோரினேற்றம்
மீத்தேனின் குளோரினேற்றத்தால் மெத்திலீன் குளோரைடு உருவாகிறது.
மெத்திலீன் குளோரைடின் பயன்கள்
மெத்திலீன் குளோரைடானது
i) காற்றுத் திவலை உந்தி செலுத்தும் ஆற்றல் மூலம்
ii) பெயிண்டுகளை நீக்கும் கரைப்பான்
iii) மருந்துப் பொருட்கள் தயாரிப்பில் கரைப்பான்
iv) உலோகம் நீக்கும் கரைப்பான் ஆகியனவற்றில் பயன்படுகிறது.
2. ட்ரை ஹேலோ ஆல்கேன்
ஒரு ஹைட்ரோகார்பனில் உள்ள மூன்று ஹைட்ரஜன் அணுக்களை மூன்று ஹேலஜன் அணுக்களால் பதிலீடு செய்வதால் உருவாகும் சேர்மங்கள் ட்ரை ஹேலோ ஆல்கேன்கள் எனப்படும்.
எடுத்துக்காட்டு
CHCl3 CHI3
குளோரோபார்ம் அயடோபார்ம்
1) குளோரோபார்ம்
இது ஒரு முக்கியமான ட்ரை ஹேலோ ஆல்கேனாகும். நீராற்பகுப்பில் இது பார்மிக் அமிலத்தை தருவதால் டுமாஸ் CHCl3 ஐ குளோரோபார்ம் என பெயரிட்டார்.
தயாரித்தல்
ஆய்வகத்தில், எத்தில் ஆல்கஹாலை சலவைத் தூளுடன் வினைப்படுத்தி பின் அதனைத் தொடர்ந்து வாலைவடித்தல் மூலம் குளோரோபார்ம் விளைப்பொருளாகப் பெறப்படுகின்றது. சலவைத் தூளானது குளோரின் மற்றும் கால்சியம் ஹைட்ராக்ஸைடின் மூலமாக பயன்படுகிறது. இவ்வினை ஹேலோபார்ம் வினை என அழைக்கப்படுகிறது.
இவ்வினை பின்வரும் மூன்று படிகளில் நிகழ்கிறது
படி 1 ஆக்சிஜனேற்றம்
CH3CH2OH + Cl2 (எத்தில் ஆல்கஹால்) → CH3CHO + 2HCl (அசிட்டால்டிஹைடு)
படி 2 குளோரினேற்றம்
CH3CHO + 3Cl2 (அசிட்டால்டிஹைடு) → CCl3 CHO + 3HCl (ட்ரைகுளோரோ அசிட்டால்டிஹைடு)
படி 3 நீராற்பகுத்தல்
2CCl3CHO + Ca(OH)2 → 2CHCl3 + (HCOO)2Ca
குளோரால் குளோரோஃபாம்
பண்புகள்
இயற்பண்புகள்
(1) இது ஒரு நிறமற்ற நீர்மம். ஈதரைப் போன்ற மணமுடைய இலேசான இனிப்புச்சுவையுடையது.
(ii) குளோரோஃபார்ம் ஆவியினை நுகரும் போது உணர்விழத்தல் (மைய நரம்பு பாதிப்பு) ஏற்படுகிறது. எனவே இது உணர்வு நீக்கியாக பயன்படுகிறது.
வேதிப்பண்புகள்
1) ஆக்சிஜனேற்றம்
காற்று மற்றும் ஒளியின் முன்னிலையில் குளோரோபார்ம் ஆக்சிஜனேற்ற வினைக்கு உட்பட்டு பாஸ்ஜீன் (கார்பனைல் குளோரைடைத்) தருகிறது.
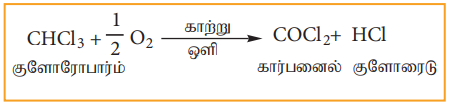
பாஸ்ஜீன் நச்சுத்தன்மை உடையது. இதன் காரணமாக குளோரோபாரம் ஆனது உணர்வு நீக்கியாக பயன்படுத்த தகுதியற்ற பொருளாகிறது.
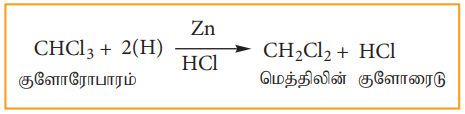
2) ஒடுக்கம்
எத்தில் ஆல்கஹால் முன்னிலையில் Zn மற்றும் HCl ஆல் குளோரோபார்ம் ஓடுக்க வினைக்கு உட்பட்டு மெத்திலீன் குளோரைடை தருகிறது.
3) நைட்ரோ ஏற்றம்
குளோரோபார்ம் நைட்ரிக் அமிலத்துடன் வினைப்பட்டு குளோரோ பிக்ரின் (ட்ரைகுளோரோ நைட்ரோ மீத்தேன்) உருவாகிறது.
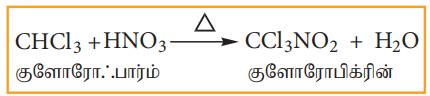
இது பூச்சிக் கொல்லியாகவும், மண் தூய்மையாக்கும் காரணியாகவும் பயன்படுகிறது.
4) கார்பைலமீன் வினை
குளோரோபார்ம் ஆனது அலிபாட்டிக் அல்லது அரோமேட்டிக் ஒரிணைய அமீன்களுடன் ஆல்கஹால் கலந்த KOH முன்னிலையில் வினைப்பட்டு வெறுக்கத்தக்க மணமுடைய ஆல்கைல் ஐசோ சயனைடைத் தருகின்றது.
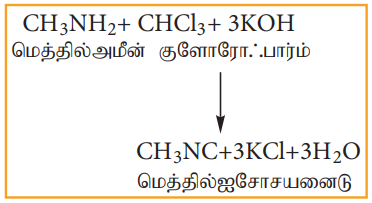
இவ்வினை ஓரிணைய அமீன்களைக் கண்டறியப் பயன்படுகிறது.
தன்மதிப்பீடு
7) குளோரோஃபார்ம் ஆனது சிறிதளவு எத்தில் ஆல்கஹால் உள்ள அடர் நிறமுடைய கலன்களில் வைக்கப்படுகிறது. ஏன்?
தீர்வு:
● காற்று மற்றும் ஒளியின் முன்னிலையில் குளோரோபார்ம் ஆக்சிஜனேற்றமடைந்து நச்சுத்தன்மையுடைய பாஸ்ஜீனை தருகிறது. ஆக்சிஜனேற்ற வினைக்கு உட்படுவதை தவிர்க்க அடர்நிற கலனில் சிறிதளவு எத்தில் ஆல்கஹால் சேர்க்கப்படுகிறது.
3. டெட்ரா ஹேலோ ஆல்கேன்
டெட்ரா ஹேலோ ஆல்கேன்களுக்கு கார்பன் டெட்ரா குளோரைடு ஒரு சிறந்த உதாரணமாகும்.
கார்பன் டெட்ரா குளோரைடு : CCl4
தயாரித்தல்:
1. மீத்தேனின் குளோரினேற்றம்
மீத்தேனை சூரிய ஒளியின் முன்னிலையில் அதிக அளவு குளோரினுடன் வினைப்படுத்தும்போது கார்பன்டெட்ரா குளோரைடு பெருமளவில் கிடைக்கிறது.
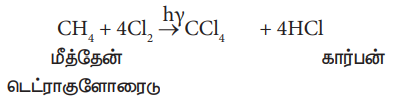
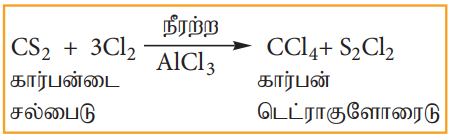
2. குளோரின் உடன் கார்பன்டைசல்பைடின் வினை
நீரற்ற AlCl3 வினையூக்கி முன்னிலையில் கார்பன்டைசல்பைடானது குளோரின் வாயுவுடன் வினைப்பட்டு கார்பன் டெட்ரா குளோரைடைத் தருகிறது.
இயற்பண்புகள்
(i) கார்பன் டெட்ரா குளோரைடானது தனித்த மணமுடைய நிறமற்ற திரவம்.
(ii) இது நீரில் கரைவதில்லை மேலும் கரிமக் கரைப்பான்களில் கரைகின்றன.
வேதிப்பண்புகள்
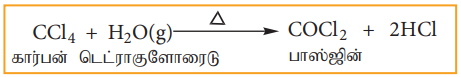
(1) நீராற்பகுத்தல்:
கார்பன் டெட்ராகுளோரைடானது சூடான நீர் அல்லது நீராவியுடன் வினைபுரிந்து நச்சுத்தன்மையுடைய பாஸ்ஜீன் எனும் வாயுவைத் தருகின்றது.
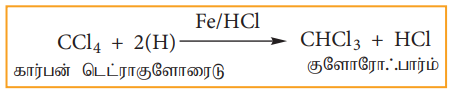
(ii) ஒடுக்கம்
நீர்த்த HCl ல் உள்ள இரும்புத்துகளால் கார்பன் டெட்ரா குளோரைடு ஒடுக்கமடைந்து குளோரோஃபார்மைத் தருகிறது.
4. ஃப்ரீயான்கள் (CFC)
மீத்தேன் மற்றும் ஈத்தேனின் குளோரோ புளூரோ பெறுதிகள் ஃப்ரீயான்கள் என அழைக்கப்படுகின்றன.
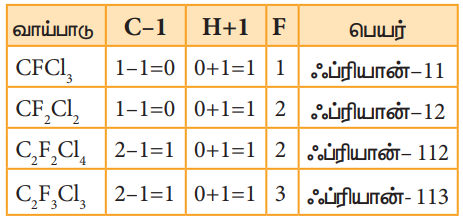
பெயரிடுதல்
ஃப்ரீயானானது ஃப்ரியான்-cba என குறிப்பிடப்படுகிறது. இங்கு,
c = கார்பன் அணுக்களின் எண்ணிக்கை -1
b = ஹைட்ரஜன் அணுக்களின் எண்ணிக்கை +1
a = மொத்தபுளூரின்அணுக்களின்எண்ணிக்கை
எடுத்துக்காட்டு
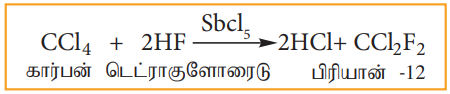
2) ஹைட்ரஜன் புளூரைடை, கார்பன் டெட்ரா குளோரைடுடன் சிறிதளவு ஆன்டிமனி பென்டா குளோரைடு வினைவேக மாற்றி முன்னிலையில் வினைப்படுத்தும் போது ஃப்ரியான்-12 உருவாகிறது. இவ்வினை ஸ்வார்ட்ஸ் வினை எனப்படும்.
இயற்பண்புகள்
ஃப்ரீயான்கள் அதிக நிலைப்புத் தன்மை உடையவை, வினை புரியாத, அரிமானத்திற்கு உட்படாத, நச்சுத் தன்மையற்ற எளிதில் திரவமாகும் வாயுக்களாகும்.
பயன்கள்
(i) குளிர்சாதனப் பெட்டிகள் மற்றும் காற்று வெப்பநிலை சீராக்கி ஆகியனவற்றில் ஃப்ரீயான்கள் குளிர்விப்பானாகப் பயன்படுகின்றன.
(ii) காற்று திவலை மற்றும் நுரைப்பு ஆகியனவற்றிற்கு உந்து ஆற்றல் மூலமாக பயன்படுகிறது.
(iii) வாசனை திரவியங்கள், முகச்சவர கிரீம்கள் பூச்சிக் கொல்லிகள் ஆகியவற்றின் நுரை தெளிப்பான் உந்து ஆற்றல் மூலமாக பயன்படுகிறது.
5. DDT (p,p, - டைகுளோரோடைபினைல் ட்ரை-குளோரோ ஈத்தேன்)
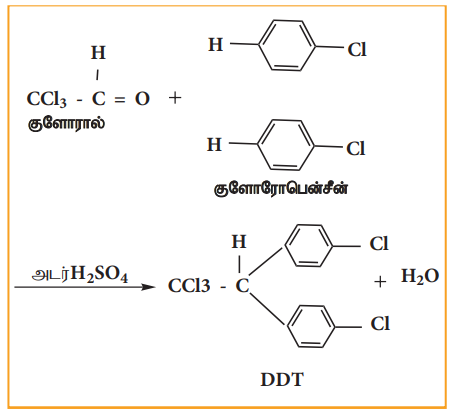
1873ல் முதல் குளோரினேற்றம் செய்யப்பட்ட கரிம பூச்சுக் கொல்லியான DDT தயாரிக்கப்பட்டது. 1939ல் பால் முல்லர் எனும் வேதியிலாளர் DDTன் பூச்சிக் கொல்லும் தன்மையினைக் கண்டறிந்தார். இக் கண்டுபிடிப்பிற்காக 1948ஆம் ஆண்டிற்கான மருத்துவம் மற்றும் உடற்கூறியலுக்கான நோபல் பரிசு இவருக்கு வழங்கப்பட்டது. அடர் H2SO4 முன்னிலையில், குளோரோ பென்சீனை குளோராலுடன் (ட்ரைகுளோரோ அசிட்டால்டிஹைடு) வெப்பப்படுத்தி DDT தயாரிக்கப்படுகிறது.
தன்மதிப்பீடு
8) DDT பூச்சிக் கொல்லியின் IUPAC பெயர் என்ன? பெரும்பாலான நாடுகளில் இவற்றின் பயன்பாடு தடை செய்யப்பட்டுள்ளது. ஏன்?
தீர்வு:
● DDT யின் IUPAC பெயர் : 2, 2 - பிஸ் (p- குளோரோ பினைல்) -1,1,1 - ட்ரை குளோரோ ஈத்தேன்
● DDT அதிக நிலைப்புத்தன்மை மற்றும் உயிரியால் மக்கா தன்மை உடையவை.
● DDT நச்சுத்தன்மை கொண்டவை. இதனால் உணவு சங்கிலியில் பாதிப்பு மற்றும் வளர்சிதை சீர்மையற்ற நிலையை உருவாகும்.
பயன்கள்
i) மலேரியா மற்றும் மஞ்சள் காய்ச்சல் போன்ற நோய்களுக்கு காரணமான சில பூச்சிகளை கட்டுப்படுத்த DDT பயன்படுகிறது.
ii) சில பூச்சிகளை கட்டுப்படுத்த விவசாய பண்ணைகளில் பயன்படுத்தப்படுகிறது.
ii) கட்டுமானத் தொழிலில் பூச்சிக் கட்டுப்படுத்தியாகப் பயன்படுகிறது.
iv) இது அதிக நச்சுத் தன்மையினைப் பெற்றிருப்பதால் வீட்டில், ஈக்கள் மற்றும் கொசுக்களை கொல்வதற்கு பயன்படுகிறது.