11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
கணக்குகளுக்கான தீர்வுகள்: வெப்ப இயக்கவியல்
53. 25°C வெப்பநிலை மற்றும் சாதாரண அழுத்தத்தில், 2 மோல்கள் நல்லியல்பு வாயு, மீள்முறையில், மாறா வெப்பநிலையில் விரிவடையும்போது அதன் கனஅளவு 500 ml லிருந்து 2L ஆக மாறுகிறது எனில், செய்யப்பட்ட வேலையை கணக்கிடுக.
தீர்வு:
n = 2 moles
Vf = 2lit
Vi = 500ml = 0.5lit
T = 25°C = 298K
w = −2.303nRT log[Vf / Vi]
w = −2.303 × 2 × 8.314 × 298 × log[2 / 0.5]
w = −2.303 × 2 × 8.314 × 298 × log(4)
w = −2.303 × 2 × 8.314 × 298 × 0.6021
w = −6871 J
w = −6.871 kJ
54. கனஅளவு மாறா கலோரிமீட்டரில், மூலக்கூறுநிறை 28 கொண்ட, 3.5 g வாயு அதிகளவு ஆக்ஸிஜன் செலுத்தி, 298K வெப்பநிலையில் முற்றிலுமாக எரிக்கப்பட்டது. எரிதல் வினையின் காரணமாக கலோரி மீட்டரின் வெப்பநிலை 298K லிருந்து 298.45K க்கு உயர்ந்துள்ளது. கலோரி மீட்டர் மாறிலி மதிப்பு 2.5 kJ K-1 எனில், வாயுவின் எரிதல் என்தால்பி மதிப்பை kJ mol-1 அலகில் காண்க.
தீர்வு:
Ti = 298K
Tf = 298.45K
Mm = 28
k = 2.5 kJK−1
m = 3.5g
உமிழப்பட்ட வெப்பம் = K∆T
= k (Tf − Ti)
= 2.45 kJK−1 × (298.45 − 298)K
= 1.125 kJ
3.5 கி வாயு வெளியிடப்பட்ட வெப்பம் = 1.12 kJ
ஃஒரு மோல் (அ) 28 கி வாயு வெளியிடும் வெப்பம் = (1.125 × 28) / 3.5
∆Hc = 9KJ mol−1
55. 77°C வெப்பநிலையில் உள்ள ஒரு அமைப்பிலிருந்து 33°C. வெப்பநிலையில் உள்ள சுற்றுப்புறத்திற்கு, 245 J ஆற்றல் பாயும்போது, அமைப்பு, சுற்றுப்புறம் மற்றும் அண்டத்தில் ஏற்படும் என்ட்ரோபி மாற்றங்களை கணக்கிடு.
தீர்வு:
Tஅமைப்பு = 77°C = (77 + 273) = 350K
Tசூழல் = 33°C = (33 + 273) = 306K
q = 245 J

∆S = ∆Sஅமைப்பு + ∆Sசூழல்
∆S = −0.7 JK−1 + 0.8 JK−1 = −0.1 JK−1
56. 4.1 வளிமண்டல அழுத்தம், மற்றும் குறிப்பிட்ட வெப்பநிலையில் உள்ள 1 மோல் நல்லியல்பு வாயு, 3710J ஆற்றலை உறிஞ்சி, 2L விரிவடைகிறது. இந்த விரிவடைதலின்போது நிகழும் என்ட்ரோபி மாற்றத்தை கணக்கிடு.
தீர்வு:
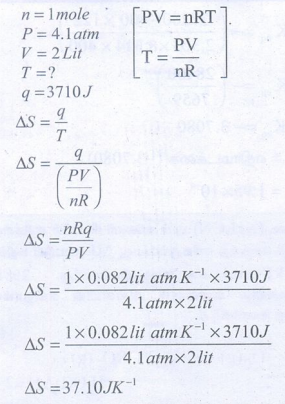
57. ஒரு மோல் சோடியம் குளோரைடை உருக்க 30.4 kJ அளவு ஆற்றல் தேவைப்படுகிறது. உருகுதலின் போது நிகழும் என்ட்ரோபி மாற்றம் 28.4 JK-1 mol-1 னில் சோடியம் குளோரைடின் உருகுநிலையை காண்க.
தீர்வு:
∆Hf (NaCl) = 30.4kJ = 30400 J mol−1
∆S f (NaCl) = 28.4JK−1 mol−1
Tf = ?
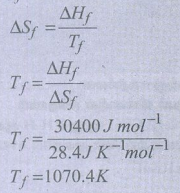
T f = 1070.4K
58. புரப்பேனின் திட்ட எரிதல் என்தால்பி மதிப்பு -2220.2 kJ mol-1 CO2 (g) மற்றும் H2O (l) ஆகியவற்றின் திட்ட உருவாதல் என்தால்பி மதிப்புகள் முறையே -393.5 மற்றும் -285.8 kJ mol-1 எனில், புரப்பேனின் திட்ட உருவாதல் என்தால்பி மதிப்பை காண்க.
தீர்வு:
∆H0f co2 = − 393.5 kJ mo1−1
∆H0f H2O = − 285.5 kJ mol−1
∆H0f C3H8 = −2220.2 kJ mol−1
புரோப்பேன் எரிதல் வெப்பம்
C3H8 + 5O2 → 3CO2 + 4H2O
∆H0c = ∑ ∆H0fp − ∑∆H0fr

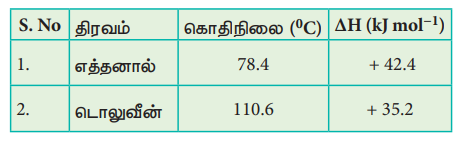
59. சாதாரண கொதிநிலை மற்றும் திட்ட ஆவியாதல் என்தால்பி மதிப்புகள் கொடுக்கப்பட்டுள்ளன. கீழ்காண் திரவங்களுக்கு ஆவியாதல் என்ட்ரோபி மதிப்புகளை காண்க.

60. 1 atm அழுத்தத்தில் கீழ்காணும் வினைக்கு
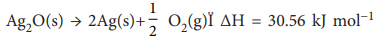 மற்றும் ΔS = 6.66 JK-1 mol-1 எனில் எந்த வெப்பநிலையில் ΔG மதிப்பு பூஜ்ஜியமாக இருக்கும் என்பதை கணக்கிடுக. (i) அந்த வெப்பநிலையில் மற்றும் (ii) அந்த வெப்பநிலைக்கு கீழ்வினை நிகழும் திசையை காண்க.
மற்றும் ΔS = 6.66 JK-1 mol-1 எனில் எந்த வெப்பநிலையில் ΔG மதிப்பு பூஜ்ஜியமாக இருக்கும் என்பதை கணக்கிடுக. (i) அந்த வெப்பநிலையில் மற்றும் (ii) அந்த வெப்பநிலைக்கு கீழ்வினை நிகழும் திசையை காண்க.
தீர்வு:
கொடுக்கப்பட்டவை
∆H = 30.56kJmol−1
= 30560Jmol−1
∆S = 6.66 × 10−3 kJK−1mol−1
T = ? இருக்கும்போது ∆G = 0
∆G = ∆H − T ∆S
0 = ∆H − T∆S
T = ∆H/ ∆S
T = 30.56kJmol−1/6.66 × 10−3 kJK−1mol−1
T = 4589K
(i) 4589K வெப்பநிலை ∆G = 0 வினை சமநிலையில் உள்ளது.
(ii) வெப்பநிலை 4589K க்கு கீழே உள்ள போது ∆H > T∆S மற்றும் ∆G = ∆H – T∆S > 0 எனவே முன்னோக்கி வினையானது தன்னிச்சையற்றது பின்னோக்கிய வினை நிகழும்.
61. 400K. வெப்பநிலையில் பின்வரும் வினையின் சமநிலை மாறிலி Keq மதிப்பை காண்க.
2 NOCl (g) ⇋ 2NO (g) + Cl2 (g),
ΔH0 = 77.2 kJ mol-1
மற்றும் ΔS0 = 122 JK-1 mol-1
தீர்வு :
T = 400 K
∆H°c = 77.2 KJmol−1
= 77200 Jmol−1
∆G° = −2.303 RT log Keq

log Keq = −3.7080
Keq = எதிர்மடக்கை (−3.7080)
Keq = 1.95 × 10−4
62. சயனமைடை (NH2 CN) பாம் கலோரி மீட்டரில், அதிகளவு ஆக்ஸிஜன் செலுத்தி எரிக்கும்போது ஏற்படும் ΔU மதிப்பு -742.4 kJ mol-1, என கண்டறியபட்டது. 298 K வெப்பநிலையில் பின்வரும் வினையின் என்தால்பி மாற்றத்தை கணக்கிடுக.
NH2CN (s) + 3/2 O2 (g) → N2 (g) + CO2 (g) + H2O (l) ΔH= ?
தீர்வு:
T = 298K; ∆U = −742.4kJmol−1
∆H = ?
∆H = ∆U + ∆ng RT
∆H = ∆U + (np − nr )RT
∆H = −742.4 + (2 – 3/2) × 8.314 × 10−3 × 298
= −742.4 + (0.5 × 8.314 × 10−3 × 298)
= −742.4 + 1.24
= −741.16kJmol−1
63. பின்வரும் தரவுகளிலிருந்து எத்திலீனை ஹைட்ரஜனேற்றம் செய்யும் வினையின் என்தால்பி மதிப்பை காண்க. C-H, C-C, C=C மற்றும் H-H ஆகிய பிணைப்புகளின் பிணைப்பு ஆற்றல்கள் முறையே 414, 347, 618 மற்றும் 435 kJ mol-1
தீர்வு:
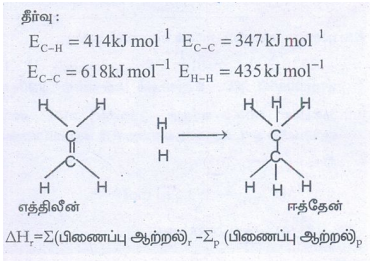
∆Hr = ∑(பிணைப்பு ஆற்றல்)r − ∑p (பிணைப்பு ஆற்றல்)p
∆Hr = (EC−C + 4 EC−H + EH−H) − (EC−C + 6 EC−H)
∆Hr = (618 + (4 × 414) = 435) − (347 + (6 × 414))
∆Hr = 2709−2831
∆Hr = −122 kJ mol−1
64. பின்வரும் தரவுகளிலிருந்து CaCl2 படிகத்தின் படிக கூடு ஆற்றலை கணக்கிடு.
Ca (s) + Cl2 (g) → CaCl2 (s) ΔH0f = -795 kJ mol-1
பதங்கமாதல் : Ca (s) → Ca (g) ΔH01 = + 121 kJ mol-1
அயனியாதல் : Ca (g) → Ca2+ (g) + 2e- ΔH02 = + 2422 kJ mol-1
பிளத்தல் : Cl2 (g) → 2Cl (g) ΔH03 = + 242.8 kJ mol-1
எலக்ட்ரான் நாட்டம் : Cl (g) + e- → Cl- (g) ΔH04 = -355 kJ mol-1
தீர்வு:
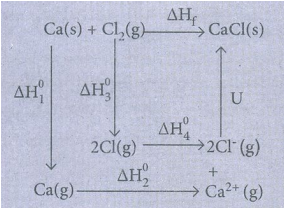
ΔΗf = ΔΗ1 + ΔΗ2 + ΔΗ3 + 2ΔΗ4 + u
−795 = 121 + 2422 + 242.8 + (2 × −355) + u
−795 = 2785.8 – 710 + u
−795 = 2075.8 + u
u = −795 − 2075.8
u = −2870.8 kJ mol−1
65. கொடுக்கப்பட்டுள்ள தரவுகளிலிருந்து Fe2O3 + 3CO → 2Fe + 3CO2 வினையின் என்தால்பி மாற்ற மதிப்பை கணக்கிடுக.
2 Fe + 3/2 O2 → Fe2O3 ΔH = -741 kJ
C + 1/2 O2 → CO ΔH = - 137 kJ
C + O2 → CO2 ΔH = - 394.5 kJ
தீர்வு:
∆Hf (Fe2O3) = −741kJmol−1
∆Hf (CO) = −137 kJ mol−1
Fe2O3 + 3CO → 2Fe + 3CO2 ∆Hr = ?
∆Hr = ∑(∆Hf) வினைவிளை பொருள் − ∑(∆Hf) வினைபடு பொருள்
∆Hr = [0 + 3(−394.5)] − [−741 + 3(−137)]
∆Hr = [−1183.5] − [−1152]
∆Hr = −1183.5 + 1152.
∆Hr = −31.5kJ mol−1
66. 175o C, வெப்பநிலையில் 1-பென்டைனை (A), ஆல்கஹால் கலந்த 4N KOH கரைசலுடன் வினைப்படுத்தும் போது, 1.3% 1-பென்டைன் (A), 95.2% 2- பென்டைன் (B) மற்றும் 3.5% 1, 2 பென்டாடையீன் (C) கலந்த சமநிலைக் கலவையை உண்டாக்குகிறது 175° C, வெப்பநிலையில் பின்வரும் சமநிலைகளின் ΔG0 மதிப்பை கணக்கிடுக.
B ⇋ A ΔG01 = ?
B ⇋ C ΔG02 = ?
T = 175°C = 175 + 273 = 448K
தீர்வு:
1− பென்டைனின் செறிவு [A] = 1.3%
2 − பென்டைனின் செறிவு [B] = 95.2%
1,2 பென்டாடையீனின் செறிவு [C] = 3.5% சமநிலையில்
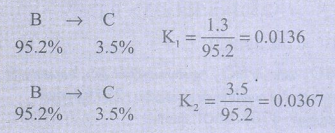
∆G01 = −2.303 RT logK1
∆G01 = −2.303 × 8.314 × 448 × log0.0136
∆G01 = −2.303 × 8.314 × 448 × −1.8664
∆G01 = +16010 J
∆G01 = +16 kJ
∆G02 = −2.303RTlogK2
∆G02 = −2.303 × 8.314 × 448 × log 0.0367
∆G02 = −2.303 × 8.314 × 448 × −1.4353
∆G02 = +12312J
∆G02 = +12.312kJ
67. 33K வெப்பநிலையில், ஐம்பது சதவீதம் N2O4 சிதைகிறது எனில், அந்த வெப்பநிலையில், 1 atm அழுத்தத்தில் ஏற்படும் திட்டகட்டிலா ஆற்றல் மாற்றத்தை கணக்கிடு.
தீர்வு:

சமநிலையில் மொத்த மோல்கள் 0.5 + 1 = 1.5
பகுதி அழுத்தம் = மோல் பின்னம் × மொத்த அழுத்தம்
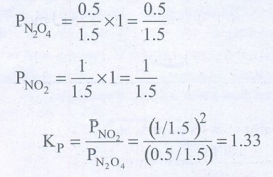
∆Go = −2.303RT log Keq
= −2.303 × 8.314 × 33 log 1.33
= −2.303 × 8.314 × 33 × 0.1239
∆Go = −78.29Jmol−1
68. SO2 மற்றும் SO3 ஆகியவற்றின் திட்ட உருவாதல் என்தால்பி மதிப்புகள் முறையே - 297 kJ mol-1 மற்றும் -396 kJ mol-1, எனில் SO2 + 1/2 O2 → SO3 வினையின் திட்ட என்தால்பி மதிப்பை காண்க.
தீர்வு:
கொடுக்கப்பட்டவை
∆H0f (SO2) = −297 kJ mol−1
∆H0f (SO3) = −396 kJ mol−1
SO2 + ½ O2 → SO3
∆H0f = ?
∆H0f = (∆H0f) compound − ∑ (∆Hf) elements
∆H0f = ∆H0f (SO3) − (∆H0f (SO2) + ½ ∆H0f (O2) )
∆H0f = −396kJ mol−1 = −(−297kJ mol−1 + 0)
∆H0f = −396kJ mol−1 + 297
∆H0f = −99kJ mol−1
69. 298 K வெப்பநிலையில் 2A + B → C வினையின் ΔH = 400 KJ mol-1, ΔS = 0.2 KJK-1 mol-1 எனில் வினை தன்னிச்சையாக நிகழ தேவையான வெப்பநிலையை கணக்கிடுக.
தீர்வு:
T = 298K
∆H = 400J mol−1 = 400 J mol−1
∆S = 0.2J K−1 mol−1
∆G = ∆H − T∆S
if T = 2000 K
∆G = 400 − (0.2 × 2000) = 0
if T > 2000K
∆G எதிர்குறியீட்டை பெற்றிருக்கும். எனவே 2000 K மேல் வினை தன்னிச்சையாக நிகழும்.
70. 298K வெப்பநிலையில் பின்வரும் வினைக்கு சமநிலை மாறிலி மதிப்பை கணக்கிடுக. 2NH3 (g) + CO2 (g) NH2CONH2 (aq) + H2O (l) கொடுக்கப்பட்ட வெப்ப நிலையில் வினையின் திட்ட கட்டிலா ஆற்றல் மாற்ற ΔG0r மதிப்பு, - 13.6 KJ mol-1
தீர்வு:
கொடுக்கப்பட்டவை T = 298 K
∆G0r = −13.6kJ mol–1
∆G0 = −2.303 RT log Keq
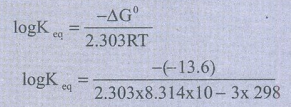
log Keq = 2.38
Keq = எதிர்மடக்கை (2.38)
Keq = 239.88
71. 3.67 லிட்டர் கொள்ளவு கொண்ட எத்திலீன் மற்றும் மீத்தேன் வாயுக்கலவையை, 25° C மற்றும் 1 வளிமண்டல அழுத்தத்தில் முழுமையாக எரிக்கும் போது 6.11 L கார்பன்டையாக்சைடு வாயுவை உருவாக்குகிறது. எரிதலின்போது வெளிப்படும் வெப்பத்தின் அளவை kJ, அலகில் கணக்கிடுக. ΔHC (CH4) = - 890 kJ mol-1 மற்றும் ΔHC (C2H4) = -1423 kJ mol-1
தீர்வு:
கொடுக்கப்பட்டவை
∆HC (CH4) = −890 kJ mol−1
∆HC (C2H4) = −1423 kJ mol−1
கொடுக்கப்பட்ட கலவை X லிட்டர்
மீத்தேனையும் (3.67 − X) லிட்டர் எத்திலீனையும் கொண்டுள்ளதாகக் கருதுக.
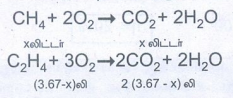
வினைப்பட்ட ஆக்சிஜனின் கனஅளவு
= X + 2(3.67 − X) = 6.11 லிட்டர்
X + 7.34 – 2X = 6.11
7.34 – X = 6.11
X = 1.23 லிட்டர்
கொடுக்கப்பட்டக் கலவையானது 1.23 லிட்டர் மீத்தேனையும் 2.44 லிட்டர் எத்திலீனையும் கொண்டுள்ளது. எனவே

∆HC = – 203.87 kJmol−1