11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
பாடச்சுருக்கம்
பாடச்சுருக்கம்
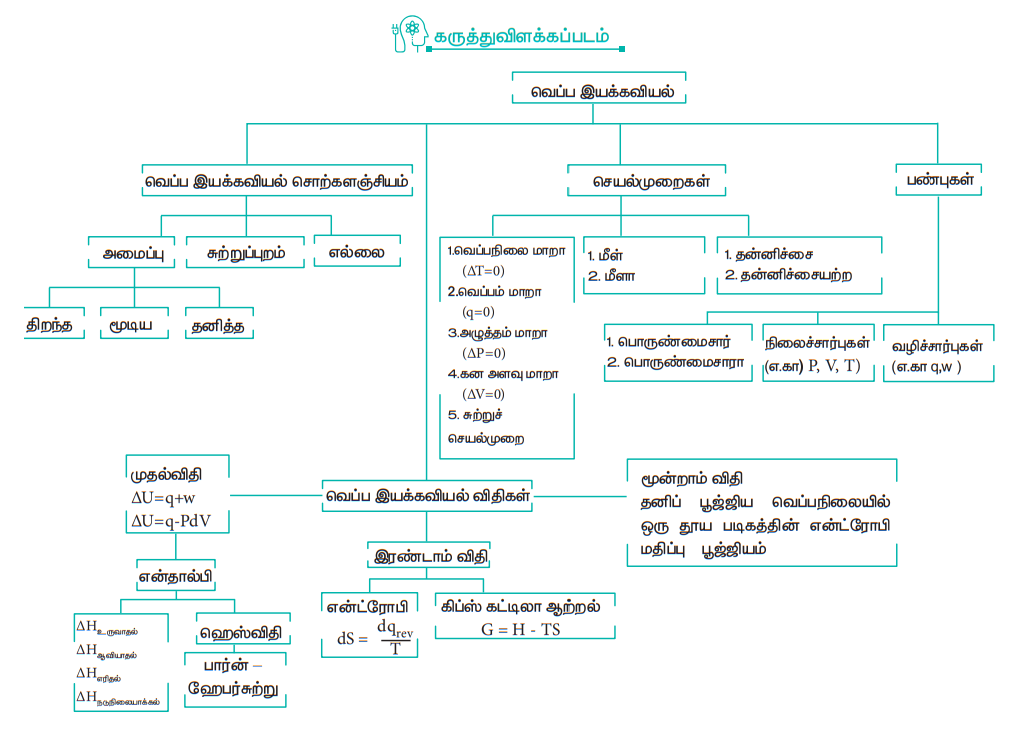
ஆற்றல், வெப்பம் மற்றும் வேலை ஆகியவற்றிற்கிடையே உள்ள தொடர்பை விளக்கும் அறிவியலின் பகுதி வெப்ப இயக்கவியல் எனப்படுகிறது. வெப்ப இயக்கவியலை கற்பதன் முக்கிய நோக்கம் (1) ஒருவகையான ஆற்றலை மற்றொருவகை ஆற்றலாக மாற்றுதல் (2) பல்வேறு வகையான ஆற்றல்களை பயன்படுத்துதல் ஆகியவற்றை பற்றி கற்றலே ஆகும்
அமைப்பு:
அமைப்பு என்பது வெப்ப இயக்கவியல் ஆய்விற்கு எடுத்துக் கொள்ளப்படும் அண்டத்தின் ஏதெனும் ஒரு பகுதி அமைப்பு என வரையறுக்கப்படுகிறது. வெப்ப இயக்கவியல் அமைப்புகள் மூன்று வகைப்படும். அவையாவன (i) தனித்த அமைப்பு (ii) மூடியஅமைப்பு (iii) திறந்த அமைப்பு.
சூழல்:
அண்டத்திலுள்ள, அமைப்பின் பகுதியாக இல்லாத அனைத்தும் சூழல் என்றழைக்கப்படுகிறது.
எல்லை:
அமைப்பை, சூழலிருந்து பிரிக்கும் எதுவும் எல்லை என்றழைக்கப்படுகிறது.
வெப்ப இயக்கவியல் பண்புகள்:
அமைப்பின் நிலையை மட்டுமே பொறுத்து அமையும் எந்தப் பண்பும் வெப்ப இயக்கவியல் பண்பு என்றழைக்கப்படுகிறது. இந்தப் பண்புகள் இரண்டு வகைப்படும் (1) பொருண்மை சாராபண்பு - இவை பொருளின் அளவை பொறுத்து மாறுவதில்லை (2) பொருண்மை சார்பண்பு – இவை பொருளின் அளவை பொறுத்து மாறுகின்றன. நான்கு அடிப்படை வெப்ப இயக்கவியல் ( U, H, S மற்றும் G) பண்புகள் உள்ளன.
வெப்ப இயக்கவியல் செயல்முறைகள் :
வெப்பம் மாறா செயல்முறையில் வெப்பமாற்றம் நிகழ்வதில்லை (q = 0)
வெப்பநிலை மாறா செயல்முறையில் வெப்பநிலை மாறாமல் உள்ளது. (dT = 0)
அழுத்தம் மாறா செயல்முறையில் அழுத்தம் மாறாமல் உள்ளது (dP = 0)
கனஅளவு மாறா செயல்முறையில் கனஅளவு மாறாமல் (dV = 0) உள்ளது.
சுற்றுச்செயல் முறையில் ஒரு அமைப்பானது, தொடர்ச்சியான பல்வேறு மாற்றங்களுக்கு உட்பட்ட பின்னர் அதன் உண்மையான ஆரம்பநிலைக்கு மீளத் திரும்புகிறது.
அகஆற்றல் (U):
அமைப்பின் அக ஆற்றல் என்பது அமைப்பிலுள்ள அனைத்து உட்கூறுகளான அணுக்கள், அயனிகள், மற்றும் மூலக்கூறுகள் ஆகியவை பெற்றிருக்கக்கூடிய ஆற்றல்களின் மதிப்புகளுக்கு சமம். ஒரு அமைப்பிலுள்ள அனைத்து மூலக்கூறுகளின் மொத்த ஆற்றல் என்பது அவைகளினுடைய இடப்பெயர்வு ஆற்றல், அதிர்வு ஆற்றல், சுழற்சி ஆற்றல், பிணைப்பு ஆற்றல், மின்னணு ஆற்றல், மற்றும் மூலக்கூறு இடையீடுகளால் உண்டாகும் ஆற்றல் ஆகியவற்றின் கூடுதலாகும்.
வெப்பம்:
வெப்பம் ஆனது, ஒரு அமைப்பினை சூழலிலிருந்து பிரிக்கும் எல்லை வழியே கடத்தப்படும் ஆற்றலாக கருதப்படுகிறது. வெப்பம் என்பது ஒரு வழிச்சார்பு ஆகும். வெப்பத்தின் SI அலகு ஜூல் (J). வேலை (w) விசை (F), மற்றும் இடப் பெயர்ச்சியின் (x). பெருக்குத் தொகை வேலை –w = F.dx என வரையறுக்கப்படுகிறது. வேலையானது ஜூல்களில் அளக்கப்படுகிறது. அதாவது வேலையின் SI அலகு ஜூல் (J), ஒரு வாயுவின் விரிவடைதல் அல்லது சுருங்குதல் நிகழும் போது செய்யப்படும் வேலையானது w = - PΔV எனும் தொடர்பினைக் கொண்டு கணக்கிடப்படுகிறது.
வெப்பம் மற்றும் வேலையின் குறியீட்டு நடைமுறை:
1. அமைப்பினால் வெப்பம் உறிஞ்சப்படும் போது : +q
2. அமைப்பிலிருந்து வெப்பம் வெளியேறும் போது : -q
3. அமைப்பினால் வேலை செய்யப்படும் போது : -w
4. அமைப்பின் மீது வேலை செய்யப்படும் போது: +w
வெப்ப இயக்கவியல் விதிகள்:
பூஜ்ஜியவிதி:
இரண்டு வெவ்வேறு வெப்ப நிலைகளிலுள்ள அமைப்புகள் தனித்தனியாக மூன்றாம் அமைப்புடன் வெப்ப சம நிலையில் இருந்தால், அந்த இரு அமைப்புகளும் தங்களுக்குள் வெப்ப சமநிலையில் இருக்கும்.
முதல்விதி:
ஆற்றலை ஆக்கவோ அல்லது அழிக்கவோ முடியாது, ஆனால் ஒரு வகையான ஆற்றலை மற்றொரு வகை ஆற்றலாக மாற்ற முடியும். U = q + w
என்தால்பி என்பது ஒரு வெப்ப இயக்கவியல் பண்பு ஆகும். என்தால்பி H என்பது அக ஆற்றல் மற்றும் அழுத்தம் கனஅளவு வேலை என வரையறுக்கப்படுகிறது. H = U + PV. என்தால்பி மாற்றம் ΔH = ΔU + ΔngRT
ஹெஸ்விதி:
மாறாத கனஅளவு அல்லது மாறாத அழுத்தத்தில் ஒரு வினை ஒரு படியில் நிகழ்ந்தாலோ அல்லது பல படிகளில் நிகழ்ந்தாலோ, அதன் ஆரம்ப மற்றும் இறுதிநிலைகள் மாறாதிருப்பின், அவ்வினையின் மொத்த என்தால்பி மதிப்பு மாறாமல் இருக்கும். என்தால்பி மதிப்பை அளவிட கடினமாக உள்ள வினைகளுக்கு ஹெஸ் விதியைப் பயன்படுத்தி கணக்கிடலாம்.
வெப்ப ஏற்புத் திறன்கள்( CP மற்றும் CV):
ஒரு குறிப்பிட்ட வெப்பநிலையில், ஒரலகு நிறையுள்ள பொருளின் வெப்ப நிலையை, ஒரு டிகிரி உயர்த்த தேவைப்படும் வெப்பத்தின் அளவானது அதன் வெப்ப ஏற்புத்திறன் எனப்படுகிறது. இதை இரண்டு வெவ்வேறு நிபந்தனைகளில் அளக்கமுடியும்.
(அ) மாறாத அழுத்தத்தில் CP = (dH / dT)P
(ஆ) மாறாதகனஅளவில் CV = (dU / dT)V
வெப்ப இயக்கவியலின் இரண்டாம்விதி
ஒரு வினை நிகழுமா, அல்லது நிகழாதா என்பதை வெப்ப இயக்கவியலின் இரண்டாம் விதிகணிக்கிறது, மேலும் வெப்பம் பாயும் திசைகளையும் கூறுகிறது. வினையின் தன்னிச்சை தன்மையை விளக்க என்ட்ரோபி (S) எனும் மற்றொரு நிலைச்சார்பை அறிமுகப்படுத்துகிறது. என்ட்ரோபி என்பது ஒரு அமைப்பின் ஒழுங்கற்ற தன்மை அல்லது சீரற்ற தன்மையை அளவிடும் பண்பாகும்.
என்ட்ரோபி கூற்று:
ஒரு தன்னிச்சை செயல் முறை நிகழும்போது, ஒரு அண்டத்தின் மொத்த என்ட்ரோபி அதிகரிக்கிறது.
கெல்வின் - பிளாங்க் கூற்று:
ஒரு சுற்றுச் செயல் முறையில், சூடான வெப்ப மூலத்திலிருந்து வெப்பத்தை உறிஞ்சி அவ்வெப்பத்தின் ஒரு பகுதியை குளிர்ந்த நிலையிலுள்ள மூலத்திற்கு மாற்றாமல், முழுவதும் வேலையாக மாற்றக்கூடிய இயந்திரத்தினை வடிவமைக்க இயலாது.
கிளாசியஸ் கூற்று:
எந்த வேலையும் செய்யாமல், குளிர்ந்த வெப்ப மூலத்திலிருந்து, சூடான வெப்ப மூலத்திற்கு, வெப்பத்தை கடத்த முடியாது.
கிப்ஸ் கட்டிலா ஆற்றல் (G):
கிப்ஸ் கட்டிலா ஆற்றல் G = H – TS என குறிப்பிடப்படுகிறது. ஒரு செயல் முறையின் கிப்ஸ் கட்டிலா ஆற்றல் மாற்றம் ΔG = ΔH - TΔS.
திட்ட கட்டிலா ஆற்றல் மாற்றம் மற்றும் சமநிலை மாறிலிகள் பின்வருமாறு தொடர்பு படுத்தப்படுகிறது.
ΔG0 = -RT ln Keq
மூன்றாம் விதி:
தனிப் பூஜ்ஜிய வெப்பநிலையில் ஒரு குறைபாடற்ற தூய படிகத்தின் என்ட்ரோபி மதிப்பு பூஜ்ஜியம்.
கருத்துவிளக்கப்படம்