அறிமுகம் | வேதியியல் - வேதிவினை, வேகவியல் | 12th Chemistry : UNIT 7 : Chemical Kinetics
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 7 : வேதிவினை, வேகவியல்
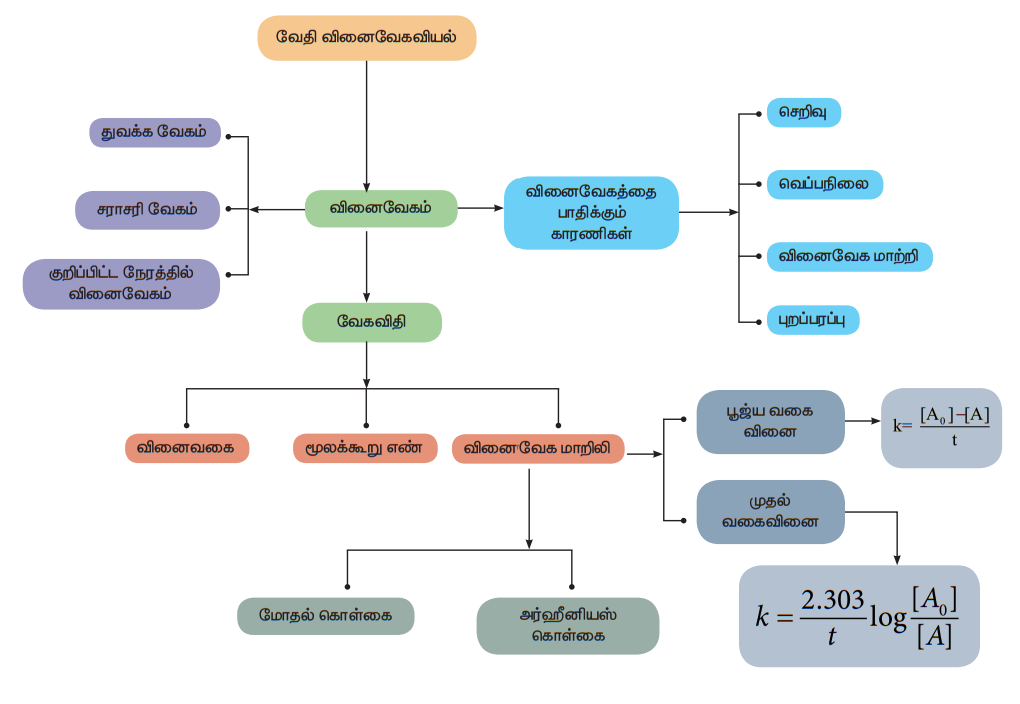
வேதிவினை, வேகவியல்
அலகு 7
வேதிவினை, வேகவியல்

ஸ்வான்டே ஆகஸ்ட் அர்ஹீனியஸ் (1859 -1927)
ஸ்வான்டே ஆகஸ்ட் அர்ஹீனியஸ், ஸ்வீடன் நாட்டைச் சார்ந்த அறிவியல் அறிஞர். வேதியியலில், இயற் வேதியியல் எனும் ஒரு தனிப்பிரிவு உருவாக காரணமாக அமைத்தவர்களுள் இவரும் ஒருவர். மின்பகுளிகளின் கடத்துத்திறன் பற்றி ஆய்வினை மேற்கொண்டு, படிக உப்புக்களை (மின்பகுளிகளை) நீரில் கரைக்கும் போது அவைகள் இணை அயனிகளாகப் பிரிகையுறுகின்றன என இவர் முன்மொழிந்தார். இக்கோட்பாட்டிற்காக 1903 ல் வேதியியலுக்கான நோபல் பரிசு இவருக்கு வழங்கப்பட்டது. இவர் அமிலம் மற்றும் காரத்திற்கான வரையறைகள் மற்றும் கிளர்வு ஆற்றல் பற்றிய கோட்பாடு ஆகியனவற்றையும் அளித்துள்ளார்.
கற்றல் நோக்கங்கள்
இப்பாடப்பகுதியைக் கற்றறிந்த பின்னர்,
* வினைவேகம் மற்றும் வினை வகையை வரையறுத்தல்
* பூஜ்ய மற்றும் முதல் வகை வினைகளுக்கான தொகைப்படுத்தப்பட்ட சமன்பாட்டினை வருவித்தல்.
* அரை வாழ் காலத்தை விவரித்தல்
மோதல் கொள்கையை விவரித்தல்
* வினைவேகமானது எவ்வாறு வெப்பநிலையினைச் சார்ந்து அமைகிறது என விவாதித்தல் மற்றும்
* வினைவேகத்தை பாதிக்கும் பல்வேறு காரணிகளை விளக்குதல் ஆகிய திறன்களை மாணவர்கள் பெற இயலும்
அறிமுகம்
வெப்ப இயக்கவியற் கொள்கைகளைப் பயன்படுத்தி, கொடுக்கப்பட்ட நிபந்தனைகளில் ஒரு வேதி வினை நிகழ சாத்தியமுள்ளதா என்பதனைக் கண்டறிய இயலும் என்பதை நாம் பதினொன்றாம் வகுப்பில் ஏற்கெனவே கற்றறிந்துள்ளோம். எனினும் ஒரு வேதிவினையானது எவ்வளவு வேகத்தில் நடைபெறும் என்ற முக்கியமான ஒரு வினாவிற்கு சரியானதொரு தீர்வினை வெப்ப இயக்கவியல் மூலம் பெற இயலாது. அனைத்து வேதி வினைகளும் நிறைவடைய சிறிது காலம் எடுத்துக் கொள்ளும் என்பதை நாம் நமது அனுபவ அறிவின் மூலம் அறிந்துள்ளோம். வேதிவினைகள், மிகக் குறுகிய கால அளவான பெம்டோ செகண்டு முதல் ஆண்டுக்கணக்கில் நிகழும் வகையில் வெவ்வேறு வினை வேகங்களைப் பெற்றிருக்கின்றன. எடுத்துக்காட்டாக, பேரியம்குளோரைடுகரைசல் மற்றும் நீர்த்த H2SO4 ஆகிய இரண்டையும் கலந்தவுடன், வெண்மை நிற BaSO4 வீழ்படிவு உடனடியாக உருவாகிறது. மாறாக இரும்பு துருப்பிடித்தல் போன்ற வினைகள் பல ஆண்டுகள் தொடர்ந்து நிகழ்கின்றன. ஒரு வேதி வினையில், (i) வேதி மாற்றம் எவ்வளவு வேகத்தில் நிகழும்? (ii) வினையின் ஆரம்ப மற்றும் இறுதி நிலைகளுக்கிடையே என்ன நிகழ்கிறது போன்ற வினாக்களுக்கான விடையினை வேதி வினைவேகவியல் (Chemical kinetics) தருகிறது. Kinetics என்ற வார்த்தை , இயக்கம் (movement) என்ற பொருள் தரும் Kinesis' என்ற கிரேக்கச் சொல்லிலிருந்து வருவிக்கப்பட்டதாகும்.
வேதி வினைவேகவியல் என்பது வெப்பநிலை, அழுத்தம், செறிவு போன்ற கொடுக்கப்பட்ட நிபந்தனைகளில் வேதிவினைகளின் வேகம் மற்றும் அவைகளின் வினை வழிமுறைகளைப் பற்றி கற்றறிவதாகும்.
வேதி வினைவேகவியலைக் கற்றறிவதன் மூலம் ஒரு வேதிவினையின் வினை வேகத்தை தீர்மானிப்பது மட்டுமன்றி தொழிற்துறையில் முக்கியத்துவம் வாய்ந்த வேதிச் செயல்முறைகள், கரிம மற்றும் கனிம தொகுப்பு வினைகள் போன்றவற்றில் அதிக விளைபொருள் பெறுவதற்குத் தகுந்த சாதகமான வினை நிகழ நிபந்தனைகளையும் தீர்மானிக்க இயலும்.
இப்பாடப்பகுதியில், ஒரு வேதி வினையின் வினைவேகம் மற்றும் வேதி வினைவேகத்தை பாதிக்கும் காரணிகள் ஆகியவற்றை நாம் கற்றறிவதுடன், வினைவேகத்திற்கான கொள்கைகள் மற்றும் வெப்பநிலையினைப் பொறுத்து ஒரு வினையின் வேகம் எவ்வாறு மாற்றம் அடைகிறது ஆகியன பற்றியும் கற்றறிய உள்ளோம்.