11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
தன்னிச்சை செயல்முறைகளுக்கான அடிப்படை விதிமுறைகள்
தன்னிச்சை செயல்முறைகளுக்கான அடிப்படை விதிமுறைகள்:
எந்த ஒரு செயல் முறையின் தன்னிச்சை தன்மையும் மூன்று வெவ்வேறு காரணிகளை பொறுத்து அமைகிறது.
● ஒரு செயல்முறையின் என்தால்பி மாற்றம் எதிர்குறி மதிப்பை பெற்றிருந்தால், அச்செயல் முறையானது வெப்பம் உமிழ் செயல்முறையாகும், மேலும் தன்னிச்சையாக நிகழலாம். (ΔH எதிர்குறி உடையது)
● ஒரு செயல்முறையின் என்ட்ரோபி மாற்றம் நேர்குறி மதிப்பை பெற்றிருந்தால், அச்செயல் முறையானது தன்னிச்சையாக நிகழலாம் (ΔS நேர்குறி உடையது)
● ஒரு வினை தன்னிச்சையாக நிகழ மேற்கூறிய இரண்டின் தொகுப்பான கட்டிலா ஆற்றல் மதிப்பு கண்டிப்பாக எதிர்குறியை பெற்றிருக்க வேண்டும். அதாவது ஒரு வினை தன்னிச்சையாக நிகழ்வதற்கு தேவையான நிபந்தனை ΔH - TΔS < 0 என்பதாகும்.
அட்டவணை 7.5 வினைகளின் தன்னிச்சை தன்மைமீது வெப்ப நிலையின் விளைவு
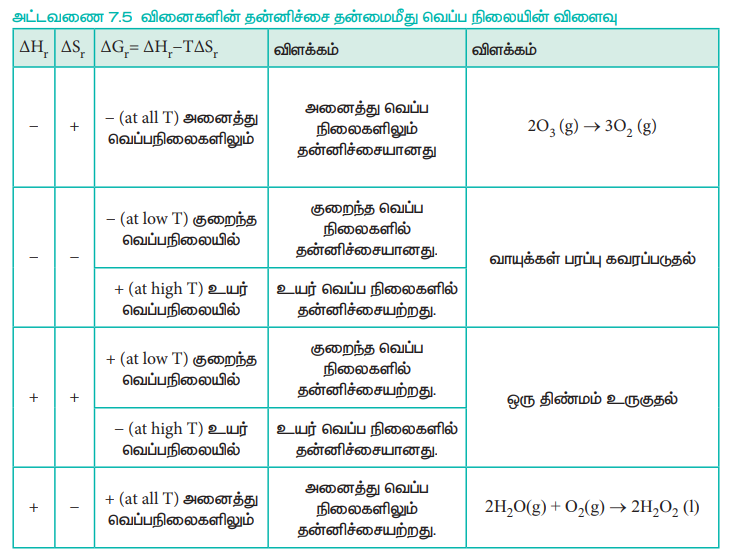
இந்த அட்டவணையானது ΔH மற்றும் ΔS ஆகியவை அனைத்து வெப்ப நிலைகளிலும், மேற் குறிப்பிட்டுள்ளவாறு இருப்பதாக கருத்திற் கொண்டுள்ளது. அவ்வாறாகவே இருக்க வேண்டும் என அவசியமில்லை. ஒரு வேதி வினையின் தன்னிச்சை தன்மையானது, மேலே குறிப்பிட்டுள்ளவாறு வினை நிகழ்வதற்கான வாய்ப்பினை மட்டும் தருகிறது. இத்தகைய செயல்முறைகளின் வேகமானது வெப்ப இயக்கவியல் கணிப்புகளுக்கு அப்பாற்பட்ட, வினை வேகவியல் காரணிகளால் (kinetic factors) தீர்மானிக்கப்படுகிறது.
கணக்கு 7.8
300K வெப்ப நிலையில், CO + (1/2) O2 → CO2 என்ற வினை தன்னிச்சையானது எனக்காட்டுக. CO2 மற்றும் CO ஆகியன உருவாவதற்கான திட்ட கட்டிலா ஆற்றல் மாற்றங்கள் முறையே -394.4 மற்றும் -137.2 kJ mole-1.
CO + (1/2) O2 → CO2
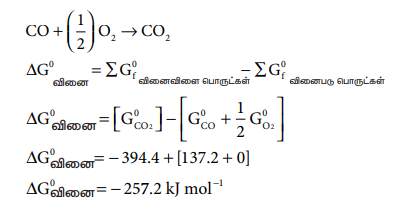
ΔG0வினை = - 394.4 + [137.2 + 0]
ΔG0வினை = - 257.2 kJ mol-1
கொடுக்கப்பட்ட வெப்பநிலையில் ΔG0வினை மதிப்பு எதிர்குறியை பெறுகிறது, எனவே வினை தன்னிச்சையாக நிகழும்.
தன்மதிப்பீடு
8) 300K வெப்ப நிலையில் ஒரு வேதி வினையின் ΔH மற்றும் ΔS மதிப்புகள் முறையே -10 kJ mole-1 மற்றும் -20 J deg-1 mole-1 எனில், வினையின் ΔG மதிப்புயாது? ΔH மற்றும் ΔS மதிப்புகள் மாறிலிகள் என கருதி 600 K வெப்ப நிலையில் வினையின் ΔG மதிப்பை கணக்கிடுக. வினையின் தன்மையை கண்டறிக.
தீர்வு:
∆H = −10kJ mol–1 = −10000 Jmol–1
∆S = 20JK–1mol–1
T = 300K
∆G = ?
∆G = ∆H − T∆S
∆G = −10kJmol–1 − 300K × (−20 × 10) –3 kJ K–1mol–1
∆G = − 4kJmol–1
At 600K
∆G = −10 – 600 × (–20 × 10−3).
∆G = − 10 + 12
∆G = +2KJmol−1
∆G எதிர்குறி மதிப்பு இருப்பதால் 300K−ல் வினை தன்னிச்சையானது.
∆G நேர்குறி மதிப்பு இருப்பதால், 600K−ல் வினை தன்னிச்சையற்றது.