உணரப்படுபவை, பயன்பாடு, வரம்புகள் | உலோகவியல் | வேதியியல் - எலிங்கம் வரைபடம் | 12th Chemistry : UNIT 1 : Metallurgy
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 1 : உலோகவியல்
எலிங்கம் வரைபடம்
1. எலிங்கம் வரைபடம்
ஒரு வினையில் ஏற்படும் கிப்ஸ் கட்டிலா ஆற்றல் (∆G) மாற்றம் பின்வரும் சமன்பாட்டால் தரப்படுகிறது.
∆G = ∆H - T∆S ------ (1)
இங்கு ∆H என்பது என்தால் மாற்றம், T என்பது கெல்வின் அலகில் வெப்பநிலை மற்றும் ∆S என்பது என்ட்ரோபி மாற்றம். ஒரு சமநிலைச் செயல்முறைக்கு ∆G° மதிப்பானது சமநிலை மாறிலியின் மதிப்பினைப் பயன்படுத்தி பின்வரும் சமன்பாட்டின் மூலம் கணக்கிடப்படுகிறது.
∆G° =-RT InKp
பல்வேறு வெப்பநிலைகளில் உலோக ஆக்சைடுகளின் ஒடுக்க வினைக்கு AG° மதிப்புகளை மேற்கண்டுள்ள சமன்பாட்டினைப் பயன்படுத்தி, அவ்வினைகளை சமநிலை செயல்முறையைக் கருதி ஹெரால்ட் எலிங்கம் கண்டறிந்தார்.
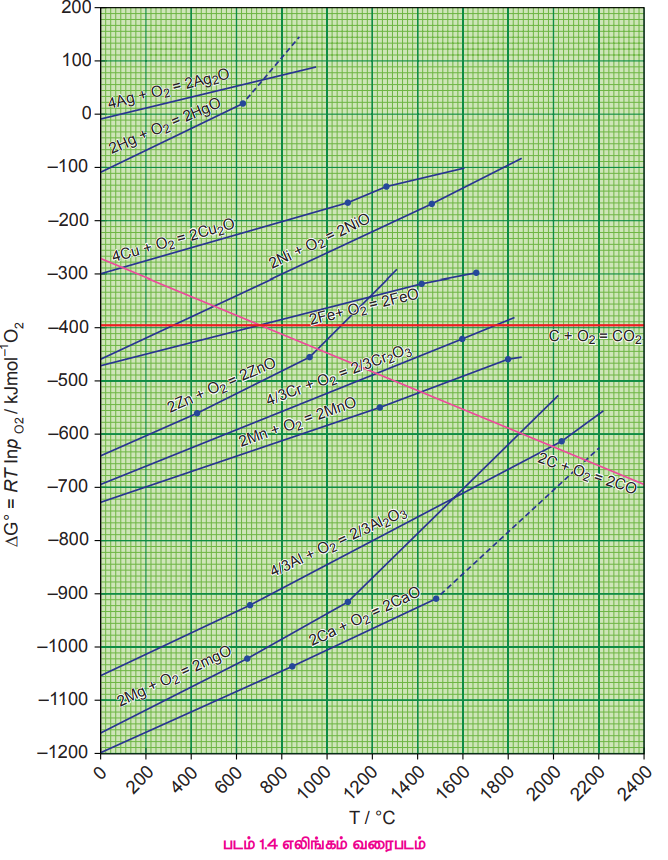
வெப்பநிலையை X அச்சிலும், உலோக ஆக்சைடுகள் உருவாகும் வினைக்கான திட்ட கட்டிலா ஆற்றல் மாற்ற மதிப்புகளை y அச்சிலும் எடுத்துக்கொண்டு அவர் ஒரு வரைபடத்தை உருவாக்கினார். உருவாகும் வரைபடம் ∆S மதிப்பை சாய்வாகவும், ∆H மதிப்பைy வெட்டுத்துண்டாகவும் உடைய நேர் கோடாகும். பல்வேறு உலோக ஆக்சைடுகள் உருவாகும் வினைக்களுக்கு, வெப்பநிலையினைப் பொருத்து, அவ்வினைகளின் திட்ட கட்டிலா ஆற்றல் மதிப்பில் ஏற்படும் மாறுபாடுகளைக் வரைபடமாகக் குறிப்பிடுவது எலிங்கம் வரைபடம் எனப்படுகிறது.
எலிங்கம் வரைபடத்திலிருந்து உற்றுநோக்கி உணரப்படுபவை
1. பெரும்பாலான உலோக ஆக்சைடுகள் உருவாகும் வினைகளுக்கு சாய்வு, நேர்குறி மதிப்புடையது. இதனை பின்வருமாறு விளக்கலாம். உலோக ஆக்சைடுகள் உருவாதலின் போது ஆக்சிஜன் வாயு பயன்படுத்தப்படுவதால் (குறைவதால்) ஒழுங்கற்றத் தன்மையில் குறைவு ஏற்படுகிறது. எனவே ∆S எதிர்குறி மதிப்பினை பெறவேண்டும். இதனால் நேர்கோட்டின் சமன்பாட்டில் உள்ள T∆S ஆனது நேர்குறி மதிப்பினைப் பெறுகிறது.
2. கார்பன் மோனாக்ஸைடு உருவாதலுக்கான வரைபடம் எதிர்குறி சாய்வுடன் கூடிய நேர்கோடாகும். இந்நேர்வில் ஒரு மோல் ஆக்சிஜன் பயன்படுத்தப்படும் போது இருமோல் கார்பன் மோனாக்சைடு வாயு உருவாகிறது எனவே ∆S நேர்குறி மதிப்புடையது இதிலிருந்து CO ஆனது அதிக வெப்பநிலையில் அதிக நிலைப்புத் தன்மை பெற்றுள்ளதை அறிய முடிகிறது.
3. வெப்பநிலை அதிகரிக்கும் போது, உலோக ஆக்சைடுகள் உருவாகும் வினைக்கான ∆G ன் மதிப்பு குறைவான எதிர்குறி மதிப்பினைப் பெறுகிறது. மேலும் ஒரு குறிப்பிட்ட வெப்பநிலையில் பூஜ்ய மதிப்பினை அடைகிறது. இவ்வெப்பநிலைக்கு கீழ் ∆G மதிப்பு எதிர்குறியுடையது மேலும் உலோக ஆக்சைடு நிலைப்புத் தன்மை உடையது. இந்த வெப்பநிலைக்கு மேல் ∆G நேர்குறி மதிப்பினைப் பெறுகிறது. பொதுவான போக்கிலிருந்து, உலோக ஆக்சைடுகள் உயர் வெப்பநிலைகளில் குறைவான நிலைப்புத் தன்மையினைப் பெற்றுள்ளன. மேலும் அவைகளை சிதைவுறுச் செய்தல் எளிதானதாக அமையும்.
4. ஒரு குறிப்பிட்ட வெப்பநிலையில், MgO, HgO போன்ற சில உலோக ஆக்சைடுகளுக்கு, ஒரு குறிப்பிட்ட வெப்பநிலையால் சாய்வில் திடீரென மாற்றம் ஏற்படுகிறது. இம்மாற்றத்திற்கு நிலைமை மாற்றமே (உருகுதல் அல்லது ஆவியாதல்) காரணமாக அமைகிறது.
எலிங்கம் வரைபடத்தின் பயன்பாடு
ஒடுக்க வினைகளுக்கு, வினை நிகழ் வெப்பநிலை எல்லைகளை தீர்மானிப்பதற்கும், தகுந்த ஒடுக்கும் காரணிகளைத் தெரிவு செய்யவும் எலிங்கம் வரைபடம் பயன்படுகிறது.
உலோக ஆக்சைடானது உலோகமாக ஒடுக்கப்படும் வினையினை ஒடுக்கத்திற்கு பயன்படுத்தப்படும் தனிமம் மற்றும் பிரித்தெடுக்கப்பட வேண்டிய உலோகம் ஆகிய இரண்டிற்கும் இடையே ஆக்சிஜனுடன் இணைந்து ஆக்சைடை உருவாக்குவதற்கான போட்டி வினையாகக் கருதலாம். உலோக ஆக்சைடானது அதிக நிலைப்புத் தன்மை உடையது எனில், ஆக்சிஜன் உலோகத்தோடு இணைந்தே இருக்கும். ஒடுக்கத்திற்கு பயன்படுத்தப்படும் தனிமத்தின் ஆக்சைடு அதிக நிலைப்புத் தன்மை உடையது எனில், உலோக ஆக்சைடில் உள்ள ஆக்சிஜன் ஒடுக்கத்திற்கு பயன்படுத்தப்படும் தனிமத்துடன் இணைகிறது. எலிங்கம் வரைபடத்திலிருந்து, ஒரு கொடுக்கப்பட்ட வெப்பநிலையில் வெவ்வேறு உலோக ஆக்சைடுகளின் ஒப்பீட்டு நிலைப்புத் தன்மையினை நாம் அறிந்து கொள்ள இயலும்.
1. Ag2O மற்றும் HgO ஆகியவை உருவாதலுக்கான எலிங்கம் வரைபடமானது, படம் 1.4 ல் காட்டியுள்ளவாறு வரைபடத்தின் மேற்பகுதியில் அமைந்துள்ளது. அவைகளின் சிதைவுறு வெப்பநிலைகள் முறையே 600K மற்றும் 700K ஆகும். இதிலிருந்து இந்த ஆக்சைடுகள் மிதமான வெப்பநிலைகளில் நிலைப்புத் தன்மை அற்றவைகளாக உள்ளன. மேலும் எவ்வித ஒடுக்க காரணிகளையும் பயன்படுத்தாமல் வெப்பப்படுத்துவதன் மூலமாக இவைகளைச் சிதைவுறச் செய்ய இயலும்.
2. எலிங்கம் வரைபடத்தினைப் பயன்படுத்தி ஒரு உலோகத்தின் ஆக்சைடை மற்றொரு உலோகத்தால் ஒடுக்கம் செய்வதற்கான வெப்ப இயக்கவியல் சாத்தியத்தன்மையினைத் தீர்மானிக்க இயலும். எந்த ஒரு உலோகமும், எலிங்கம் வரைபடத்தில் அவ்வுலோகத்திற்கு மேற்புறம் எலிங்கம் வரைகோடுகளைப் பெற்றுள்ள உலோக ஆக்சைடுகளை ஒடுக்க இயலும். எடுத்துக்காட்டாக, எலிங்கம் வரைபடத்தில், குரோமியம் ஆக்சைடு உருவாதலுக்கான எலிங்கம் வரைகோடு அலுமினியத்திற்கு மேல் இடம் பெற்றுள்ளது. இதிலிருந்து A12O3 ஆனது Cr2O3 ஐ விட அதிக நிலைப்புத் தன்மை உடையது என அறிய முடிகிறது. எனவே குரோமிக் ஆக்சைடை ஒடுக்கமடையச் செய்வதற்கு அலுமினியத்தை ஒடுக்கும் காரணியாகப் பயன்படுத்த இயலும். எனினும் அலுமினியம் ஆக்சைடிற்கு கீழ்புறத்தில் எலிங்கம் வரைகோட்டினைப் பெற்றுள்ள மெக்னீசியம் மற்றும் கால்சியம் போன்றவற்றின் ஆக்சைடுகளை ஒடுக்க, அலுமினியத்தைப் பயன்படுத்த இயலாது.
3. கார்பனின் நேர்கோடானது பெரும்பாலான உலோக ஆக்சைடுகளின் நேர்கோடுகளை வெட்டுகிறது. எனவே அத்தகைய அனைத்து ஆக்சைடுகளையும் போதுமான அதிக வெப்பநிலையில் கார்பனால் ஒடுக்க இயலும். இரும்பு (II) ஆக்சைடைக் கார்பனைக் கொண்டு ஒடுக்கமடையச் செய்வதற்கு சாதகமான வெப்ப இயக்கவியல் நிபந்தனைகளை நாம் பகுத்தறிவோம். FeO மற்றும் CO உருவாவதற்கான நேர்கோடுகள் சுமார் 1000k வெப்பநிலையில் வெட்டுகின்றன. இவ்வெப்பநிலைக்கு கீழ் கார்பன் நேர்கோடானது இரும்பின் நேர்கோட்டிற்கு மேல் உள்ளது. இதிலிருந்து இவ்வெப்பநிலைக்கு கீழ் FeO ஆனது CO வைக் காட்டிலும் அதிக நிலைப்புத் தன்மை உடையது என அறிய முடிகிறது. எனவே, இவ்வெப்பநிலை எல்லையில் ஒடுக்க வினையானது வெப்ப இயக்கவியல் கொள்கைப்படி சாத்தியமானதல்ல. எனினும் 1000K வெப்பநிலைக்கு மேல், கார்பன் நேர்கோடானது இரும்பின் நேர்கோட்டிற்கு கீழ்புறமாக அமைகிறது எனவே, இவ்வெப்பநிலைக்கு மேல் நாம் கார்பனை ஒடுக்கும் காரணியாக பயன்படுத்தலாம். எலிங்கம் வரைபடத்திலிருந்து பெறப்படும் விவரங்களின் அடிப்படையிலான பின்வரும் கட்டிலா ஆற்றல் மாற்றத்தைக் கண்டறியும் கணக்கீடுகளும் இதனை உறுதிப்படுத்துகின்றன. 1500 K வெப்பநிலையில், எலிங்கம் வரைபடத்திலிருந்து.
2Fe (s) + O2 (g) → 2FeO (g) ∆G1 =-350 kJ mol-1 ------ (1)
2C (s) + O2 (g) → 2CO (g) ∆G2 =-480 kJ mol-1 -------(2)
(1) வது சமன்பாட்டை திருப்பி எழுதுக.
2FeO (s) → 2Fe (s)+ O2 (g) - ∆G1 = +350 kJ mol-1 ------ (3)
சமன்பாடு (2) மற்றும் (3) ஐ இணைக்க
2FeO (s) + 2C → 2Fe (1,s)+ 2CO (g) ∆G3 = -130 kJ mol-1 ------ (4)
எனவே ஒரு மோல் FeO ஒடுக்கப்படுவதற்கான கட்டிலா ஆற்றல் மாற்றம் ஆனது ∆G3/2 =-65 kj mol-1
எலிங்கம் வரைபடத்தின் வரம்புகள்
1. எலிங்கம் வரைபடம் வெப்ப இயக்கவியல் கொள்கைகளை மட்டுமே கருத்திற்கொண்டு உருவாக்கப்பட்டதாகும். இது ஒரு வினை நிகழ்வதற்கான வெப்ப இயக்கவியல் சாத்தியத் தன்மை குறித்த தகவலை மட்டுமே தருகிறது. இது ஒரு வினை எவ்வளவு வேகத்தில் நிகழும் என்ற விவரத்தினை தருவதில்லை. மேலும் துணை வினைகள் நிகழ்வதற்கான சாத்தியங்களை பற்றி எந்த ஒரு விவரத்தினையும் தருவதில்லை .
2. வினைபடுபொருட்களின், வினைவிளைபொருளுடன் வேதிச் சமநிலையில் இருப்பதாக கருதி ∆G எலிங்கம் வரைபடத்தில் விளக்கப்பட்டுள்ளது. ஆனால் இது எல்லா நிபந்தனைகளும் உண்மையல்ல.
தன் மதிப்பீடு
3. எலிங்கம் வரைபடத்தைப் பயன்படுத்தி (படம் 1.4) ZnO ஐ Zn ஆக கார்பனைக் கொண்டு ஒடுக்குவதற்கான குறைந்தபட்ச வெப்பநிலையைக் கண்டறிக. இவ்வெப்பநிலையில் நிகழும் ஒட்டுமொத்த வினையினை எழுதுக.