உலோகவியல் | வேதியியல் - பண்படா உலோகத்தை பிரித்தெடுத்தல் | 12th Chemistry : UNIT 1 : Metallurgy
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 1 : உலோகவியல்
பண்படா உலோகத்தை பிரித்தெடுத்தல்
பண்படா உலோகத்தை பிரித்தெடுத்தல்
அடர்பிக்கப்பட்ட தாதுவிலிருந்து, பண்படா உலோகத்தினைப் பிரித்தெடுத்தலில் பின்வரும் இரு படி நிலைகள் உள்ளன. அவையானவன
i. தாதுவை, தேவைப்படும் உலோகத்தின் ஆக்சைடாக மாற்றுதல்
ii. உலோக ஆக்சைடை தனிம உலோகமாக ஒடுக்குதல்.
அடர்பிக்கப்பட்ட தாதுவில், உலோகமானது நேர் ஆக்சிஜனேற்ற நிலையில் காணப்படுகிறது. எனவே இதனை தனிமநிலைக்கு ஒடுக்கமடையச் செய்ய வேண்டும். வெப்ப இயக்கவியல் தத்துவங்களின் அடிப்படையில் மற்ற உலோக சேர்மங்களுடன் ஒப்பிடும் போது, உலோக ஆக்சைடுகளை ஒடுக்குதல் எளிதானது என நம்மால் அறிந்துகொள்ள முடியும் எனவே ஒடுக்கமடையச் செய்யும் முன்னர் தாதுவானது தேவைப்படும் உலோகத்தின் ஆக்சைடாக முதலில் மாற்றப்படுகிறது. அடர்பிக்கப்பட்ட தாதுவை தேவைப்படும் உலோகத்தின் ஆக்சைடாக மாற்ற பயன்படுத்தப்படும் சில பொதுவான முறைகளை நாம் விவாதிப்போம்.
1. தாதுக்களை ஆக்சைடுகளாக மாற்றுதல்
வறுத்தல்
சல்பைடு தாதுக்களை ஆக்சைடுகளாக மாற்ற பயன்படும் வழக்கமானதொரு முறை வறுத்தல் செயல்முறை ஆகும். இம்முறையில் அடர்பிக்கப்பட்ட தாதுவானது தகுந்த உலையில் எடுத்துக் கொள்ளப்பட்டு உலோகத்தின் உருகுநிலையை விட குறைவான வெப்பநிலையில் அதிக அளவு ஆக்சிஜன் செலுத்தப்பட்டு ஆக்சினேற்றம் அடையச் செய்யப்படுகிறது.
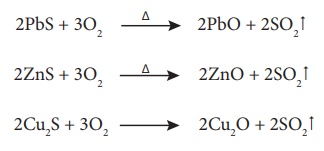
வறுத்தலினால் ஆர்சனிக், சல்பர், பாஸ்பரஸ் போன்றவை அவைகளின் எளிதில் ஆவியாகும் ஆக்ஸைடுகளாக மாற்றப்பட்டு வெளியேற்றப்படுகின்றன.
எடுத்துக்காட்டாக
4As + 3O2 → 2As2O3 ↑
S8 + 8O2 → 8SO2 ↑
P4 + 5O2 → P4O10 ↑
வறுத்தலின் போது உருவாகும் சல்பர்டைஆக்சைடானது சுற்றுச்சூழலுக்கு உகந்ததன்று. நவீன உலோகவியல் தொழிற்சாலைகளில், இந்த துணை விளைபொருள் சேர்க்கப்பட்டு கந்தக அமிலமாக மாற்றப்படுவதன் மூலம் காற்று மாசுபடுதல் தவிர்க்கப்படுகிறது.
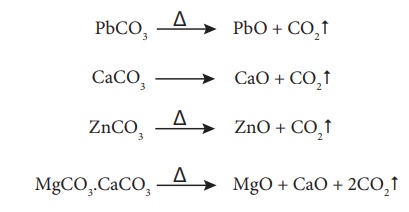
காற்றில்லாச் சூழலில் வறுத்தல்
இம்முறையில் காற்றில்லா சூழலில், அடர்பிக்கப்பட்ட தாதுவானது வன்மையாக வெப்பப்படுத்தப்படுகிறது. இந்நிகழ்வின் போது, நீரேற்றம் பெற்ற ஹைட்ராக்சைடுகளில் காணப்படும் படிக நீரானது ஆவியாக வெளியேறுகிறது. கரிம சேர்மங்கள் ஏதேனும் இருப்பின் அவைகளும் வெளியேறுகின்றன. இதன் விளைவாக நுண்துளைகள் காணப்படும் தாது கிடைகிறது. கட்டுப்படுத்தப்பட்ட அளவிளான காற்றினை செலுத்தியும் இம்முறையில் தாதுக்களை வறுக்கலாம்.
எடுத்துக்காட்டாக,
கார்பனேட் தாதுக்களை காற்றில்லாச் சூழலில் வறுக்கும் போது கார்பன் டை ஆக்சைடு வெளியேறுகிறது.
படிக நீரைக் கொண்டுள்ள, தாதுக்களிலிருந்து நீரானது நீராவியாக வெளியேற்றப்படுகிறது.
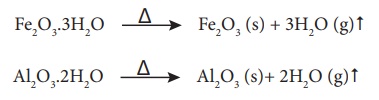
தன்மதிப்பீடு
மேக்னசைட்டை (மெக்னீசியம் கார்பனேட்) காற்றில்லாச் சூழலில் வறுக்கும் போது மெக்னீசியா பெறப்படுகிறது. இந்நேர்வில் சிதைவடையும் வினைக்கான சமன்பாட்டினைத் தருக.
2. உலோக ஆக்ஸைடுகளை ஒடுக்குதல்
கார்பன், கார்பன்மோனாக்சைடு, ஹைட்ரஜன், அலுமினியம் மற்றும் இதர வினைத்திறன் மிக்க உலோகங்களான சோடியம் போன்ற ஒடுக்கும் காரணிகளைக் கொண்டு உலோக ஆக்ஸைடுகளை உலோகமாக ஒடுக்கலாம். உலோகத்தின் இயல்பினைப் பொறுத்து, ஒடுக்கும் காரணி தெரிவு செய்யப்படுகிறது. எடுத்துக்காட்டாக சோடியம், பொட்டாசியம், அலுமினியம் போன்ற அதிக வினைத்திறன் உடைய உலோகங்களுக்கு கார்பனை ஒடுக்கும் காரணியாகப் பயன்படுத்த இயலாது. இதைப்போலவே ZnO, A12O3 போன்ற ஆக்ஸைடுகளை ஒடுக்க CO வை பயன்படுத்த இயலாது.
இப்பாடப்பகுதியின் இறுதியில் எலிங்கம் வரைபடத்தினைப் பயன்படுத்தி தகுந்த ஒடுக்கும் காரணிகளை தெரிவு செய்வது பற்றி கற்றறிய உள்ளோம்.
உருக்குதல்
இம்முறையில், கனிமக் கழிவுடன் சேர்ந்து எளிதில் உருகும் கசடினை உருவாக்கக்கூடிய வேதிச் சேர்மமான இளக்கி மற்றும் கார்பன், கார்பன் மோனாக்ஸைடு (அல்லது) அலுமினியம் போன்ற தகுந்த ஒடுக்கும் காரணிகள் அடர்பிக்கப்பட்ட தாதுவுடன் சேர்த்து உருக்கப்படுகிறது. உலோகத்தின் உருகுநிலையை விட அதிக வெப்பநிலையில், மேற்கண்டுள்ள கலவையானது ஒரு உருக்கு உலையில் உருக்கப்படுகிறது. எடுத்துக்காட்டாக இரும்பு ஆக்சைடானது கார்பன் மோனாக்சைடால் பின்வருமாறு ஒடுக்கப்படுகிறது.
Fe2 O3 (s) + 3CO (g) → 2Fe(s) + 3CO2 (g)↑
மேற்கண்டுள்ள பிரித்தெடுத்தலில், ஒரு காரத்தன்மை உடைய இளக்கியான சுண்ணாம்புக்கல் (CaO) பயன்படுத்தப்படுகிறது. இத்தாதுவில் காணப்படும் சிலிக்கா கனிமக் கழிவானது அமிலத் தன்மையை பெற்றிருப்பதால், சுண்ணாம்புக்கல் அதனுடன் இணைந்து கால்சியம் சிலிக்கேட் எனும் கனிமக் கசடினைத் தருகிறது.

CaO (s) + SiO2 (s) → CaSiO3 (s)
இளக்கி கனிமக்கழிவு கனிமக்கசடு
காப்பர் பைரைட்டிலிருந்து காப்பரை பிரித்தெடுக்கும் செயல்முறையில் அடர்பிக்கப்பட்ட தாதுவானது, அமிலத் தன்மையுடைய இளக்கியான சிலிகாவுடன் கலக்கப்பட்டு எதிர் அனல் உலையில் வெப்பப்படுத்தப்படுகிறது. உருக்குதலால் உருவாகும் பெர்ரஸ் ஆக்சைடானது காரத்தன்மையினைப் பெற்றிருப்பதால் அது சிலிக்காவுடன் இணைந்து பெர்ரஸ் சிலிக்கேட் கனிமக் கழிவினைத் தருகிறது. எஞ்சியுள்ள உலோக சல்பைடுகளான Cu,S மற்றும் Fes ஆகியன ஒன்றில் ஒன்று கரைவதால் காப்பர் மட்டி உருவாகிறது.
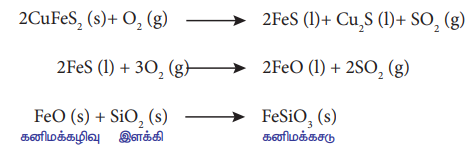
2CuFeS2 (s)+ O2 (g) → 2FeS (I)+ Cu2S (1)+ SO2 (g)
2FeS (1) + 3O2 (g) → 2FeO (I) + 2SO2 (g)
FeO (s) + SiO2 (s) → FeSiO3 (s)
கனிமக்கழிவு இளக்கி கனிமக்கசடு
கனிமக் கழிவிலிருந்து காப்பர் மட்டி பிரித்தெடுக்கப்பட்டு மாற்று உலையில் இடப்படுகிறது. மாற்ற வினைகளின் போது மட்டியில் காணப்படும் FeS முதலில் FeO ஆக ஆக்சிஜனேற்றமடைகிறது. சிலிக்காவை பயன்படுத்தி கனிமக் கழிவாக மாற்றப்பட்டு இது நீக்கப்படுகிறது. எஞ்சியுள்ள காப்பர் சல்பைடானது மேலும் ஆக்சிஜனேற்றத்திற்கு உட்படுத்தப்பட்டு அதன் ஆக்சைடாக மாற்றப்படுகிறது. பின்னர் இது உலோக காப்பராக கீழ்க்கண்டுள்ளவாறு மாற்றப்படுகிறது.
2Cu 2 S ( l ,s) + 3O 2 (g) → 2Cu 2 O ( l ,s) + 2SO 2 (g)
2Cu 2 O ( l ) + Cu 2 S ( l ) → 6Cu ( l ) + SO 2 (g)
உலோக காப்பரானது திண்மமாக்கப்படுகிறது. இதிலிருந்து SO2 வாயு வெளியேறுவதால் அதன் தோற்ற அமைப்பில் கொப்புளங்கள் போல் காணப்படுகிறது. இந்த காப்பரானது கொப்புளக் காப்பர் (blistered copper) என அழைக்கப்படுகிறது.
கார்பனைக் கொண்டு ஒடுக்குதல்
இம்முறையில் உலோகத்தின் ஆக்சைடுதாதுவானது கரியுடன் நன்கு கலக்கப்பட்டு, வழக்கமாக ஊது உலையில் வன்மையாக வெப்பப்படுத்தப்படுகிறது. ஒடுக்க வெப்பநிலையில் கார்பனுடன் சேர்ந்து உலோக கார்பைடுகளை உருவாக்காத உலோகங்களுக்கு பயன்படுத்தப்படுகிறது.
எடுத்துக்காட்டாக
ZnO (s)+ C (s) → Zn (s) + CO (g)↑
Mn3O4 (s) + 4C (s) → 3Mn (s) + 4CO (g)↑
Cr2O3 (s) + 3C (s) → 2Cr (s) + 3CO (g)↑
ஹைட்ரஜனைக் கொண்டு ஒடுக்குதல்
Fe, Pb, Cu போன்ற ஹைட்ரஜனைக்காட்டிலும் குறைவான எலக்ரோ நேர்மின் தன்மை உடைய உலோக ஆக்ஸைடுகளுக்கு இம்முறை பயன்படுத்தப்படுகிறது.
Ag2O (s)+ H2 (g) → 2Ag (s) + H2O (I)
Fe3O4 (s) + 4H2 (g) --- 3Fe (s) + 4H2O (I)
நீர்வாயுவைக் (கார்பன் மோனாக்சைடு மற்றும் ஹைட்ரஜன் கலவை) கொண்டு நிக்கல் ஆக்சைடு ஒடுக்கப்படுகிறது.
2NiO (s) + CO (g) + H2 (g) → 2Ni (s) + CO2 (g) + H2O (I)
உலோகத்தைப் பயன்படுத்தி ஒடுக்குதல்
Cr2O3 போன்ற உலோக ஆக்சைடுகளை அலுமினோ வெப்ப ஒடுக்க முறையினைப் பயன்படுத்தி ஒடுக்கலாம். இம்முறையில் உலோக ஆக்சைடானது அலுமினியத் தூளுடன் கலக்கப்பட்டு, சுட்டக் களிமண்ணால் ஆன புடக்கலனில் எடுத்துக்கொள்ளப்படுகிறது. எரியூட்டும் செயல்முறையை துவக்கி வைக்க எரியூட்டுக் கலவையாக மெக்னீசியம் மற்றும் பேரியம் பெர்ராக்ஸைடு கலவை பயன்படுத்தப்படுகிறது.
BaO2 + Mg → BaO + MgO
மேற்கண்டுள்ள வினை நிகழும் போது, அதிக அளவு வெப்பம் வெளியிடப்படுகிறது. (2400°C அளவில் வெப்பநிலை மற்றும் 852 KJ mol-1 வினை என்தால்பி) இதன் விளைவாக அலுமினியத்தூளால் Cr2O3 ஒடுக்கமடைதல் நிகழ்கிறது.
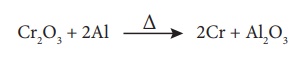
சோடியம், பொட்டாசியம், கால்சியம் போன்ற வினைத்திறன் மிக்க உலோகங்களும், உலோக ஆக்சைடுகளை உலோகமாக ஒடுக்கப் பயன்படுகிறது.
B2O3 + 6Na → 2B + 3Na2O
Rb2O3 + 3Mg → 2Rb + 3MgO
TiO2 + 2Mg → Ti + 2MgO

சுய ஒடுக்கம்
சில தாதுக்களை சாதாரணமாக வறுக்கும் போது அவைகள் பண்படா உலோகத்தைத் தருகின்றன. இத்தகைய நேர்வுகளில் தனியே ஒடுக்கும் காரணி தேவையில்லை. எடுத்துக்காட்டாக, சின்னபார் (HgS) தாதுவை வறுக்கும் போது மெர்குரி கிடைக்கிறது.
HgS (s) + O2 (g) → Hg (1) + SO2 ↑