வேதியியல் - உலோகவியல் : பாடச்சுருக்கம் | 12th Chemistry : UNIT 1 : Metallurgy
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 1 : உலோகவியல்
உலோகவியல் : பாடச்சுருக்கம்
பாடச்சுருக்கம்
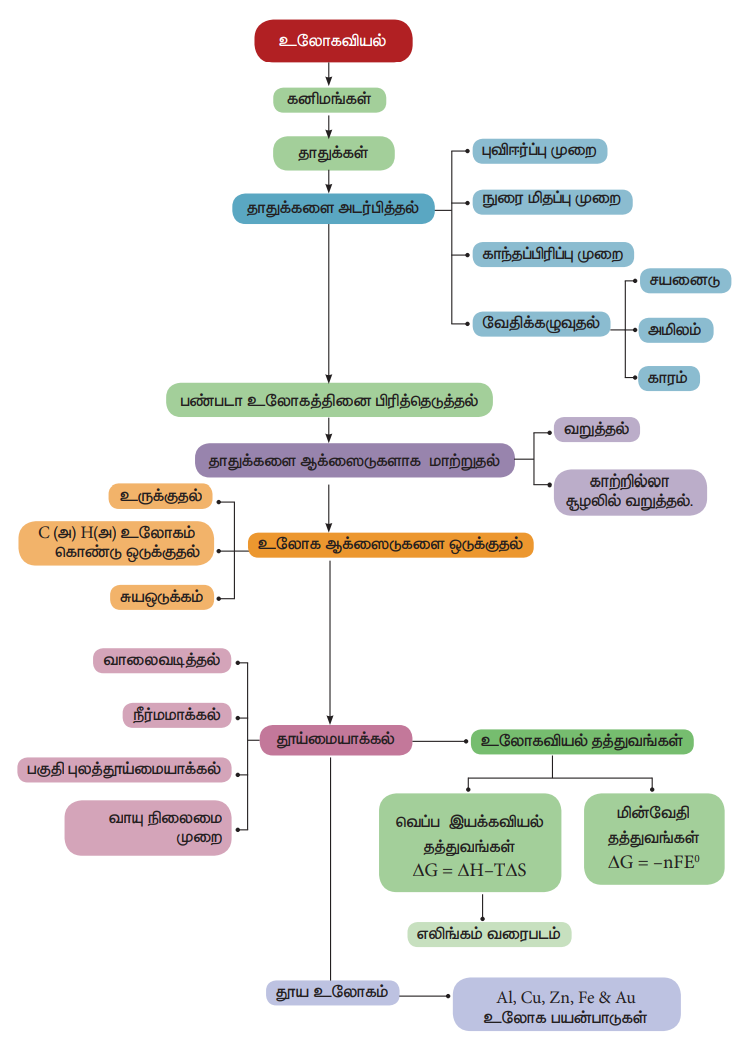
* உலோகங்களின் அறிவியல் மற்றும் தொழில்நுட்பத்தோடுத் தொடர்புடையது உலோகவியல் ஆகும்.
* இயற்கையில் காணப்படும் அகழ்ந்து எடுக்கப்பட்ட ஒரு பொருளானது ஒரு உலோகத்தை அதன் தனித்த நிலையிலேயோ அல்லது அதன் ஆக்சைடு, சல்பைடு போன்ற சேர்ம நிலைகளிலோக் கொண்டிருப்பின் அந்தப் பொருள் கனிமம் எனப்படும்.
* அதிக சதவீதத்தில் உலோகத்தினைப் பெற்றுள்ள கனிமங்களிலிருந்து எளிதாகவும், பொருளாதார ரீதியாக சிக்கனமாகவும், உலோகங்களைப் பிரித்தெடுக்க இயலுமாயின் அத்தகைய கனிமங்கள் தாதுக்கள் என அழைக்கப்படுகின்றன.
* ஒரு தேவைப்படும் உலோகத்தினை அதன் தாதுவிலிருந்துப் பிரித்தெடுத்தலானது பின்வரும் உலோகவியல் செயல்முறைகளை உள்ளடக்கியது.
(i) தாதுக்களை அடர்பித்தல்
(ii) பண்படா உலோகத்தைப் பிரித்தெடுத்தல்
(iii) பண்படா உலோகத்தைத் தூய்மையாக்கல்
* அடர்பிக்கப்பட்ட தாதுவிலிருந்து, பண்படா உலோகத்தினைப் பிரித்தெடுத்தலில் பின்வரும் இரு படி நிலைகள் உள்ளன. அவையானவன
i. தாதுவை, தேவைப்படும் உலோகத்தின் ஆக்சைடாக மாற்றுதல்
ii. உலோக ஆக்சைடை தனிம உலோகமாக ஒடுக்குதல்.
* வெப்பநிலையினைப் பொருத்து, அவ்வினைகளின் திட்ட கட்டிலா ஆற்றல் மதிப்பில் ஏற்படும் மாறுபாடுகளைக் வரைபடமாகக் குறிப்பிடுவது எலிங்கம் வரைபடம் எனப்படுகிறது.
* வெப்ப இயக்கவியல் தத்துவங்களைப் போலவே உலோகவியலில் மின்வேதித்தத்துவங்களும் பயன்படுகின்றன.
* E° ஆனது நேர்குறியுடையது எனில், ∆G ஆனது எதிர்குறியைப் பெறும் மேலும் ஒடுக்க வினை தன்னிச்சையாக நிகழும் எனவே ஒட்டு மொத்த வினையின் நிகர மின்னழுத்தம் நேர்குறி மதிப்பைப் பெறுமாறு ஒடுக்க வினை திட்டமிடப்படுகிறது. அதிக வினைத்திறன் கொண்ட உலோகமானது, ஒப்பீட்டு அளவில் குறைவான வினைத்திறன் கொண்ட உலோக அயனிகளைக் கொண்டுள்ள கரைசலில் சேர்க்கப்படும் போது, அதிக வினைத்திறன் கொண்ட உலோகம் கரைசலுக்குள் செல்கிறது.
* ஒரு உலோகம் அதன் தாதுவிலிருந்து பிரித்தெடுக்கப்படும் போது பொதுவாக வினைபுரியாத ஆக்சைடுகள், பிற உலோகங்கள், அலோகங்கள் போன்ற மாசுக்கள் அதில் காணப்படலாம். இத்தகைய மாசுக்களைப், பண்படா உலோகத்திலிருந்து பிரித்தெடுத்தல் தூய்மையாக்கும் செயல் முறைகள் எனப்படுகிறது.