நிகழ்வு, இயற்பியல் மற்றும் வேதியியல் பண்புகள், பயன்கள் - ஆக்சிஜன் | 8th Science : Chapter 11 : Air
8 ஆம் வகுப்பு அறிவியல் : அலகு 11 : காற்று
ஆக்சிஜன்
ஆக்சிஜன்
உலகில் வாழ்கின்ற அவற்றின் உயிரினங்கள் அனைத்திற்கும் ஆக்சிஜன்
தேவை. ஆக்சிஜன் இல்லாத உலகத்தை நம்மால் நினைத்துக்கூட பார்க்க இயலாது. 1772ஆம் ஆண்டு
ஸ்வீடன் நாட்டைச் சேர்ந்த வேதியியலாளர் C.W.ஷீலே ஆக்சிஜனைக் கண்டறிந்தார். இது எரிதலுக்குத்
துணை புரிந்ததால் இதனை நெருப்புக்காற்று என்றும், அத்தியாவசியமான உயிர் என்றும் அவர்
அழைத்தார். அதே நேரத்தில் பிரிட்டன் அறிவியலாளர் ஜோசப் பிரிஸ்ட்லி என்பவரும் 1774ஆம்
ஆண்டு தனது தனிப்பட்ட முயற்சியால் ஆக்சிஜனைக் கண்டறிந்தார். லவாய்சியர் எனும் அறிவியலாளர்
இதற்கு ஆக்சிஜன் என்று பெயரிட்டார். கிரேக்கமொழியில் ஆக்சிஜன்ஸ் என்றால் அமில உருவாக்கி'
என்று பொருள் முற்கால வேதியியலாளர்கள் அமிலம் தயாரிக்க ஆக்சிஜன் அவசியம் எனக் கருதியதால்
ஆக்சிஜனுக்கு இப்பெயர் சூட்டப்பட்டது.
1. ஆக்சிஜன்
பரவல்
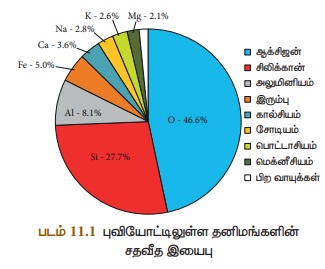
பூமியில் அதிகளவு கிடைக்கக்கூடிய வாயுக்களுள் ஆக்சிஜனும் ஒன்று.
ஹைட்ரஜன் மற்றும் ஹீலியத்திற்கு அடுத்தபடியாக அண்டத்தில் பரவலாக மூன்றாவதாகக் காணப்படும்
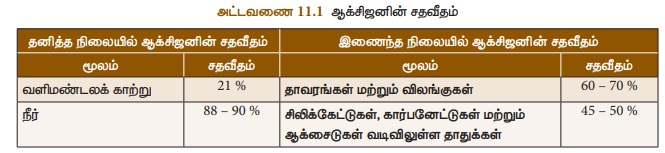
தனிமம் ஆக்சிஜன், ஆக்சிஜனானது தனித்த நிலையிலும், இணைந்த நிலையிலும் கிடைக்கிறது. வளிமண்டலத்தில்
தனித்த நிலையில் ஈரணு வாயு மூலக்கூறாக இது உள்ளது. தாவரங்கள், குளோரோபில் மற்றும் சூரிய
ஒளியைப் பயன்படுத்தி குளுக்கோஸ் தயாரிக்கும் ஒளிச்சேர்க்கை எனும் நிகழ்வின் போதும்
அதிகப்படியான ஆக்சிஜன் வெளியிடப்படுகிறது.
6CO2 + 6H2 O + சூரியனிலிருந்து பெறப்படும்
ஆற்றல் -> C6H12O6+6O2
இணைந்த நிலையில் ஆக்சிஜனானது பூமியின் மேலோட்டில் சிலிக்கேட்டுகளாகவும்,
உலோக ஆக்சைடுகளாகவும் உள்ளது. பூமியின் மேற்பரப்பில் உள்ளநீரிலும் ஆக்சிஜன் உள்ளது.வளிமண்டலத்தின்
மேல் அடுக்குகளில் ஆக்சிஜன் ஓசோன் எனப்படும் மூவணு மூலக்கூறாக (O;) உள்ளது.
2. ஆக்சிஜனின்
இயற்பியல் பண்புகள்
• ஆக்சிஜன் நிறமற்ற, மணமற்ற, சுவையற்ற வாயு.
• வெப்பம்மற்றும் மின்சாரத்தை எளிதில் கடத்தாது.
• ஆக்சிஜன் குளிர்ந்த நீரில் உடனடியாகக் கரையும்.
• காற்றை விட கனமானது.
ஆக்சிஜனானது
நைட்ரஜனைவிட இருமடங்கு நீரில் அதிகமாகக் கரையும் தன்மை உடையது. நைட்ரஜனின் கரைதிறனையே
ஆக்சிஜனும் கொண்டிருக்குமானால், கடல், ஆறு, ஏரி போன்ற நீர் நிலைகளில் வாழும் உயிரினங்களுக்கு
உயிர் வாழ்தல் மிகவும் கடினமான செயலாக இருக்கும்.
• அதிக அழுத்தம் மற்றும் குறைந்த வெப்ப நிலைக்கு உட்படுத்தப்படும்போது
திரவமாகிறது.
• இது எரிதலுக்குத் துணைபுரிகிறது.
3. ஆக்சிஜனின்
வேதிப்பண்புகள்
1. எரிதல்
ஆக்சிஜன் தனித்து எரியும் தன்மை அற்றது. ஆனால், இது பிற பொருள்களின்
எரிதலுக்குத் துணை புரியும்.
ஆக்சிஜனுக்கு
தானாகவே தீப்பற்றி எரியும் தன்மை இருந்தால் நமது வளிமண்டலத்திலுள்ள ஆக்சிஜன் முழுவதும்
எரிய ஒரு தீக்குச்சி மட்டுமே போதுமானதாக இருக்கும்.
சோடியம், பொட்டாசியம்
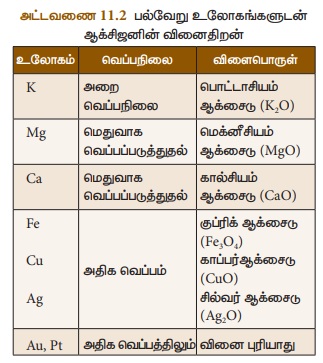
2. உலோகங்களுடன் வினை
, மெக்னீசியம், அலுமினியம் மற்றும் இரும்பு போன்ற உலோகங்களுடன்
ஆக்சிஜன் வினைபுரிந்து அவற்றின் உலோக ஆக்சைடுகளைத் தருகிறது. இவை பொதுவாக காரத்தன்மை
உடையவை. ஆனால் இவை ஒவ்வொன்றும் ஆக்சிஜனுடன் வேறுபட்ட வினைதிறனுடன் செயல்புரிகின்றன.
உலோகம் + ஆக்சிஜன் -> உலோக ஆக்சைடு
உதாரணம்
4Na + O2 -> 2Na2O
சோடியம் ஆக்சிஜன் சோடியம் ஆக்சைடு
செயல்பாடு 1
ஒரு
மெக்னீசிய நாடாவை அது தீப்பற்றும் வரை தீச்சுடரில் வெப்பப்படுத்தவும். பிறகு எரியும்
அந்த நாடாவை ஆக்சிஜன் உள்ள குடுவையில் காட்டவும். பிரகாசமான ஒளியுடன் அந்த நாடா எரிவதுடன்
வெண்மையான மெக்னீசியம் ஆக்சைடு சாம்பலாகக் கிடைக்கிறது.
3. அலோகங்களுடன் வினை
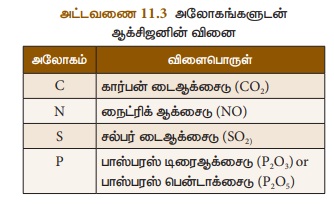
ஹைட்ரஜன், நைட்ரஜன், கார்பன், சல்பர், பாஸ்பரஸ் போன்ற அலோகங்களுடன்
ஆக்சிஜன் வினைபுரிந்து அமிலத்தன்மை வாய்ந்த அலோக ஆக்சைடுகளை உருவாக்குகின்றது.
அலோகம் + ஆக்சிஜன் -> அலோக ஆக்சைடு
செயல்பாடு
2
சிறிதளவு
பாஸ்பரஸ் துண்டினை வெப்பப்படுத்தி ஆக்சிஜனுள்ள நுழைக்கவும். மூச்சடைக்கும் அதனை குடுவையினுள்
பாஸ்பரஸ் வாசனையுடன் எரிந்து பாஸ்பரஸ் பென்டாக்சைடு (வெண்புகை வெளிவருகிறது.

4. ஹைட்ரோ கார்பன்களுடன் வினை
ஆக்சிஜன் ஹைட்ரோகார்பன்களுடன் (கார்பனையும், ஹைட்ரஜனையும் கொண்டுள்ள
சேர்மங்கள்) வினைபுரிந்து கார்பன் டைஆக்சைடையும், நீராவியையும் தருகிறது எடுத்துக்காட்டாக
மரம், பெட்ரோல், டீசல், சமையல் எரிவாயு போன்றவை ஹைட்ரோ கார்பன்களின் கலவையாகும். இவை
ஆக்சிஜனுடன் எரியும்பொழுது வெப்பம் மற்றும் ஒளி ஆற்றலை உருவாக்குவதால் எரிபொருள்களாகப்
பயன்படுகின்றன.
ஹைட்ரோகார்பன் + O2 -> CO2 + நீராவி + வெப்ப + ஒளி ஆற்றல்
5. துருப்பிடித்தல்
காற்று மற்றும் ஈரப்பதத்தின் முன்னிலையில் இரும்பு அதனுடைய நீரேறிய
ஆக்சைடாக மாறும் நிகழ்வு துருப்பிடித்தல் எனப்படும். துரு என்பது நீரேறிய இரும்பு
(II) ஆக்சைடு ஆகும்.
(x என்பது வேறுபட்ட நீர் மூலக்கூறுகளின் எண்ணிக்கையைக் குறிக்கிறது.)
4. ஆக்சிஜனின் பயன்கள்
• உலோகங்களை வெட்டவும் இணைக்கவும் (வெல்டிங்) பயன்படும் ஆக்சி-அசிட்டிலின்
உருளைகளில் இது பயன்படுகிறது.
• எஃகிலுள்ள கார்பன் மாசை நீக்கப் பயன்படுகிறது.
• விலங்குகள் மற்றும் தாவரங்களின் சுவாசத்திற்கு ஆக்சிஜன் உதவுகிறது.
• ராக்கெட்டுகளில் எரிபொருளாகப் பயன்படுகிறது.
• ஆழ்கடலில் மூழ்குபவர்கள், மலை ஏறுபவர்கள், விண்வெளி வீரர்
மற்றும் நோயாளிகளுக்குத் தேவைப்படும் செயற்கை சுவாசத்தில் ஆக்சிஜன் பயன்படுகிறது.
• கரித்தூளுடன் ஆக்சிஜனை இணைத்து வெடிபொருள் தயாரிக்கப்படுகிறது.
• மெத்தனால்
மற்றும் அம்மோனியா தயாரிக்க இது பயன்படுகிறது.
