தேவை, பல்வேறு கூற்றுகள், - வெப்ப இயக்கவியலின் இரண்டாம்விதி | 11th Chemistry : UNIT 7 : Thermodynamics
11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
வெப்ப இயக்கவியலின் இரண்டாம்விதி
வெப்ப இயக்கவியலின் இரண்டாம்விதி
வெப்ப இயக்கவியலின் இரண்டாம் விதிக்கான தேவை:
வெப்ப இயக்கவியலின் முதல்விதிப்படி அண்டத்தின் ஆற்றல் மாறாதிருக்கும் எனநாம் அறிவோம்.
பின்வரும் எடுத்துக்காட்டுகளை நாம் கருதுவோம்.
1. ஒரு முகவையிலுள்ள வெந்நீர், சிறிது நேரத்தில் சூழலுக்கு வெப்ப ஆற்றலை இழந்து குளிர்ச்சியடைகிறது.
2. ஹைட்ரோ குளோரிக் அமிலத்தை, சோடியம் ஹைட்ராக்ஸைடுடன் சேர்க்கும் போது. சோடியம் குளோரைடும், நீரும் உருவாகிறது. இவ்வினையில் வெப்பம் வெளியேறுகிறது.
இவ்விரு நிகழ்வுகளிலும், மொத்த ஆற்றல் மாறுவதில்லை, மேலும் இது முதல் விதிப்படியே அமைகிறது. எனினும், இதன் மறுதலைச் செயல்முறைகள் அதாவது குளிர்ந்த நீரானது சூழலில் இருந்துதானாகவே வெப்பத்தை உறிஞ்சி வெந்நீராக மாறும் வினையின் ஆற்றல் மாற்றமும் முதல்விதிப்படியே அமைந்தாலும், இவ்வினை தன்னிச்சையாக நிகழ்வதில்லை. எனினும் குளிர்ந்த நீருக்கு வெப்ப ஆற்றல் வழங்கப்படும் போது அது சூடாகிறது, அதாவது இம்மாற்றம் தன்னிச்சையாக நிகழ்வதில்லை, மேலும் ஆற்றலை கொடுப்பதன் மூலம் நிகழுமாறு செய்ய முடியும்.
இதை போலவே, சோடியம் குளோரைடு கரைசல் தானாக வெப்பத்தை உறிஞ்சி ஹைட்ரோ குளோரிக் அமிலமாகவும், சோடியம் ஹைட்ராக்ஸைடாகவும் மாறுவது இல்லை. ஆனால் ஆற்றலை வழங்கியும் இந்த செயல் முறையை நிகழச் செய்யமுடியாது.
இவ்வாறான இயற்கை அனுபவங்களிலிருந்து, சில செயல் முறைகள் தன்னிச்சையாகவும், சில செயல் முறைகள் தன்னிச்சையற்றும் மேலும் சில செயல்முறைகள் ஒருகுறிப்பிட்ட திசையில் மட்டும் நிகழ்வதாக அமைகின்றன என அறிய முடிகிறது. ஒரு குறிப்பிட்ட வினையின் நிகழும் தன்மையை விளக்க நமக்கு வெப்ப இயக்கவியல் இரண்டாம் விதி தேவைப்படுகிறது.
1. வெப்ப இயக்கவியலின் இரண்டாம் விதியின் பல்வேறு கூற்றுகள்:
என்ட்ரோபி
வெப்ப இயக்கவியலின் இரண்டாம்விதி "என்ட்ரோபி" என்றழைக்கப்படும் மற்றுமொரு நிலைச்சார்பை அறிமுகப்படுத்துகிறது. என்ட்ரோபி என்பது ஒரு அமைப்பின் மூலக்கூறுகளின் ஒழுங்கற்ற தன்மையை அளவிடும் வெப்ப இயக்கவியல் நிலைச்சார்பு. ஆனால் என்ட்ரோபியின் வெப்ப இயக்கவியல் வரையறையானது ஒரு செயல்முறையின் விளைவால் ஏற்படும் என்ட்ரோபி மாற்றத்தை கருத்தில் கொள்கிறது. இதன் வரையறை பின்வருமாறு
dS = dqமீள் / T
என்ட்ரோபி கூற்று:
வெப்ப இயக்கவியலின் இரண்டாம் விதியை என்ட்ரோபி வாயிலாக குறிப்பிடலாம், அதாவது “ஒருதன்னிச்சை செயல்முறை நிகழும்போது, ஒரு தனித்த அமைப்பின் என்ட்ரோபி அதிகரிக்கிறது.
வாயுக்கள் விரிவடைதல் போன்ற மீளா செயல் முறைகளுக்கு
ΔS'மொத்தம் > 0
ΔS'மொத்தம் > ΔSஅமைப்பு > ΔSசூழல்
i.e. ΔS'மொத்தம் > ΔSஅமைப்பு + ΔSசூழல்
பனிக்கட்டி உருகுதல் போன்று மீள் செயல்முறைகளுக்கு,
ΔSஅமைப்பு = ΔSசூழல்
ΔSமொத்தம் = 0
கெல்வின் - பிளாங்க் கூற்று:
ஒரு சுற்றுச் செயல் முறையில், சூடான வெப்ப மூலத்திலிருந்து வெப்பத்தை உறிஞ்சி அவ்வெப்பத்தின் ஒரு பகுதியை குளிர்ந்த நிலையிலுள்ள மூலத்திற்கு மாற்றாமல், முழுவதும் வேலையாக மாற்றக்கூடிய இயந்திரத்தினை வடிவமைக்க இயலாது. ஒரு சிறந்த, உராய்வற்ற இயந்திரத்தினால் கூட அதற்கு கொடுக்கப்பட்ட வெப்ப உள்ளீட்டினை 100% வேலையாக மாற்ற முடியாது என்பதை வெப்ப இயக்கவியல் இரண்டாம் விதி விளக்குகிறது.
மீள்முறையில் செயல்படும் ஒரு வெப்ப இயந்திரத்தின் திறனானது, அந்த இயந்திரம் எந்த இரு வெப்பநிலைகளுக்கிடையே செயல்படுகிறநோ அவற்றை மட்டுமே பொறுத்து அமைகிறது என்பதை கார்னோ (Carnot) வெப்ப இயந்திரங்களை பற்றிய தனது ஆய்வின் மூலம் கண்டறிந்தார்.
திறன் = செய்யப்பட்ட வேலை / உறிஞ்சப்பட்டவெப்பம்
η = |qh| - |qc| / |qh|

qh - சூடான வெப்ப மூலத்திலிருந்து உறிஞ்சப்பட்ட வெப்பம்
qC - குளிர்ந்த நிலையிலுள்ள மூலத்திற்கு மாற்றப்பட்ட வெப்பம்
η = 1 – [ |qc| / |qh| ] ---------- (7.27)
ஒரு மீள்சுற்றுச் செயல்முறைக்கு
ΔS(அண்டம்) = ΔSஅமைப்பு + ΔSசூழல் = 0
ΔS(அமைப்பு) = -ΔSசூழல்

சமன்பாடு 7.27 ல் 7.28 ஐ பிரதியிட
⇒ η = 1 – (Tc / Th) ---------- (7.29)
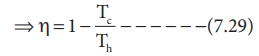
Th >> Tc
எனவே, η < 1
இயந்திரத்தின் திறனை சதவிகிதத்தில் பின்வருமாறு குறிப்பிடப்படுகிறது.
இயக்குதிறன் சதவீதம் = [ 1 – (Tc / Th) ] × 100
கிளாசியஸ் கூற்று:
எந்த ஒரு வேலையும் செய்யாமல், குளிர்ந்த வெப்ப மூலத்திலிருந்து, சூடான வெப்ப மூலத்திற்கு, வெப்பத்தை மாற்ற முடியாது.
கணக்கு 7.10
ஒரு தானியங்கி மோட்டார் வாகன இயந்திரத்தில், பெட்ரோல் 816° C வெப்பநிலையில் எரிக்கப்படுகிறது. சூழலின் வெப்பநிலை 21°C ஆக இருக்கும்போது இயந்திரத்தின் அதிகபட்ச திறனை கணக்கிடுக.
தீர்வு
இயக்குதிறன் சதவீதம் [ (Th – Tc) / Th ] × 100
இங்கு
Th = 816 + 273 = 1089 K;
Tc = 21 + 273 = 294 K
இயக்குதிறன் சதவீதம் = [ (1089 – 294) / 1089 ] × 100
இயக்குதிறன் சதவீதம் = 73%
தன்மதிப்பீடு
5) 127°C மற்றும் 47°C ஆகிய வெப்பநிலைகளுக்கிடையே செயல்படும் ஒரு இயந்திரம் உயர்வெப்ப மூலத்திலிருந்து ஒரு குறிப்பிட்ட அளவு ஆற்றலை உறிஞ்சுகிறது. உராய்வின் மூலம் எந்த ஆற்றல் இழப்பும் இல்லாத நிலையில் இயந்திரத்தின் அதிகபட்ச சதவீத இயக்கத்திறனைக் கணக்கிடுக.
தீர்வு:
Th =127°C =127 + 273 = 400K
TC = 47 °C = 47 + 273 = 320K
இயக்குத்திறன் சதவீதம், ղ = ?
ղ = [Th − TC / Th] ×100
ղ = [400 – 320/400] ×100
ղ = [80/400] ×100
ղ = 20%
என்ட்ரோபியின் அலகுகள்:
என்ட்ரோபி (S) என்பது பரிமாறப்பட்ட வெப்ப ஆற்றலை (q), வெப்பநிலையால் (T) வகுக்க கிடைப்பது ஆகும். எனவே என்ட்ரோபியின் SI அலகு JK-1.
ஒழுங்கற்ற தன்மை மற்றும் தன்னிச்சைத் தன்மை
பனிக்கட்டி உருகுதல், நீர் ஆவியாதல் போன்ற செயல்முறைகளை கவனமாக ஆய்ந்தறியும் போது, அவ்வமைப்பின் ஒழுங்கற்ற தன்மை அதிகரிப்பதை அறிய முடிகிறது. பனிக்கட்டியில் நீர் மூலக்கூறுகள் அதிக ஒழுங்குடன் கூடிய படிக அமைப்பில் உள்ளதால், அவ்வமைப்பு மூலக்கூறுகளின் சிறு நகர்வுகளுக்கு மட்டுமே அனுமதிக்கிறது. பனிக்கட்டி உருகும் போது, நீர் மூலக்கூறுகள் ஒழுங்கற்ற நிலைக்கு செல்கின்றன மேலும் அதிக கட்டற்ற தன்மையுடன் நகர்கின்றன. நீர்மநிலையில் கட்டற்ற நகரும் தன்மை அதிகரிக்கிறது. ஆவிநிலையில் இது மேலும் அதிகரிக்கிறது. அதாவது பனிக்கட்டி நீராக உருகும் போதும், அல்லது நீர் ஆவியாகும் போதும், நீர் மூலக்கூறுகளின் ஒழுங்கற்ற தன்மை அதிகரிக்கிறது என நாம் இதனை கூற முடியும். இவ்விரு நிகழ்வுகளும் தன்னிச்சை செயல்முறைகளாகும். இச்செயல்முறைகளில் ஒழுங்கற்ற தன்மை (என்ட்ரோபி) அதிகரிக்கிறது.

படம் 7.8 ஒழுங்கற்ற தன்மை அதிகரித்தல் – விளக்கப்படம்
திட்ட என்ட்ரோபி மாற்றம் (ΔS0):
தனிச்சுழி வெப்பநிலை (0K)க்கு மேல் எந்த ஒரு வெப்பநிலையிலும் ஒரு அமைப்பின் உண்மையான என்ட்ரோபி மதிப்பினைக் கண்டறிய இயலும். 298K மற்றும் 1 bar அழுத்த நிலையில் ஒரு பொருளின் தனி என்ட்ரோபி ஆனது அச்சேர்மத்தின் திட்ட என்ட்ரோபி (S0) என்றழைக்கப்படுகிறது. நெர்ன்ஸ்டின் வெப்ப இயக்கவியல் மூன்றாம் விதிக்கான கூற்றின்படி ஒரு குறைபாடற்ற படிக தனிமத்தின் தனி என்ட்ரோபி மதிப்பு தனிச்சுழி வெப்பநிலையில் வெப்பநிலையில் (0K) மட்டும் பூஜ்ஜியமாகும். தனிச்சுழி வெப்பநிலைக்கு மேல் எந்த ஒருவெப்பநிலையிலும் அனைத்து சேர்மங்களின் திட்ட என்ட்ரோபி மதிப்புகளும் எப்போதும் நேர்குறி மதிப்பைக் கொண்டிருக்கும். வினையில் ஈடுபடும் பல்வேறு சேர்மங்களின் என்ட்ரோபி மதிப்புகளிலிருந்து, வினையின் என்ட்ரோபி மாற்றத்தை (ΔSr0) கணக்கிட முடியும்.
ΔSr0 = ΣSoவினைவிளைப்பொருட்கள் - ΣSoவினைபடுப்பொருட்கள் ---------- (7.30)
திட்ட உருவாதல் என்ட்ரோபி:
"திட்ட நிலைமைகளில், ஒரு மோல் சேர்மம், அதன் தனிமங்களிலிருந்து உருவாகும்போது ஏற்படும் என்ட்ரோபி மாற்றம், திட்ட உருவாதல் என்ட்ரோபி என வரையறுக்கப்படுகிறது. இது ΔSf0 என குறிக்கப்படுகிறது. தனிமங்களின் திட்ட என்ட்ரோபி (S0) மதிப்புகளிலிருந்து கொடுக்கப்பட்டுள்ள ஒரு சேர்மத்தின் என்ட்ரோபியைக் கணக்கிட முடியும்.
கணக்கு 7.6
C (s) + O2 (g) → CO2 (g) இவ்வினையின் திட்ட என்ட்ரோபி மாற்றத்தை கணக்கிடுக. CO2 (g), C (s), O2 (g) ஆகியவற்றின் திட்ட என்ட்ரோபி மதிப்புகள் முறையே 213.6, 5.740, மற்றும் 205 JK-1.
C (g) + O2 (g) → CO2 (g)
ΔS0r = ΣS0வினைவிளைப்பொருட்கள் – ΣS0வினைபடுப்பொருட்கள்
ΔS0r = {S0CO2} – {S0C + S0O2}
ΔS0r = 213.6 - [5.74 + 205]
ΔS0r = 213.6 - [210.74]
ΔS0r = 2.86 JK-1
தன்மதிப்பீடு
6) யூரியா நீராற் பகுப்படைந்து அம்மோனியா மற்றும் கார்பன்-டை- ஆக்ஸைடை தருகிறது. இவ்வினையின் திட்ட என்ட்ரோபி மாற்றத்தை கணக்கிடுக. யூரியா, H2O, CO2, NH3 ஆகியவற்றின் திட்ட என்ட்ரோபி மதிப்புகள் முறையே 173.8, 70, 213.5 மற்றும் 192.5 J mol-1 K-1
தீர்வு:
S0 (யூரியா) = 173.8 J mol−1K−1
S0 (H2O) = 70 J mol−1K−1
S0 (CO2) = 213.5 J mol−1K−1
S0 (NH3) = 192.5 J mol−1K−1
NH2 – CO − NH2 + H2O → 2NH3 + CO2
∆S0r = ∑ (S0) வினைவிளைப்பொருள் − ∑ (S0) வினைபடுப்பொருள்
S0r = [2S0(NH3) + S0(CO2)] − [S0(யூரியா) + S0 (H2O)]
∆S0r = [2 × 192.5 + 213.5] – [173.8 + 70]
∆S0r = [598.5] − [243.8]
∆S0r = 354.7Jmol−1K−1
நிலைமை மாற்றங்களின் என்ட்ரோபி மாற்றங்கள்:
ஒரு திண்மம் நீர்மமாதல் (உருகுதல்), ஒரு நீர்மம் ஆவியாதல் (ஆவியாதல்), ஒரு திண்மம் ஆவியாதல் (பதங்கமாதல்) ஆகிய செயல்முறைகளின் போது என்ட்ரோபி மாற்றம் நிகழ்கிறது. இம்மாற்றங்களின் போது இரண்டு நிலைமைகளும் சமநிலையில் இருப்பதால் இம்மாற்றத்தினை மீள் முறையில், மாறா வெப்பநிலையில் நிகழ்த்தலாம்.
ΔS = qமீள் / T = ΔHமீள் / T ---------- (7.31)
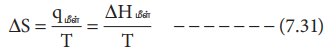
உருகுதல் என்ட்ரோபி:
ஒரு மோல் திண்மம், அதன் உருகுநிலையில், மீள் முறையில் உருகும்போது உறிஞ்சப்படும் வெப்பம் மோலார் உருகுதல் வெப்பம் எனப்படுகிறது. இச் செயல்முறைக்கான என்ட்ரோபி மாற்றம் உருகுதல் என்ட்ரோபி எனப்படும்.
ΔSமீள் = dqமீள் / T
ΔS உருகுதல் = ΔHஉருகுதல் / Tf ---------- (7.32)
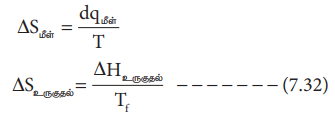
இங்கு Hf என்பது மோலார் உருகுதல் வெப்பம். Tf என்பது உருகுநிலை.
ஆவியாதல் என்ட்ரோபி:
ஒரு மோல் திரவம், அதன் கொதி நிலையில், மீள் முறையில் ஆவியாகும் போது உறிஞ்சப்படும் வெப்பம் மோலார் ஆவியாதல் வெப்பம் எனப்படுகிறது. இச்செயல்முறைக்கான என்ட்ரோபி மாற்றம் ஆவியாதல் என்ட்ரோபி எனப்படும்.
ΔSv = ΔHv / Tb ---------- (7.33)
இங்கு ΔHv என்பது மோலார் ஆவியாதல் வெப்பம், Tb என்பது கொதிநிலை
புறவேற்றுமை வடிவமாறுதல் என்ட்ரோபி:
ஒரு மோல் திண்மம், அதன் புறவேற்றுமை வடிவமாறு வெப்பநிலையில், மீள் முறையில் ஒரு புறவேற்றுமை வடிவத்திலிருந்து மற்றொன்றிற்கு மாற்றமடையும் போது ஏற்படும் வெப்பமாற்றம் மோலார் புறவேற்றுமை வடிவமாறு வெப்பம் எனப்படுகிறது. இச்செயல்முறைக்கான என்ட்ரோபி மாற்றம் புறவேற்றுமை வடிவமாறுதல் என்ட்ரோபி எனப்படுகிறது.
ΔSt = ΔHt / Tt ---------- (7.34)
இங்கு ΔHt என்பது மோலார் புறவேற்றுமை வடிவமாறு வெப்பம், Tt என்பது புறவேற்றுமை வடிவமாறு வெப்பநிலை.
கணக்கு 7.7
0°C வெப்பநிலையில் 1 மோல் பனிக்கட்டி, நீராக உருகும்போது நிகழும் என்ட்ரோபி மாற்றத்தை கணக்கிடுக. பனிக்கட்டியின் மோலார் உருகுதல் வெப்பமதிப்பு 6008 J mol-1.
தீர்வு
ΔHஉருகுதல் = 6008 J mol-1
Tf = 0° C = 273 K

தன்மதிப்பீடு
7) 351 K வெப்பநிலையில் 1 மோல் எத்தனாலை ஆவியாக்கும் போது நிகழும் என்ட்ரோபி மாற்றத்தைக்கணக்கிடுக. எத்தனாலின் மோலார் ஆவியாதல் வெப்பமதிப்பு 39.84 kJ mol-1.
தீர்வு:
Tb = 351K
ΔΗVap = 39840J mol−1
ΔSV = ΔΗVap / Tb
ΔSV = 39840 /351
ΔSV = 113.5JK−1mol−1