அணு அமைப்பு | முதல் பருவம் அலகு 4 | 7 ஆம் வகுப்பு அறிவியல் - இணைதிறன் | 7th Science : Term 1 Unit 4 : Atomic Structure
7 ஆம் வகுப்பு அறிவியல் : முதல் பருவம் அலகு 4 : அணு அமைப்பு
இணைதிறன்
இணைதிறன்
நாம் பிறருடன் கை குலுக்கும் போது, ஒரு கையின் உதவியுடன் ஒருவருடன் கை குலுக்கலாம். அல்லது, இரண்டு கைகளின் உதவியுடன் இருவருடன் கை குலுக்கலாம். நமக்கு இரண்டிற்கும் மேற்பட்ட கைகள் இருந்தால், பல நபர்களுடன் கை குலுக்கலாம். இதேபோன்று, சில அணுக்கள் ஓர் எலக்ட்ரானையும் சில அணுக்கள் இரு எலக்ட்ரான்களையும், சில அணுக்கள் மூன்று எலக்ட்ரான்களையும், சில அணுக்கள் நான்கு எலக்ட்ரான்களையும் பிற அணுக்களுடன் பகிரகூடிய தன்மையைப் பெற்றிருக்கும். வேறு சில அணுக்கள் எந்த ஒரு எலக்ட்ரானையும் பகிரகூடிய தன்மையைப் பெறாமல் இருக்கும். அணுக்களின் இத்தகைய பண்பிற்கு இணைதிறன் என்று பெயர்.
அணுக்களைப் பிணைத்திருப்பது எது? எலக்ட்ரான்கள் எதிர்மின் சுமை கொண்டவை; புரோட்டான்கள் நேர்மின்சுமை கொண்டவை. இவற்றிற்கு இடையே உள்ள ஈர்ப்பே எலக்ட்ரான்களை அதன் வட்டப்பாதைகளில் பிணைத்து வைத்திருக்கிறது.
ஓர் அணு பிற அணுவுடன் இணையக்கூடிய திறனே இணைதிறன் எனப்படும். ஓர் அணு எத்தனை ஹைட்ரஜன் அணுக்களைப் பிணைத்து வைத்திருக்க இயலும் என்பதனைக் கொண்டு இது அளவிடப்படுகிறது. எடுத்துக்காட்டாக, ஓர் ஆக்சிஜன் அணு இரு ஹைட்ரஜன் அணுக்களுடன் இணைந்து ஒரு நீர் மூலக்கூறினை உருவாக்கும். எனவே, ஆக்சிஜனின் இணைதிறன் இரண்டாகும். குளோரினைப் பொருத்தவரையில், அது ஒரே ஒரு ஹைட்ரஜன் அணுவுடன் மட்டுமே இணைந்து ஹைட்ரோகுளோரிக் அமிலத்தை உருவாக்கும். எனவே, குளோரினின் இணைதிறன் ஒன்றாகும். மீத்தேனில் (CH4) ஒரு கார்பன் அணு நான்கு ஹைட்ரஜன் அணுக்களுடன் இணைந்துள்ளது.
உங்களால் மீத்தேனில் உள்ள கார்பன் அணுவின் இணைதிறனை யூகிக்க முடிகிறதா? அம்மோனியா மூலக்கூறில், நைட்ரஜன் அணு மூன்று ஹைட்ரஜன் அணுக்களுடன் இணைகிறது. அம்மோனியாவில் உள்ள நைட்ரஜனின் இணைதிறன் மதிப்பு என்ன?
வெவ்வேறு தனிமங்களின் அணுக்கள் அல்லது ஓரே தனிமத்தின் அணுக்கள் இணைந்து மூலக்கூறுகள் உருவாகும். வேறு ஒரு தனிமத்தின் அணு அல்லது அணுக்களுடன் இனையும் ஒரு தனிமத்தின் அணுக்களின் எண்ணிக்கையை இணைதிறன் தீர்மானிக்கிறது.
இணைதிறன் மதிப்பு ஒன்றைக் கொண்ட தனிமங்கள் ஒற்றை இணைதிறன் தனிமங்கள் எனப்படும். எ.கா. ஹைட்ரஜன் மற்றும் சோடியம். இணைதிறன் மதிப்பு இரண்டைக் கொண்ட தனிமங்கள் இரட்டை இணைதிறன் தனிமங்கள் எனப்படும். எ.கா. ஆக்சிஜன் மற்றும் பெரிலியம். இணைதிறன் மதிப்பு மூன்றைக் கொண்ட தனிமங்கள் மும்மை இணைதிறன் தனிமங்கள் எனப்படும். எ.கா. நைட்ரஜன் மற்றும் அலுமினியம். சில தனிமங்கள் ஒன்றுக்கும் மேற்பட்ட இணைதிறனைப் பெற்றிருக்கின்றன. எடுத்துக்காட்டாக, இரும்பு ஆக்சிஜனுடன் இணைந்து இரு வகையான ஆக்சைடுகளை உருவாக்கும். பெர்ரஸ் ஆக்சைடு இரண்டு இணைதிறனையும், பெர்ரிக் ஆக்சைடு மூன்று இணைதிறனையும் கொண்டுள்ளன. இவற்றைப் பற்றி விரிவாக உயர் வகுப்புகளில் கற்க இருக்கிறீர்கள்.
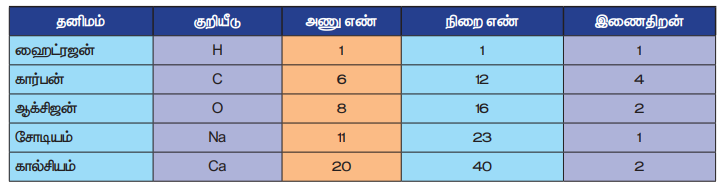
பல்வேறு தனிமங்களின் அணுக்கள் ஒன்றுடன் ஒன்று இணையும்போது சேர்மங்களின் மூலக்கூறுகள் உருவாகின்றன. இந்நிகழ்வுகளில் நாம் அத்தனிமங்களின் இணைதிறன் மதிப்பினை அறிந்து வைத்திருப்பது அவசியமாகும். சில தனிமங்களின் இணைதிறன் அட்டவணை 4.4 ல் தரப்பட்டுள்ளன.
அட்டவணை 4.4 தனிமங்களின் குறியீடு, அணு எண், நிறை எண் மற்றும் இணைதிறன்