வாயு விதிகள் - பாயில் விதி - (அழுத்தம் - கனஅளவு- தொடர்பு) | 11th Chemistry : UNIT 6 : Gaseous State
11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
பாயில் விதி - (அழுத்தம் - கனஅளவு- தொடர்பு)
பாயில் விதி - (அழுத்தம் - கனஅளவு- தொடர்பு)
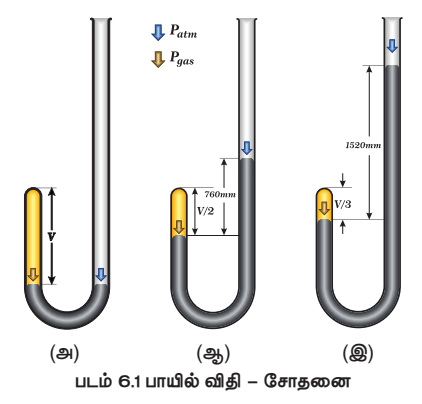
வாயுக்களின் அழுத்தம் மற்றும் கனஅளவு ஆகியவற்றிற்கு இடையேயான தொடர்பினை அறியும் பொருட்டு ராபர்ட் பாயில் தொடர்ச்சியான பரிசோதனைகளை மேற்கொண்டார். அவர் பயன்படுத்தியதைப் போன்ற மாதிரி உபகரண அமைப்பினை படம் (6.1)ல் காணலாம்.
படம் 6.1 பாயில் விதி – சோதனை
படம் (61) ல் காட்டப்பட்டுள்ளவாறு, உபகரணத்தின் இரு முனைகளிலும் உள்ள பாதரச மட்டத்தின் அளவு சமமாகும் வகையில் உபகரணத்தின் திறந்த முனை வழியே பாதரசம் சேர்க்கப்படுகிறது.
மூடிய முனையில் அடைபட்டுள்ள காற்றின் கன அளவு, ஆரம்ப நிலையில் இருந்த அளவில் பாதியாகும். வகையில் கூடுதலாக பாதரசத்தினை சேர்க்கவும். இந்நிலை படம் 6.1 (ஆ) ல் காட்டப்பட்டுள்ளது. கூடுதலாக பாதரசம் சேர்க்கப்பட்டதால், வாயு உணரும் அழுத்தமானது. இரு முனைகளில் உள்ள பாதரச மட்டங்களுக்கு இடையேயான வேறுபாட்டினால் பெறப்படுகிறது. ஆரம்ப நிலையில் இரு முனைகளிலும் உள்ள பாதரச மட்டங்களுக்கு இடையே வேறுபாடு பூஜ்யமாகும். எனவே அடைபட்ட வாயு உணரும் அழுத்தம், வளிமண்டல அழுத்தமான 1 atm க்குச் சமம். அடைபட்ட வாயுவின் கனஅளவு ஆரம்ப அளவைக் காட்டிலும், சரிபாதியளவு குறைக்கப்படும் போது, பாதரச மட்டங்களுக்கு இடையேயான வேறுபாடு 760mm ஆக அதிகரிக்கிறது. இந்நிலையில் அடைபட்ட வாயு உணரும் அழுத்தம் 2 atm ஆகும். இதனடிப்படையில், ஒரு குறிப்பிட்ட வெப்பநிலையில், குறிப்பிட்ட நிறையுள்ள வாயு அடைத்துக் கொள்ளும் கனஅளவானது அதன் அழுத்தத்திற்கு எதிர்விகித தொடர்புடையது என பாயில் முடிவு செய்தார்.
கணிதவியல் முறைப்படி, பாயில் விதியினை கீழ்க்கண்டுள்ளவாறு எழுதலாம்
V α (1 / P) -------- (6.1)
( T மற்றும் n மாறிலிகள். T - வெப்பநிலை, n - மோல்களின் எண்ணிக்கை)
V = k × (1 / P) ---------- (6.2)
k - விகித மாறிலி
சமன்பாடு (6.2) ஐ நாம் மாற்றியமைக்கும் போது, மாறாத வெப்பநிலை மற்றும் நிறையில்,
PV = k ---------- (6.2a)
வாயுக்களின் வேதித்தன்மை எத்தகையதாக இருப்பினும், அனைத்து வாயுக்களுக்கும் அழுத்தம் குறைவாக உள்ள நிலையில் பாயில் விதி பொருந்தும்.
எனவே மாறாத வெப்பநிலையில், இருவேறு நிலைகளில் உள்ள குறிப்பிட்ட நிறையுள்ள ஒரு வாயுவிற்கு பாயில் விதியினை நாம் பின்வருமாறு எழுதலாம்
P1 V1 = P2 V2 = k ---------- (6.3)
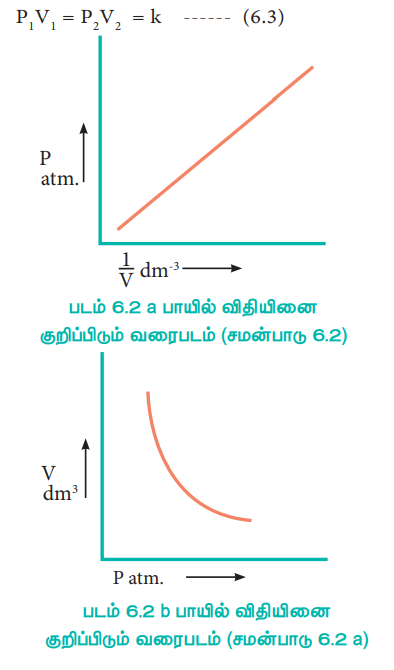
PV தொடர்பினை நாம் பின்வருமாறு புரிந்து கொள்ளலாம். வாயுக்களின் மூலக்கூறுகள் கொள்கலனின் சுவற்றின் மீது மோதுவதால் ஏற்படும் மூலக்கூறுகளின் மீதான விசை வாயுவின் அழுத்தத்திற்கு காரணமாக அமைகிறது. ஒரு குறிப்பிட்ட அளவுள்ள, வாயுவின் கன அளவு பாதியாகக் குறைக்கப்படும் போது, வாயுவின் அடர்த்தி இருமடங்காகிறது. எனவே, கலனின் ஓரலகு பரப்பில் மோதும் மூலக்கூறுகளின் எண்ணிக்கையும் இரு மடங்காகிறது. இதன் காரணமாக, வாயுவின் அழுத்தமும் இரு மடங்காக அதிகரிக்கிறது.
பாயில் விதியின் விளைவுகள்
பாயில் விதியிலிருந்து அழுத்தம் - அடர்த்தி இவற்றிற்கு இடையான தொடர்பினை பின்வருமாறு தருவிக்கலாம்.
P1 V1 = P2 V2 (பாயில் விதி)
P1 (m / d1) = P2 (m / d2)
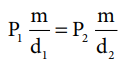
இங்கு “m” என்பது வாயுவின் நிறை, d1 மற்றும் d2 என்பன முறையே, P1 மற்றும் P2 அழுத்த நிலைகளில் அடர்த்தி மதிப்புகளைக் குறிப்பிடுகின்றன.
P1 / d1 = P2 / d2 ---------- (6.4)
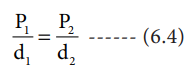
அதாவது, வாயுவின் அடர்த்தி, அதன் அழுத்தத்திற்கு நேர்விகித தொடர்புடையது.
உங்களுக்குத் தெரியுமா?
பயணிகள் விமானத்தின் உட்புறம் செயற்கையாக அழுத்த அதிகரிப்பு செய்யப்படுகிறது. ஏன் இவ்வாறு செய்யப்படுகிறது. என்பதை நீ அறிவாயா?
பெரும்பாலான ஆகாய விமானங்கள் சுமார் 30,000 அடி உயரத்தில் பறக்கும். உயரம் அதிகரிக்கும் போது ஓரலகு கன அளவில் காணப்படும் வாயு மூலக்கூறுகளின் எண்ணிக்கை குறைவாக இருப்பதால் அழுத்தம் குறையும்.
எனவே விமானம் காற்றில் உயரத்தில் செல்லும் போது அதனை சூழ்ந்துள்ள காற்றின் அழுத்தம் மிக குறைவாக உள்ளதால், விமானத்தினுள் உள்ளவர் ஆக்சிஜன் குறைபாட்டிற்கு உள்ளாக வாய்ப்புள்ளது. இக்காரணத்தினால் தான் ஆகாய விமானங்களில் செயற்கையாக அழுத்த அதிகரிப்பு செய்யப்படுகிறது.

இதைப்போலவே, மலையேறும் ஒருவர், அழுத்தக் குறைவினால் ஏற்படும் விளைவினை, காதுகளில் ஏற்படும் சிறுவலியின் மூலம் உணரமுடியும். வெளிப்புற அழுத்தம் குறையும் போதிலும் காதின் உட்குழியில் உள்ள காற்றின் அழுத்தம் மாறாமல் இருக்கும். இது ஒரு சமநிலையற்ற நிலையினை ஏற்படுத்துகிறது. இந்த அதிகப்படியான உள் அழுத்தம், செவிப்பறையினை வெளிநோக்கி தள்ளுவதால் சிறு வலி ஏற்படுகிறது. சிறிது நேரத்தில் கொட்டாவி விடுவதால், செவி உட்குழியில் உள்ள மிகுதியான காற்று வெளியேறும் நிகழ்வின் காரணமாக உள் அழுத்தமும், வெளி அழுத்தமும் சமமாவதுடன், வலியினையும் குறைக்கிறது.
நீரில் மூழ்குபவர்கள், மூழ்கும் போது தேவையின்றி மூச்சினை அடக்கக் கூடாது என அறிவுரை வழங்கப்படுவதற்கு என்ன காரணம் என உங்களுக்குத் நெரியுமா?
படம் (6.3)ல் விடுபட்ட அளவீடுகளை (6.3 (b)ல் கனஅளவு மற்றும் 6.3 (c)ல் அழுத்தம்) கண்டறிவோம்.

தீர்வு:
பாயில் விதியின்படி, மாறாத வெப்பநிலையில், ஒரு குறிப்பிட்ட நிறையுடைய வாயுவிற்கு,
P1V1 = P2V2 = P3V3
1 atm × 1 dm3 = 2 atm × V2 = P3 × 0.25 dm3
ஃ 2 atm × V2 = 1 atm × 1 dm3
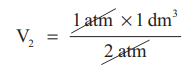
V2 = 0.5 dm3
and P3 × 0.25 dm3 = 1 atm × 1 dm3
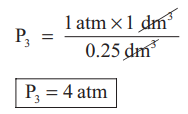
P3 = 4 atm
தங்களை மதிப்பீடு செய்து கொள்ளுங்கள்
1. குளிர்சாதனப் பெட்டிகளில் குளிர்விப்பானாக பயன்படுத்தப்படும் ஃபிரியான்-12 சேர்மமானது, ஓசோன்படலம் சிதைவடைய காரணமாக அமைகிறது. தற்போது அதற்கு மாற்றாக சூழலுக்கு ஏற்ற சேர்மங்கள் பயன்படுத்தப்படுகின்றன. 0.3 atm அழுத்தம் மற்றும் 1.5 dm3 கனஅளவு உடைய ஃபிரியான் வாயு மாதிரியினைக் கருதுக. மாறாத வெப்பநிலையில், அழுத்தமானது 1.2 atmக்கு மாற்றப்படும் போது, அதிகரிக்கும் அல்லது குறையும் கனஅளவைக் கணக்கிடுக.
தீர்வு:
ப்ரீயானின் கனஅளவு (V1) = 1.5dm3
அழுத்தம் (P1) = 0.3 atm
T ஆனது மாறிலி P2 = 1.2 atm
V2 = ?
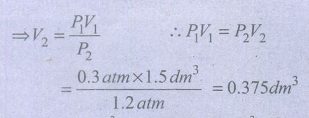
கனஅளவு 1.5dm3 லிருந்து 0.375 dm3 ஆகக் குறைகிறது.
2. ஒரு மோட்டார் வாகன இயந்திரத்தினுள் உள்ள உருளையில் (Cylinder) நிரம்பியுள்ள காற்றின் அழுத்தம் 1.05 atm ஆக உள்ள போது கனஅளவு 0.375 dm3, அதே வெப்பநிலையில் 0.125 dm3 க்கு அழுத்தப்படும்போது, அழுத்தப்பட்ட காற்றின் அழுத்தம் என்ன?
தீர்வு:
V1 = 0.375dm3
V2 = 0.125 dm3
P1 =1.05atm
P2 = ?
“T”மாறிலி
P1V1 = P2V2

P2 = 3.15atm