11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
கணக்குகளுக்கான தீர்வுகள்: வாயு நிலைமை
44) ஒரு வாயு 15°C யில் 1 atm அழுத்தத்தில் பெற்றுள்ள கனஅளவு 2.58 dm3 வெப்பநிலை 38°C யாக 1 atm அழுத்தத்தில் உயர்ந்தால் அதன் கனஅளவு அதிகரிக்குமா? எனில் அதன் இறுதி கனஅளவைக் கணக்கிடு
தீர்வு:
T1 =15°C + 273 = T1 = 288K
T2 = 38 + 273 = 311K
V1 = 2.58dm3 V2 = ?
(P = 1atm மாறிலி)
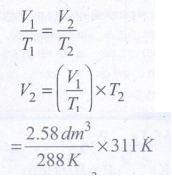
V2 = 2.78dm3
அதாவது கனஅளவு 2.58 dm3 லிருந்து 2.78 dm3 ஆக அதிகரிக்கிறது.
45) ஒரு குறிப்பிட்ட வெப்பநிலையில் வாயு ஒன்றின் கனஅளவு 3.8 dm3 ஆகும். அதனை O°C யில் உள்ள பனிக்கட்டி நீரில் மூழ்க வைக்கும் போது அதன் கனஅளவு 2.27 dm3 எனில் அதன் ஆரம்ப வெப்பநிலை என்ன.
தீர்வு:
V1 = 3.8 dm3
V2 = 2.27 dm3
T1 = ?
T2 = 0°C = 273 K
V1/T1 = V2/T2
T1 = V × [T2/V2]
T1 = 3.8 dm3 × 273K /2.27 dm3
T1 = 457.00 K
46) நைட்ரஜன் வாயுவின் இரு வேறுமாதிரிகளுள் ஒன்று A 1.5 மோல்கள், 37.6 dm3 கனஅளவுள்ள கலனில் 298 K ல் வைக்கப்பட்டுள்ளது. மற்றொன்று B 16.5 dm3 கனஅளவுள்ள கலனில் 298 K ல் வைக்கப்பட்டுள்ளது. மாதிரி B யில் உள்ள மோல்களின் எண்ணிக்கையைக் கணக்கிடுக.
தீர்வு:
nA = 1.5mol
nB = ?
VA = 37.6 dm3
VB = 16.5 dm3
(T = 298K மாறிலி)
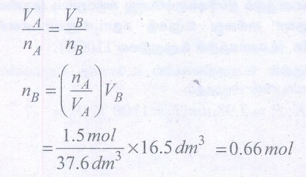
= 0.66 mol
47) சல்பர் ஹெக்சாகுளோரைடு ஒரு நிறமற்ற மணமற்ற வாயு. அது நல்லியல்பு தன்மை உடையதாக கருதி 5.43 dm3 கனஅளவுள்ள ஒரு எஃகு கலனில் 69.5° Cல் 1.82 மோல் கொண்ட வாயுவின் அழுத்தத்தினைக் கணக்கிடுக.
தீர்வு:
n = 1.82 mole
V = 5.43dm3
T = 69.5 + 273 = 342.5K
P = ?

P = 9.425 atm
48) ஆர்கான் ஒரு மந்தவாயு. இது மின்விளக்குகளில் டங்ஸ்டன் இழை ஆவியாவதைத் தடுக்க பயன்படுகிறது. மாறா கனஅளவில் உள்ள ஒரு மின் விளக்கில் 18°Cயில் 1.2 atmல் உள்ள ஆர்கான் வாயு 85°Cக்கு வெப்பப்படுத்தப்படுகிறது. அதன் இறுதி அழுத்தத்தினை (atmல்) கணக்கிடுக.
தீர்வு:
P1 = 1.2 atm
T1 =18°C + 273 = 291K
T2 = 85°C + 273 = 358 K
P2 = ?
P1 /T1 = P2/T2
P2 = [P1 /T1] × T2
= (1.2 atm/291K) × 358 K
P2 = 1.48 atm
49) ஏரி ஒன்றில் ஒரு சிறிய குமிழி 6°C மற்றும் 4 atm உள்ள அடிப்புறத்தில் இருந்து 25°C மற்றும் 1 atm உள்ள மேற்பரப்பிற்கு வருகின்றது. அதன் ஆரம்ப கனஅளவு 1.5 ml எனில் இறுதி கனஅளவினை கண்டறிக.
தீர்வு:
T1 = 6°C + 273 = 279K
P1 = 4atm
V1 = 1.5 ml
T2 = 25°C + 273 = 298 K
P2 = 1atm
V2 = ?

V2 = 6.45mol
50) ஒரு உலோகத்தினை ஹைட்ரோகுளோரிக் அமிலத்துடன் வினைபுரியச் செய்யும் போது ஹைட்ரஜன் உருவாகிறது. ஒரு மாணவன் இந்த வினையின் மூலம் 154.4 × 10-3 கனஅளவுள்ள வாயுவினை 742 mm Hg அழுத்தத்தில் மற்றும் 298 K வெப்பநிலையில் சேகரிக்கிறான் எனக் கருதவும். மாணவன் சேகரித்த ஹைட்ரஜன் வாயுவின் நிறை என்ன?
தீர்வு:
V = 154.4 × 10–33dm
P = 742 mm of Hg
T = 298K
m = ?
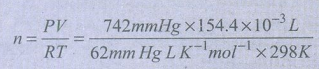
n = 0.006 mol
n = நிறை/ மோலார்நிறை
நிறை = n × மோலார்நிறை = 0.006 × 2.016
= 0.0121 g = 12.1 mg
51) ஒரு வாயு 192 நொடியில் சுவரிலுள்ள ஒரு துளையின் வழியே விரவுகின்றது. N2 வாயு அதே வெப்ப அழுத்த நிலையில் விரவ எடுக்கும் நேரம் 84 நொடி எனில் வாயுவின் மோலார் நிறை என்ன?
தீர்வு:
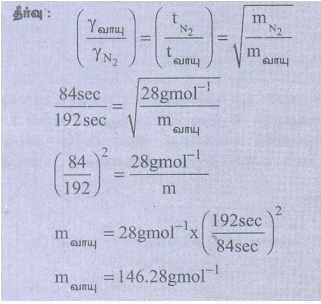
mவாயு = 146.28gmol−1
52) 300 K ல் 52.5 g ஆக்ஸிஜன் மற்றும் 65.1g CO2 அடங்கியுள்ள தொட்டியில் கலவையின் மொத்த அழுத்தம் 9.21 atm. கலவையிலுள்ள ஒவ்வொரு வாயுவின் பகுதி அழுத்தங்களை கண்டறிக.
தீர்வு:
mO2 = 52.5g
PO2 = ?
mCO2 = 65.1g
PCO2 = ?
T = 300K
P = 9.21 atm
PO2 = X O2 × மொத்த அழுத்தம்
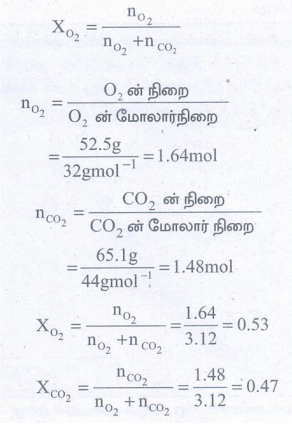
PO2 = X O2 × மொத்த அழுத்தம்
= 0.53 × 9.21atm = 4.88atm
PCO2 = X CO2 × மொத்த அழுத்தம்
= 0.47 × 9.21atm = 4.33atm
53) 2.98 atmல் 25°Cல் உள்ள எரிவாயு உலோகத்தொட்டி ஒன்று வைக்கப்பட்டுள்ளது. அத்தொட்டி 12 atm அழுத்தம் வரை மட்டுமே தாங்கி பின் அதிக அழுத்தத்தினால் வெடிக்கக் கூடியது. அத்தொட்டி உள்ள கட்டிடத்தில் தீப்பிடிக்கும் போது அத்தொட்டி முதலில் வெடிக்குமா அல்லது உருகத் தொடங்குமா எனக்கண்டறிக. (உலோகத்தின் உருகுநிலை 1100K)
உலோகத்தின் உருகுநிலையில் உலோகத் தொட்டியில் உள்ள வாயுவின் அழுத்தம்
T1 = 298K; P1 = 2.98atm;T2 =1100 K ;P2 = ?
P1 /T1 = P2 /T2
⇒ P2 = (P1 /T1) × T2
P2 = (2.98atm/298K) × 1100K =11atm
1100K வெப்பநிலையில் தொட்டியில் உள்ள வாயுவின் அழுத்தமானது 11atm ஆகிறது உலோகத்தொட்டியானது அதிகபட்சமாக 12 atm வரை தாங்கக்கூடியது என்பதால் தொட்டி முதலில் உருகத்தொடங்கும்.