கேள்விகளுக்கான பதில்கள் - சரியான விடையைத் தெரிவு செய்க | 11th Chemistry : UNIT 6 : Gaseous State
11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
சரியான விடையைத் தெரிவு செய்க
மதிப்பீடு
I. சரியான விடையைத் தெரிவு செய்க.
1) வாயுக்கள் அதிக அழுத்தத்தில் நல்லியல்பு பண்பிலிருந்து விலகலடைகின்றன. கீழ்கண்ட கூற்றுகளில் நல்லியல்பு அல்லா தன்மைக்கு பொருந்தும் சரியான கூற்று எது? எவை
அ) அதிக அழுத்தத்தில் மூலக்கூறுகளுக்கிடையே மோதல் அதிகரிக்கின்றன.
ஆ) அதிக அழுத்தத்தில் வாயு மூலக்கூறுகள் ஒரே திசையில் நகர்கின்றன.
இ) அதிக அழுத்தத்தில் வாயுவின் கனஅளவு புறக்கணிக்கத்தக்கதாகும்
ஈ) அதிக அழுத்தத்தில் மூலக்கூறுகளுக்கிடையேயான கவர்ச்சி விசை புறக்கணிக்கத்தக்கதன்று.
[விடை: ஈ) அதிக அழுத்தத்தில் மூலக்கூறுகளுக்கிடையேயான கவர்ச்சி விசை புறக்கணிக்கத்தக்கதன்று.]
2. ஒரு வாயுவின் விரவுதலின் வீதம்
அ) அதன் அடர்த்திக்கு நேர்விகித தொடர்புடையது.
ஆ) அதன் மூலக்கூறு எடைக்கு நேர்விகித தொடர்புடையது
இ) மூலக்கூறு எடையின் வர்க்கமூலத்திற்கு நேர்விகித தொடர்புடையது.
ஈ) மூலக்கூறு எடையின் வர்க்கமூலத்திற்கு எதிர்விகித தொடர்புடையது.
[விடை: ஈ) மூலக்கூறு எடையின் வர்க்கமூலத்திற்கு எதிர்விகித தொடர்புடையது.]
3) கீழ்கண்டவற்றுள் எது வாயுநிலைக்கான சரியான வாண்டர் வால்ஸ் சமன்பாடாகும்.
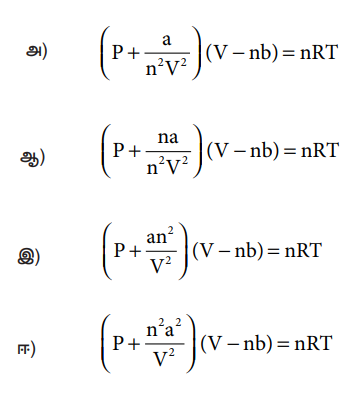
[விடை: இ) [ P + (an2/ V2)] (V − nb) = nRT]
4) கட்டுப்பாடற்ற விரிவடைதலின் போது ஒரு நல்லியல்பு வாயுவின் வெப்பநிலை குறைவதில்லை ஏனெனில் மூலக்கூறுகள்
அ) எதிர்மாறு வெப்பநிலையை விட அதிக வெப்பநிலையில் உள்ளது.
ஆ) ஒன்றுக்கொன்று கவர்ச்சி விசையை செலுத்துவதில்லை.
இ) இயக்க ஆற்றல் இழப்பிற்கு சமமான வேலையை செய்யும்.
ஈ) ஆற்றல் இழப்பின்றி மோதுகின்றன.
[விடை: ஆ) ஒன்றுக்கொன்று கவர்ச்சி விசையை செலுத்துவதில்லை.]
5) ஒரு காலியாகவுள்ள கலனில் 298K யில் சம எடையுள்ள மீத்தேன் மற்றும் ஆக்ஸிஜன் நிரப்பப்படுகின்றன. மொத்த அழுத்தத்தில் ஆக்ஸிஜன் மூலக்கூறு கொடுக்கும் அழுத்த பின்னம்.
அ) 1 / 3
ஆ) 1 / 2
இ) 2 / 3
ஈ) (1 / 3) × 273 × 298
[விடை: அ) 1/3]
தீர்வு:
மீத்தேனின் நிறை = ஆக்சிஜனின் நிறை = a
மீத்தேனின் மோல்களின் எண்ணிக்கை = a/16
ஆக்சிஜனின் மோல்களின் எண்ணிக்கை = a/32

ஆக்சிஜனின் பகுதி அழுத்தம் = மோல் பின்னம் × மொத்த அழுத்தம் = 1/3 P
6) இயல்பு வாயுக்கள் குறிப்பிட்ட அழுத்த வரம்பில் நல்லியல்பு வாயுக்களாக நடக்கும் வெப்பநிலை
அ) நிலைமாறு வெட்பநிலை
ஆ) பாயில் வெப்பநிலை
இ) எதிர்மாறு வெப்பநிலை
ஈ) குறைக்கப்பட்ட வெப்பநிலை
[விடை: ஆ) பாயில் வெப்பநிலை]
தீர்வு:
எந்த ஒரு குறிப்பிட்ட வெப்ப நிலையில் இயல்பு வாயுக்கள் குறிப்பிடத்தக்க அழுத்த எல்லையில் நல்லியல்புத்தன்மைக்கு உட்பட்டு செயல்படுகிறதோ அவ்வெப்பநிலை பாயில் வெப்பநிலை எனப்படும்.
7) 1000 மீ3 கனஅளவுள்ள மூடிய அறையில் ஒரு வாசனை திரவியபுட்டி திறக்கப்பட்டது. அறையில் நறுமணம் உண்டாகிறது. இதற்கு வாயுக்களின் எந்த பண்பு காரணமாக அமைகிறது?
அ) பாகுத்தன்மை
ஆ) அடர்த்தி
இ) விரவுதல்
ஈ) எதுவுமில்லை
[விடை: இ) விரவுதல்]
8) அம்மோனியா குடுவை மற்றும் HCl குடுவை இரண்டும் ஒரு நீண்டகுழாய் வழியே இணைக்கப்பட்டு இரண்டும் ஒரே நேரத்தில் திறக்கப்படுகின்றன. வெண்ணிற அம்மோனியம் குளோரைடு வளையம் முதன்முதலில் எங்கு உருவாகின்றது?
அ) குழாயின் நடுப்பகுதியில்
ஆ) ஹைட்ரஜன் குளோரைடு குடுவையருகில்
இ) அம்மோனியா குடுவையருகில்
ஈ) குழாயின் முழுநீளத்திலும் முழுமையாக
[விடை: ஆ) ஹைட்ரஜன் குளோரைடு குடுவையருகில்]
தீர்வு:
விரவுதல் வீதம் α 1/√M
MNH3 = 17; MHCl = 36.5
γ NH3 > γ HCl
எனவே வெண்புகை ஹைட்ரஜன் குளோரைடுக்கு அருகே முதலில் உருவாகிறது.
9) எதனைப் பொறுத்து வாயுமாறிலியின் மதிப்பு அமையும்?
அ) வாயுவின்வெப்பநிலை
ஆ) வாயுவின் கனஅளவு
இ) வாயுவின் மூலக்கூறுகளின் எண்ணிக்கை
ஈ) அழுத்தம் மற்றும் கனஅளவின் அலகுகள்
[விடை: ஈ) அழுத்தம் மற்றும் கனஅளவின் அலகுகள்.]
10) வாயுமாறிலியின் மதிப்பு
அ) 0.082 dm3 atm.
ஆ) 0.987 cal mol-1 K-1
இ) 8.3 J mol-1 K-1
ஈ) 8 erg mol-1K-1
[விடை: இ) 8.3 J mol−1 K−1]
11) வானியல் ஆய்வுமையங்களில் உபயோகப்படும் அதிக வெப்ப பலூன்களின் பயன்பாடு இவ்விதியின் அடிப்படையில் அமைகிறது.
அ) பாயிலின் விதி
ஆ) நியூட்டனின் விதி
இ) கெல்வினின் விதி
ஈ) பிரௌனின் விதி
[விடை: அ) ) பாயிலின் விதி]
12) வாயுக்களின் வாண்டர் வால்ஸ் மாறிலி aயின் மதிப்பு (dm3)2 atm. mol-2- ல் கீழ்க்கண்டுள்ள அட்டவணையில் கொடுக்கப்பட்டுள்ளது
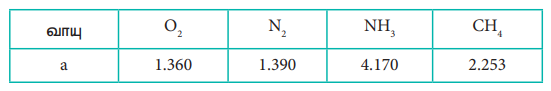
மிக எளிதாக திரவமாக்கப்படும் வாயு
அ) O2
ஆ) N2
இ) NH3
ஈ) CH4
[விடை: இ) NH3]
தீர்வு:
‘a’ ன் மதிப்பு அதிகமாக உள்ள போது மூலக்கூறுகளுக்கு இடையேயான கவர்ச்சி விசை அதிகரிக்கிறது. திரவமாக்குதல் எளிதாகிறது. வாய்ப்பு (இ) சரியானது.
13) கீழ்காணும் கூற்றுகளை கருதுக
i) காற்றழுத்தம் கடல் மட்டத்தினை விட மலை உச்சியில் குறைவு.
ii) வாயுக்கள் திட மற்றும் திரவங்களை விட அதிக அளவில் அழுத்தத்திற்கு உட்படுகின்றன.
iii) காற்றின் வளிமண்டல அழுத்தம் அதிகரிக்கும் போது பாதரசமட்டம் அதிகரிக்கின்றது.
சரியான கூற்றினை தேர்ந்தெடுக்கவும்
அ) I மற்றும் II
ஆ) II மற்றும் III
இ) I மற்றும் III
ஈ) I, II மற்றும் III
[விடை: ஈ) I, II மற்றும் III]
14) 400K ல் 71.0 barல் CO2ன் அமுக்கதிறன் காரணி 0.8697 இந்த நிலையில் CO2ன் மோலார் கனஅளவு
அ) 22.04 dm3
ஆ) 2.24 dm3
இ) 0.41 dm3
ஈ) 19.5 dm3
[விடை: இ) 0.41 dm3]
தீர்வு:
அமுக்கத்திறன் காரணி (z) = PV/nRT
V = (Z × nRT)/p
V = (0.8697 × 1 × 8.314 × 10−2 × 400) / 71bar = 0.41 dm3

15) ஒரு நல்லியல்பு வாயுவின் வெப்பநிலை மற்றும் கனஅளவு இருமடங்காக அதிகரிக்கும் போது அதன் ஆரம்ப அழுத்தத்தின் மாற்றம்
அ) 4P
ஆ) 2P
இ) P
ஈ) 3P
[விடை: இ) P]
தீர்வு:

P2 = P1 வாய்ப்பு (இ)
16) ஒரு சமவெப்ப அழுத்த நிலையில் CnH2n-2 என்ற மூலக்கூறு வாய்ப்பாடு கொண்ட ஹைட்ரோகார்பன் போன்று ஹைட்ரஜன் வாயு 3√3 மடங்கு விரவுதல் வீதம் கொண்டதெனில் 'n' ன் மதிப்பு என்ன?
அ) 8
ஆ) 4
இ) 3
ஈ) 1
[விடை: ஆ) 4]
தீர்வு:
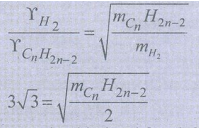
இருபுறமும் வர்க்கப்படுத்தி மாற்றியமைக்க
27 × 2 = mCnH2n−2
54 = n(12) + (2n−2) (1)
54 =12n + 2n − 2.
54 = 14n − 2
n = (54 + 2)/ 14 = 56 / 14 = 4
17) ஒரு கலனில் சம எண்ணிக்கையுள்ள ஹைட்ரஜன் மற்றும் ஆக்ஸிஜன் மோல்கள் ஒரு துளை வழியே வெளியேறுகின்றன. பாதியளவு ஹைட்ரஜன் வெளியேற தேவைப்படும் அதே நேரத்தில் விரவும் ஆக்ஸிஜனின் பின்ன அளவு (NEET Phase I)
அ) 3 / 8
ஆ) 1 / 2
இ) 1 / 8
ஈ) 1 / 4
[விடை: இ) 1/8]
தீர்வு:
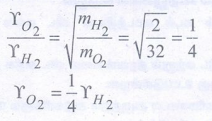
பாதியளவு ஹைட்ரஜன் வெளியேற தேவைப்படும் அதே நேரத்தில் பரவும் ஆக்ஸிஜனின் பின்ன அளவு 1/8ஆகும்.
18) மாறாத அழுத்தத்தில் வெப்பநிலை மாற்றத்தால் ஏற்படும் கனஅளவு மாற்றம் கனஅளவின் ஒப்பீட்டு அதிகரிப்பு ஆகும். அதாவது α = (1 / V) (∂V / ∂T )P. நல்லியல்பு வாயுக்களுக்கான α மதிப்பு
அ) T
ஆ) 1 / T
இ) P
ஈ) ஏதும் இல்லை
[விடை: ஆ) 1/T ]
தீர்வு:

19) P, Q, R மற்றும் S என்ற நான்கு வாயுக்களின் b யின் மதிப்பு சமம் ஆனால் a யின் மதிப்பு Q < R < S < P, a மற்றும் b வாண்டர் வால்ஸ் மாறிலிகள் குறிப்பிட்ட வெப்பநிலையில் நான்கு வாயுக்களுள் எளிதில் ஆவியாகும் வாயு
அ) P
ஆ) Q
இ) R
ஈ) S
[விடை: அ) P]
தீர்வு:
'a' ன் மதிப்பு அதிகமாகும் பொழுது திரவமாக்கல் எளிதாகும்.
20) நல்லியல்பு பண்பிலிருந்து அதிக விலக்கம் அடையும் வாயு (NEET)
அ) CH4 (g)
ஆ) NH3 (g)
இ) H2 (g)
ஈ) N2 (g)
[விடை: ஆ) NH3(g)]
21) வாண்டர் வால்ஸ் மாறிலிகள் b மற்றும் a யின் அலகுகள் முறையே
அ) mol L-1 மற்றும் L atm2 mol-1
ஆ) mol L மற்றும் L atm mol2
இ) mol-1 L மற்றும் L2 atm mol-2
ஈ) இவை எதுவுமில்லை
[விடை: இ) mol−1 L மற்றும் L2 atm mo1−2 ]
தீர்வு:
an2/V2 = atm
a = atm L2/mol2 = L2mol−2atm
nb = L
b = L/mol = L mol−1
22) கூற்று: CO2 வின் நிலைமாறு வெப்பநிலை 304 K. இதனை அதிக அழுத்ததிற்கு உட்படுத்தி 304 Kக்கு மேல் திரவமாக்க முடியும்.
காரணம்:- மாறாத வெப்பநிலையில் கொடுக்கப்பட்டுள்ள நிறையுள்ள வாயுவின் கனஅளவு அதன் அழுத்தத்திற்கு நேர்விகிதத்தில் அமையும்
அ) கூற்று மற்றும் காரணம் இரண்டும் சரி. காரணமானது கூற்றிற்கு சரியான விளக்கம் ஆகும்.
ஆ) கூற்று மற்றும் காரணம் இரண்டும் சரி ஆனால் காரணம் கூற்றிற்கான சரியான விளக்கமல்ல.
இ) கூற்று சரி ஆனால் காரணம் தவறு.
ஈ) கூற்று மற்றும் காரணம் இரண்டும் தவறு.
[விடை: ஈ) கூற்று மற்றும் காரணம் இரண்டும் தவறு.]
தீர்வு:
சரியான கூற்றுகள்
1. CO2ன் மதிப்பு நிலைமாறு வெப்பநிலை 304K. இதனை எவ்வளவு அழுத்தம் அளிக்கப்படினும், 304Kக்கு மேல் திரவமாக்க இயலாது.
2. மாறாத வெப்பநிலையில் கொடுக்கப்பட்டுள்ள நிறையுள்ள வாயுவின் கனஅளவு அதன் அழுத்தத்திற்கு எதிர் விகிதத்தில் அமையும்.
23) 227° C யில் 5.00 atm அழுத்தத்திலுள்ள N2 வாயுவின் அடர்த்தி என்ன?
அ) 1.40 g / L
ஆ) 2.81 g / L
இ) 3.41 g / L
ஈ) 0.29 g / L
[விடை: இ) 3.41g/L ]
தீர்வு:
d = PM/RT
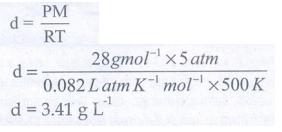
d = 3.14 g L−1
24) கீழ்கண்டவற்றுள் குறிப்பிட்ட எடையுள்ள நல்லியல்பு வாயுவின் பண்புகளைக் சரியாகக் குறிக்கும் படம் எது
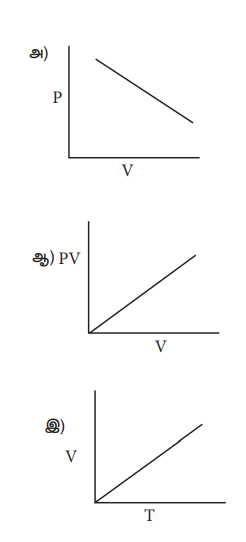
ஈ) அனைத்தும்
[விடை:  ]
]
தீர்வு:
ஒரு குறிப்பிட்ட நிறையுடைய நல்லியல்பு வாயுவிற்கு
V α T
P α 1/ V
மற்றும் PV = மாறிலி
25) 25 கிராம் நிறையுள்ள கீழ்கண்ட வாயுக்கள் 27°யில் 600 mm Hg அழுத்தத்தில் எடுக்கப்பட்டு உள்ளன. இவற்றில் குறைந்த கனஅளவு கொண்ட வாயு எது?
அ) HBr
ஆ) HCl
இ) HF
ஈ) HI
[விடை: ஈ) HI]
தீர்வு:
கொடுக்கப்பட்டுள்ள வெப்பநிலை மற்றும் அழுத்தத்தில்
கனஅளவு α மோல்களின் எண்ணிக்கை
கனஅளவு α நிறை / மோலார் நிறை
கனஅளவு α 25 / மோலார் நிறை
அதாவது மோலார் நிறை அதிகம் எனில், கனஅளவு குறைவு எனவே HI ஆனது குறைவான கன அளவைப் பெற்றுள்ளது.