11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
நல்லியல்பு வாயுச்சமன்பாடு
நல்லியல்பு வாயுச்சமன்பாடு
T, P, V மற்றும் n ஆகிய நான்கு மாறிகளைக் கொண்டு, வாயு நிலைமையினை முழுமையாக விவரிக்க இயலும். இவற்றிற்கு இடையேயானத் தொடர்பினை இதுவரை பயின்ற வாயுவிதிகளைக் கொண்டு அறியலாம்.
பாயில்விதி V α (1 / P)
சார்லஸ்விதி V α T
அவகாட்ரோவிதி V α n
மேற்கண்டுள்ள சமன்பாடுகளை இணைப்பதன் மூலம், அனைத்து வாயுக்களின் இயற்பண்புகளை விவரிக்க உதவும் பின்வரும் பொதுவான சமன்பாட்டினை நாம் உருவாக்கலாம்.
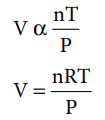
இங்கு R என்பது வாயுமாறிலி என்றழைக்கப்படும் விகிதமாறிலியாகும்.
மேற்கண்டுள்ள சமன்பாட்டினை மாற்றியமைத்தால் நல்லியல்பு வாயுச்சமன்பாடு உருவாகிறது.
PV = nRT ---------- (6.11)
அழுத்தமானது, வெவ்வேறு அலகுகளில் குறிப்பிடப்படுகிறது (அட்டவணை 6.1) என நாம் ஏற்கனவே அறிவோம். எனவே, வாயுமாறிலியின் மதிப்பினை வெவ்வேறு அலகுகளில் தெரிந்திருக்க வேண்டியது அவசியமாகும்.
Rன் மதிப்பினை பின்வரும் சமன்பாட்டினை பயன்படுத்தி நாம் கணக்கிடலாம்.
R = PV / nT
P ன்மதிப்பு 1 atm, கனஅளவு 22.414 dm3 மற்றும் வெப்பநிலை 273.15K ஆக உள்ள போது 1 மோல் வாயுவிற்கு,
R = (1 atm. × 22.414 dm3) / (1 mol. × 273.15 K)
= 0.0821 dm3 atm. mol-1 K−1
திட்ட வெப்ப அழுத்த நிலைகளில் (STPல்) P = 1 bar (105 Pascal) வெப்ப நிலை 273.15 K ல் 1 மோல் வாயு அடைத்துக் கொள்ளும் கனஅளவு V = 22.71 × 10-3 m3
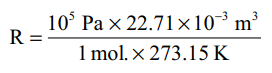
= 8.314 Pa m3 K-1 mol-1
= 8.314 × 10-5 bar m3 K-1 mol-1
= 8.314 × 10-2 bar dm3 K-1 mol-1
= 8.314 × 10-2 bar L K-1 mol-1
= 8.314 J K-1 mol-1
நல்லியல்பு வாயுச்சமன்பாடானது P, V, T மற்றும் n ஆகிய நான்கு மாறிகளுக்கு இடையேயான தொடர்பினைத் தருவதால் இச்சமன்பாடு வாயுக்களின் நிலைமைச் சமன்பாடு எனவும் அழைக்கப்படுகிறது.
70° C ல் 6 dm3 கனஅளவுடைய ஒரு எஃகு கலனில் உள்ள 2 மோல் சல்பர் ஹெக்ஸா புளுரைடின் அழுத்தத்தினை, அவ்வாயுவினை நல்லியல்பு வாயுவாகக்கருதி நாம் கணக்கிடுவோம்.
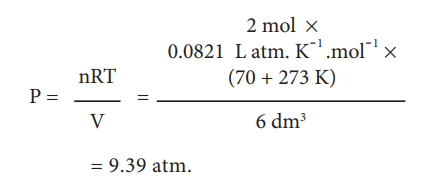
= 9.39 atm.
தன்மதிப்பீடு
5) 8°C மற்றும் 6.4 atm வெப்ப அழுத்த நிலை காணப்படும் ஒரு ஏரியின் அடிப்பரப்பிலிருந்து ஒரு சிறிய நீர்க்குமிழி மேலெழும்பி நீரின் மேற்பரப்பிற்கு செல்கிறது, நீரின் மேற்பரப்பில் வெப்பநிலை 25°C மற்றும் அழுத்தம் 1 atm. நீர்க்குமிழியின் ஆரம்ப கனஅளவு 2.1 mL எனில் அதன் இறுதி கனஅளவை (mL ல்) கணக்கிடுக,
தீர்வு:
T1 = 8°C = 8 + 273 = 281K
T2 = 25°C = 25 + 273 = 298K.
P1 = 6.4 atm
P2 =1atm
V1 = 2.1mol
V2 = ?
