11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
பின்வரும் வினாக்களுக்கு சுருக்கமாக விடையளி
II. பின்வரும் வினாக்களுக்கு சுருக்கமாக விடையளி
26) பாயிலின் விதியினை தருக
ஒரு குறிப்பிட்ட வெப்பநிலையில், குறிப்பிட்ட நிறையுள்ள வாயு அடைத்துக் கொள்ளும் கனஅளவானது அதன் அழுத்தத்திற்கு எதிர்விகித தொடர்பைப் பெற்றுள்ளன. மாறா T, Vα1/p (அல்லது) PV= மாறிலி.
27) கேலூசாக் விதிக்கு எடுத்துக்காட்டாக விளங்கும் இரு மாதிரிகளின் பெயர்களைத் தந்து விளக்குக
1. காற்றில் ஐந்தில் ஒரு பங்கு ஆக்சிஜன் உள்ளது என்பதை நிரூபிக்கும் மெழுகுவர்த்தி சோதனை.
2. வேக வைத்த முட்டையை குப்பியின் விளிம்பில் வைக்கப்படும் சோதனை.
28) ஒரு வாயுவின் கனஅளவு மற்றும் மோல்களை தொடர்புபடுத்தும் கணிதமுறை வாய்பாட்டினை தருக
கனஅளவு மற்றும் மோல்களை தொடர்புள்ள சமன்பாடு V α n
இச்சமன்பாடு அவகேட்ரோ கருதுகோளாகும்.
29) நல்லியல்பு வாயுக்கள் என்பன யாவை? இயல்பு வாயுக்கள் நல்லியல்பு வாயுக்களிலிருந்து எவ்வாறு வேறுபடுகின்றன.?
அனைத்து வெப்ப அழுத்த நிலைகளிலும் வாயுச் சமன்பாடு PV = nRTக்கு உட்பட்டு செயல்படும் வாயுக்கள் நல்லியல்பு வாயுக்கள் எனப்படும்.
அதிக அழுத்தம் மற்றும் குறைந்த வெப்பநிலையில் இயல்பு வாயுக்கள் நல்லியல்பு வாயுக்களிலிருந்து வேறுபடுகின்றன.
30) a = 0 என்ற வாண்டர் வால்ஸ் மாறிலியைக் கொண்ட வாயுவினை திரவமாக்க முடியுமா? விவரி
a = 0 என்ற வாண்டர் வால்ஸ் மாறிலியைக் கொண்ட வாயுவினை திரவமாக்க முடியாது. வாயு மூலக்கூறுகளுக்கிடையே எந்த கவர்ச்சி விசையும் இல்லை என்பதை a = 0 உணர்த்துகிறது. எனவே, வாயுவை திரவமாக்க முடியாது.
31) ஒரு வாயு உள்ள கலனின் சுவரில் மிகச்சிறிய பசைத் தன்மை கொண்ட ஒரு பரப்பு உள்ளதெனக் கருதவும். இப்பரப்பில் மோதும் மூலக்கூறுகள் அங்கு நிரந்தரமாக ஒட்டிக் கொள்கின்றன. இப்பரப்பில் அழுத்தம் மற்றும் மற்ற இடங்களை விட அதிகமாக இருக்குமா அன்றி குறைவாக இருக்குமா?
சுவரின் மற்ற இடங்களை விட மூலக்கூறுகள் ஒட்டிக் கொண்ட பரப்பில் அழுத்தம் அதிகமாக இருக்கும். (வாயுக்களின் இயக்கவியற் கொள்கைபடி)
32) கீழ்கண்டவற்றிற்கு உரிய விளக்கங்கள் தருக
அ) கோடைக்காலத்தில் காற்றேற்றப்பட்ட குளிர்பானப் புட்டிகள் நீரினுள் வைக்கப்பட்டிருக்கும்
ஆ) திரவ அம்மோனியா அடைக்கப்பட்டுள்ள புட்டிகள் திறக்கப்படும் முன் குளிர்விக்கப்படும்
இ) மோட்டார் வாகன எந்திரங்களின் உருளைகளில் (tyres) கோடையில் குளிர்காலத்தை விடகாற்று குறைவாக நிரப்பப்பட்டிருக்கும்.
ஈ) வானியல் ஆய்வு பலூனின் அளவு உயரமாக மேலே செல்லச் செல்ல பெரியதாக மாறும்.
அ. கோடைக்காலத்தில் காற்றேற்றப்பட்ட குளிர்பான புட்டிகள் நீரினுள் வைக்கப்பட்டிருக்கும்.
• கோடைக்காலத்தில் வெப்பநிலை அதிகரிப்பதால், குளிர்பானப்புட்டியில் அழுத்தம் அதிகரிக்கிறது. (கேலூசாக் விதிப்படி) அழுத்தம் அதிகரிப்பதால் புட்டி வெடிக்க வாய்ப்புள்ளது. புட்டி வெடிக்காமல் தவிர்க்க குளிர்பான புட்டிகள் நீரினுள் வைக்கப்படுகின்றன.
ஆ. திரவ அம்மோனியா அடைக்கப்பட்டுள்ள புட்டிகள் திறக்கப்படும் முன் குளிர்விக்கப்படும்.
• அறை வெப்பநிலையில் திரவ அம்மோனியாவின் ஆவி அழுத்தம் அதிகம்.
• குளிர்விக்கும் போது ஆவி அழுத்தம் குறைகிறது. (கேலூசாக் விதிப்படி)
• ஆதலால் புட்டியை திறக்கும்போது திரவ அம்மோனியா வெளியே தெளிக்காது.
இ. மோட்டார் வாகன எந்திரங்களின் உருளைகளில் (tyres) கோடையில் குளிர்காலத்தை விட காற்று குறைவாக நிரப்பப்பட்டிருக்கும்.
• கோடைக்காலத்தில் வெப்பநிலை அதிகம்.
• வெப்பநிலை அதிகரிப்பதால் டயரிலுள்ள டியூப்பில் இயக்க ஆற்றல் அதிகரிக்கிறது.
• அழுத்தம் அதிகரிப்பதால் டயர் வெடிக்கும் நிலை உருவாகும்
• இதை தவிர்க்க, குறைந்த அளவு காற்று நிரப்பப்பட்டிருக்கும்.
ஈ. வானியல் ஆய்வு பலூனின் அளவு உயரமாக மேலே செல்லச்செல்ல பெரியதாக மாறும்.
• வானியல் பலூன் உயரமாக செல்லச்செல்ல அழுத்தம் குறைகிறது.
• அதன் விளைவால், பலூனில் உள்ள வாயுவின் கனஅளவு அதிகரிக்கிறது. (பாயில் விதிப்படி)
33) வாயுக்கள் பற்றிய கீழ்கண்ட உண்மைகளுக்கு சரியான விளக்கம் தருக
அ) வாயுக்கள் கலனின் அடிப்பரப்பில் தங்குவதில்லை.
ஆ) வாயுக்கள் தமக்குக் கொடுக்கப்பட்டுள்ள வெளியில் பரவுகின்றன.
அ. வாயுக்கள் கலனில் அடிப்பரப்பில் தங்குவதில்லை.
வாயுக்கள் குறைந்த அடர்த்தி பெற்றுள்ளது. வாயு மூலக்கூறுகளுக்கிடையே கவர்ச்சி விசை இல்லை. ஆதலால், வாயுக்கள் கலனின் அடிப்பரப்பில் தங்குவதில்லை.
ஆ. வாயுக்கள் தமக்குக் கொடுக்கப்பட்டுள்ள வெளியில் பரவுகின்றன
ஒவ்வொரு வாயு மூலக்கூறும் குறிப்பிட்ட கனஅளவை அடைத்துக் கொள்வதில்லை.
எனவே, மூலக்கூறுகளுக்கிடையே கவர்ச்சி விசை மிகக் குறைவு. ஆதலால், இயக்க ஆற்றல் அதிகரிப்பதால், மூலக்கூறுகள் தங்கு தடையின்றி இயங்குகின்றன.
34) நமது வளிமண்டலத்தில் ஹைட்ரஜன் (H2) இல்லை. ஏன்? நிலவில் வளிமண்டலம் ஏன் இல்லை?
• ஹைட்ரஜன் லேசான வாயு மற்றும் அதிக வினை புரியும் தன்மை உடையது.
• வளிமண்டலத்தில் பெரும்பாலான ஹைட்ரஜன் ஆக்சிஜனுடன் வினைபுரிந்து விடுவதால் மிகக் குறைந்த அளவே ஹைட்ரஜன் வளிமண்டலத்தில் மேல் பகுதியில் இடம் பெறலாம்.
• நிலவில் g மதிப்பு குறைவு.
• வாயு மூலக்கூறுகளுக்கு விடுபடு திசைவேகம் நிலவை விட அதிகமாக இருப்பதால் அனைத்து வாயு மூலக்கூறுகளும் எளிதில் வெளியேறிவிடும். எனவே, நிலவில் வளிமண்டலம் இல்லை.
35) பின்வரும் நிபந்தனைகளில் ஒரு வாயு நல்லியல்பு பண்பினை பெறுகிறதா அல்லது நல்லியல்பு பண்பிலிருந்து விலகிச் செல்கிறதா என விவரி?
அ) மாறா வெப்ப நிலையில் அது மிகச்சிறிய கனஅளவிற்கு அழுத்தப்படும் போது
ஆ) மாறா கனஅளவில் அதன் வெப்பநிலையை உயர்த்தும் போது
இ) சமவெப்ப மற்றும் சமகனஅளவு நிலையில் அதிக அளவு வாயு சேர்க்கப்படும் போது
அ. மாறா வெப்பநிலையில் அது மிகச்சிறிய கனஅளவிற்கு அழுத்தப்படும்போது:
ஒரு வாயு நல்லியல்பு பண்பிலிருந்து விலகிச் செல்கின்றது. ஏனெனில், ஒவ்வொரு மூலக்கூறும் ஒரு குறிப்பிட்ட கனஅளவை அடைத்துக் கொள்கிறது.
ஆ. மாறா கனஅளவில் அதன் வெப்பநிலையை உயர்த்தும் போது :
வாயு மூலக்கூறுகளின் இயக்க ஆற்றல் அதிகரிக்கின்றன. எனவே,வாயு நல்லியல்பு பண்பினை பெறுகிறது.
இ. சமவெப்ப மற்றும் சம கனஅளவு நிலையில் அதிக அளவு வாயு சேர்க்கப்படும் போது:
கலனில் அதிக அளவு வாயுவை சேர்க்கும்போது வாயு மூலக்கூறுளின் நகருதல் தடைபடுகின்றன. எனவே ஒவ்வொரு தனித்த வாயு மூலக்கூறும் ஒரு குறிப்பிட்ட கனஅளவை அடைத்து கொள்கின்றது. எனவே, வாயு நல்லியல்பு பண்பிலிருந்து விலகிச் செல்கின்றது.
36) கொடுக்கப்பட்டுள்ள குறைந்த வெப்பநிலையில் கீழ்கண்டவற்றுள் எந்த வாயு நல்லியல்பு வாயுவிலிருந்து விலகும் F2, Cl2 அல்லது Br2? விளக்குக
• குறைந்த வெப்பநிலையில் புரோமின் (Br2) நல்லியல்பு வாயுவிலிருந்து விலகுகிறது.
• Br2 மூலக்கூறு நிறை அதிகம். ஆதலால் மூலக்கூறுக்கு இயக்க ஆற்றல் குறைவு.
37) விரவுதல் மற்றும் பாய்தல் வேறுபாடு தருக.
விரவுதல்
ஒரு வாயுவின் மூலக் கூறுகள் மற்றொரு வாயுவின் வழியே நகரும் பண்பானது விரவுதலாகும்.
பாய்தல்
ஒரு கலனில் உள்ள வாயுவானது ஒரு மிகச்சிறிய துளையின் வழியே வெளியேறும் நிகழ்வு பாய்தலாகும்.
38) காற்று கரைசல்கள் கொண்ட கலன்கள் வெப்பப்படுத்துவதைப் பற்றிய தெளிவான எச்சரிக்கை கொண்டிருக்கும் ஏன்?
வெப்பப்படுத்தும் போது கலனில் அழுத்தம் அதிகரிக்கும் அழுத்தம் அதிகரிப்பதால் கலன் வெடிக்கலாம். இதை தவிர்க்க காற்றுக்கரைசல்கள் கொண்ட கலனில் எச்சரிக்கை கொடுக்கப்பட்டுள்ளது.
39) எவரெஸ்ட் மலையின் உச்சியின் மீதுள்ள ஒருவர் உறிஞ்சி (Straw) கொண்டு நீரினை உறிஞ்சுவது எளிதா?
எவரெஸ்ட் மலையின் உச்சியில் காற்று அழுத்தம் மிகக் குறைவு. ஆதலால், வாயின் மூலம் உறிஞ்சியால் நீரை உறிஞ்சி இழுக்க முடியாது. எனவே, ஒருவர் உறிஞ்சியை கொண்டு நீரினை உறிஞ்சுவது கடினம்.
40) இயல்பு வாயுக்களின் வாண்டர் வால்ஸ் சமன்பாடுகளைத் தருக. அழுத்தம் மற்றும் கனஅளவின் திருத்தங்களையும் தருக.
இயல்பு வாயுக்களின் வாண்டர்வால்ஸ் சமன்பாடு
[P + an2 /v2] (V − nb) = nRT
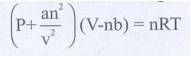
அழுத்தத்திற்கான திருத்தம் :
• வாயுவின் அழுத்தமானது, அவ்வாயு மூலக்கூறுகள் கொள்கலனில் சுவற்றின் மீது மோதுவதால் ஏற்படும் விசைக்கு நேர்விகிதத் தொடர்புடையது.
• கொள்கலனின் சுவற்றினை நோக்கிச் செல்லும் ஒருவாயு மூலக்கூறின் வேகமானது அம்மூலக்கூறினை சூழ்ந்துள்ள பிறவாயு மூலக்கூறுகளின் கவர்ச்சி விசையினால் குறைக்கப்படுகிறது.
• எனவே அளந்தறியப்பட்ட அழுத்தமானது. வாயுவின் நல்லியல்பு அழுத்தத்தை விட குறைவானதாகும். எனவே இவ்விளைவிற்கான ஒரு திருத்தத் தினை வாண்டர் வால்ஸ் அறிமுகப்படுத்தினார்.
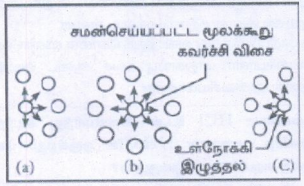
கொள்கலனின் சுவற்றிற்கு அருகே உள்ள ஒரு மூலக்கூறு உணரும் கவர்ச்சி விசையானது வாயுவின் அடர்த்திக்கு நேர்விகிதத்தில் இருக்கும் என வாண்டர் வால்ஸ் கண்டறிந்தார்.
P’α ρ2
ρ = n/V
இங்கு n என்பது வாயுக்களின் மோல்களின் எண்ணிக்கை V என்பது கொள்கலனின் கனஅளவு
⇒ P’α n2/V2
⇒ P’ = α n2/V2
இங்கு a என்பது விகிதமாறிலி, இது வாயுவின் இயல்பினைப் பொருத்து அமையும்.
எனவே, Pநல்லியல்பு = p + (an2/V2)
கன அளவிற்கான திருத்தம் :
• ஒவ்வொரு தனித்த வாயு மூலக்கூறும் ஒரு குறிப்பிடத்தக்க கனஅளவை அடைத்துக் கொள்வதால், வாயு அடங்கிய கொள்கலனின் கன அளவினை (V) க்காட்டிலும், வாயுவின் உண்மையான கனஅளவு குறைவானதாகும்.
• இவ்விளைவிற்கான வாண்டர் வால்ஸ் திருத்தக் காரணி V ஐ அறிமுகப்படுத்தினார். வாயு மூலக்கூறுகளை கோளவடிவில் இருப்பதாக கருத்திற் கொண்டு, திருத்தக் காரணியை நாம் கணக்கிடலாம்.
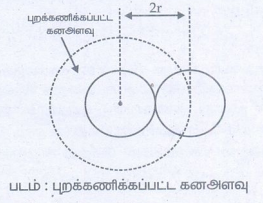
V = புறக்கணிக்கப்பட்ட கனஅளவு
இரு மூலக்கூறுகளுக்கான புறக்கணிக்கப்பட்ட கனஅளவு

ஒரு தனித்த மூலக்கூறுக்கான புறக்கணிக்கப்பட்ட கனஅளவு
= 8Vm /2 = 4Vm
n மூலக்கூறுகளுக்கான புறக்கணிக்கப்பட்ட கனஅளவு இங்கு b என்பது வாண்டர் வால்ஸ் மாறிலி இது
4Vm ற்குச் சமம்.
Vநல்லியல்பு = V − nb …………
41) வாண்டர் வால்ஸ் மாறிலிகளைக் கொண்டு நிலைமாறு மாறிலிகளைத் தருவி.
n மோல் வாயுவிற்கான வாண்டர் வால்ஸ் சமன்பாடு,
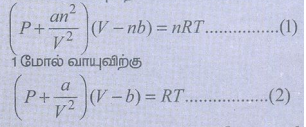
மேற்கண்டுள்ள சமன்பாட்டிலிருந்து, நிலைமாறு மாறிலிகள் Pc , Vc மற்றும் Tc ன் மதிப்புகளை வாண்டர் வால்ஸ் மாறிலிகள் a மற்றும் bன் வாயிலாக தருவிக்கலாம். மேற்கண்டுள்ள சமன்பாட்டினை விரிவாக்க,

Vன் அடுக்காக மேற்கண்டுள்ள சமன்பாட்டினை விரிவாக்கும் போது
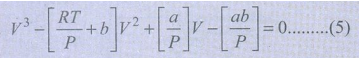
இச்சமன்பாடானது, (5) Vல் அமைந்த முப்படிச் சமன்பாடாகும். இச்சமன்பாட்டினைத் தீர்க்கும் போது நாம் மூன்று தீர்வுகளைப் பெறலாம். நிலைமாறு நிலையில் Vன் இம்மூன்று மதிப்புகளும் நிலைமாறு கனஅளவு Vக்குச் சமம். மேலும் அழுத்தம் மற்றும் வெப்பநிலைகள் Pc மற்றும் Tc க்குச் சமம்.
i.e, V = VC
V – VC = 0
(V – VC)3 = 0
v3 − 3VCV2 + 3VC2V – VC3 ..........(6)
(5) மற்றும் (6) ஆகிய இருசமன்பாடுகளும் ஒன்றே என்பதால், அவற்றில் உள்ள V2, V ஆகியவற்றின் குணகங்கள் மற்றும் மாறிலி மதிப்புகளை நாம் சமப்படுத்தலாம்.
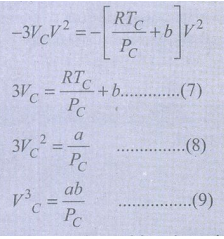
சமன்பாடு (9) ஐ சமன்பாடு (8) ஆல் வகுக்க
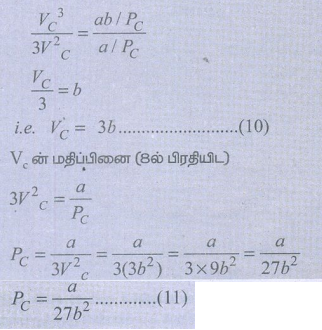
VC மற்றும் PC ன் மதிப்புகளைச் சமன்பாடு (7) ல்பிரதியிட
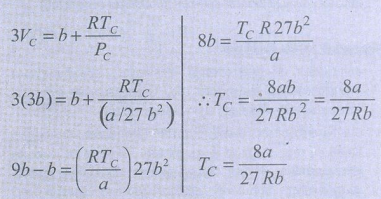
42) நிலவின் பரப்பின் மீதுள்ள ஒரு விண்வெளி ஆராய்ச்சியாளர் பாதுகாப்பு கவச ஆடை அணிய வேண்டியது அவசியம் ஏன்?
நிலவின் பரப்பில் சுவாசிப்பதற்கு ஆக்சிஜன் இல்லை. மேலும் காற்று அழுத்தம் இல்லை. அதிக குளிர் மற்றும் ஆபத்தான கதிர்வீச்சுகள் உள்ளன.
இந்த பாதிப்பிலிருந்து தவிர்த்துக் கொள்ள விண்வெளி ஆராய்ச்சியாளர் பாதுகாப்பு கவச ஆடை அணிய வேண்டியது அவசியமாகிறது.
43) அம்மோனியா HCl உடன் வினைபுரிந்து அடர்ந்த வெண்ணிற புகையான NH4Cl ஐ தருகிறது. புகை HClக்கு அருகில் தோன்றுவது ஏன்?
HCl−யை விட அம்மோனியாவின் விரவுதல் அதிகம். ஏனெனில், அம்மோனியா குறைந்த மூலக்கூறு நிறை பெற்றுள்ளது. எனவே, நிறைய புகை HCl−க்கு அருகில் தோன்றுகிறது. (கிரஹாமின் வாயு விரவுதல் விதிப்படி).
44) ஒரு வாயு 15°C யில் 1 atm அழுத்தத்தில் பெற்றுள்ள கனஅளவு 2.58 dm3 வெப்பநிலை 38°C யாக 1 atm அழுத்தத்தில் உயர்ந்தால் அதன் கனஅளவு அதிகரிக்குமா? எனில் அதன் இறுதி கனஅளவைக் கணக்கிடு
தீர்வு:
T1 =15°C + 273 = T1 = 288K
T2 = 38 + 273 = 311K
V1 = 2.58dm3 V2 = ?
(P = 1atm மாறிலி)
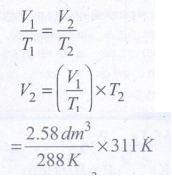
V2 = 2.78dm3
அதாவது கனஅளவு 2.58 dm3 லிருந்து 2.78 dm3 ஆக அதிகரிக்கிறது.
45) ஒரு குறிப்பிட்ட வெப்பநிலையில் வாயு ஒன்றின் கனஅளவு 3.8 dm3 ஆகும். அதனை O°C யில் உள்ள பனிக்கட்டி நீரில் மூழ்க வைக்கும் போது அதன் கனஅளவு 2.27 dm3 எனில் அதன் ஆரம்ப வெப்பநிலை என்ன.
தீர்வு:
V1 = 3.8 dm3
V2 = 2.27 dm3
T1 = ?
T2 = 0°C = 273 K
V1/T1 = V2/T2
T1 = V × [T2/V2]
T1 = 3.8 dm3 × 273K /2.27 dm3
T1 = 457.00 K
46) நைட்ரஜன் வாயுவின் இரு வேறுமாதிரிகளுள் ஒன்று A 1.5 மோல்கள், 37.6 dm3 கனஅளவுள்ள கலனில் 298 K ல் வைக்கப்பட்டுள்ளது. மற்றொன்று B 16.5 dm3 கனஅளவுள்ள கலனில் 298 K ல் வைக்கப்பட்டுள்ளது. மாதிரி B யில் உள்ள மோல்களின் எண்ணிக்கையைக் கணக்கிடுக.
தீர்வு:
nA = 1.5mol
nB = ?
VA = 37.6 dm3
VB = 16.5 dm3
(T = 298K மாறிலி)
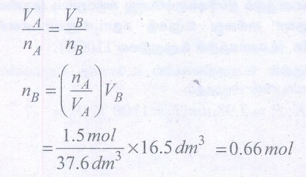
= 0.66 mol
47) சல்பர் ஹெக்சாகுளோரைடு ஒரு நிறமற்ற மணமற்ற வாயு. அது நல்லியல்பு தன்மை உடையதாக கருதி 5.43 dm3 கனஅளவுள்ள ஒரு எஃகு கலனில் 69.5° Cல் 1.82 மோல் கொண்ட வாயுவின் அழுத்தத்தினைக் கணக்கிடுக.
தீர்வு:
n = 1.82 mole
V = 5.43dm3
T = 69.5 + 273 = 342.5K
P = ?

P = 9.425 atm
48) ஆர்கான் ஒரு மந்தவாயு. இது மின்விளக்குகளில் டங்ஸ்டன் இழை ஆவியாவதைத் தடுக்க பயன்படுகிறது. மாறா கனஅளவில் உள்ள ஒரு மின் விளக்கில் 18°Cயில் 1.2 atmல் உள்ள ஆர்கான் வாயு 85°Cக்கு வெப்பப்படுத்தப்படுகிறது. அதன் இறுதி அழுத்தத்தினை (atmல்) கணக்கிடுக.
தீர்வு:
P1 = 1.2 atm
T1 =18°C + 273 = 291K
T2 = 85°C + 273 = 358 K
P2 = ?
P1 /T1 = P2/T2
P2 = [P1 /T1] × T2
= (1.2 atm/291K) × 358 K
P2 = 1.48 atm
49) ஏரி ஒன்றில் ஒரு சிறிய குமிழி 6°C மற்றும் 4 atm உள்ள அடிப்புறத்தில் இருந்து 25°C மற்றும் 1 atm உள்ள மேற்பரப்பிற்கு வருகின்றது. அதன் ஆரம்ப கனஅளவு 1.5 ml எனில் இறுதி கனஅளவினை கண்டறிக.
தீர்வு:
T1 = 6°C + 273 = 279K
P1 = 4atm
V1 = 1.5 ml
T2 = 25°C + 273 = 298 K
P2 = 1atm
V2 = ?

V2 = 6.45mol
50) ஒரு உலோகத்தினை ஹைட்ரோகுளோரிக் அமிலத்துடன் வினைபுரியச் செய்யும் போது ஹைட்ரஜன் உருவாகிறது. ஒரு மாணவன் இந்த வினையின் மூலம் 154.4 × 10-3 கனஅளவுள்ள வாயுவினை 742 mm Hg அழுத்தத்தில் மற்றும் 298 K வெப்பநிலையில் சேகரிக்கிறான் எனக் கருதவும். மாணவன் சேகரித்த ஹைட்ரஜன் வாயுவின் நிறை என்ன?
தீர்வு:
V = 154.4 × 10–33dm
P = 742 mm of Hg
T = 298K
m = ?
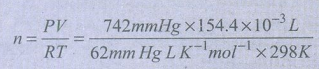
n = 0.006 mol
n = நிறை/ மோலார்நிறை
நிறை = n × மோலார்நிறை = 0.006 × 2.016
= 0.0121 g = 12.1 mg
51) ஒரு வாயு 192 நொடியில் சுவரிலுள்ள ஒரு துளையின் வழியே விரவுகின்றது. N2 வாயு அதே வெப்ப அழுத்த நிலையில் விரவ எடுக்கும் நேரம் 84 நொடி எனில் வாயுவின் மோலார் நிறை என்ன?
தீர்வு:
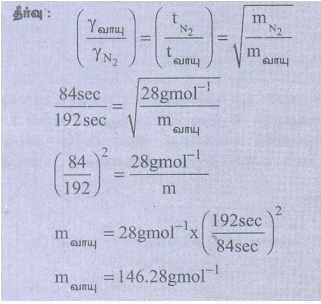
mவாயு = 146.28gmol−1
52) 300 K ல் 52.5 g ஆக்ஸிஜன் மற்றும் 65.1g CO2 அடங்கியுள்ள தொட்டியில் கலவையின் மொத்த அழுத்தம் 9.21 atm. கலவையிலுள்ள ஒவ்வொரு வாயுவின் பகுதி அழுத்தங்களை கண்டறிக.
தீர்வு:
mO2 = 52.5g
PO2 = ?
mCO2 = 65.1g
PCO2 = ?
T = 300K
P = 9.21 atm
PO2 = X O2 × மொத்த அழுத்தம்
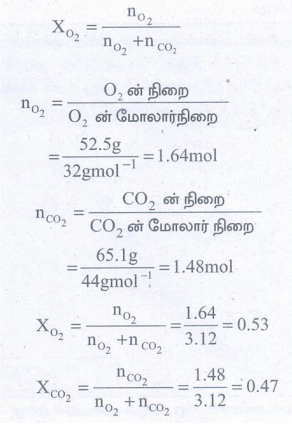
PO2 = X O2 × மொத்த அழுத்தம்
= 0.53 × 9.21atm = 4.88atm
PCO2 = X CO2 × மொத்த அழுத்தம்
= 0.47 × 9.21atm = 4.33atm
53) 2.98 atmல் 25°Cல் உள்ள எரிவாயு உலோகத்தொட்டி ஒன்று வைக்கப்பட்டுள்ளது. அத்தொட்டி 12 atm அழுத்தம் வரை மட்டுமே தாங்கி பின் அதிக அழுத்தத்தினால் வெடிக்கக் கூடியது. அத்தொட்டி உள்ள கட்டிடத்தில் தீப்பிடிக்கும் போது அத்தொட்டி முதலில் வெடிக்குமா அல்லது உருகத் தொடங்குமா எனக்கண்டறிக. (உலோகத்தின் உருகுநிலை 1100K)
உலோகத்தின் உருகுநிலையில் உலோகத் தொட்டியில் உள்ள வாயுவின் அழுத்தம்
T1 = 298K; P1 = 2.98atm;T2 =1100 K ;P2 = ?
P1 /T1 = P2 /T2
⇒ P2 = (P1 /T1) × T2
P2 = (2.98atm/298K) × 1100K =11atm
1100K வெப்பநிலையில் தொட்டியில் உள்ள வாயுவின் அழுத்தமானது 11atm ஆகிறது உலோகத்தொட்டியானது அதிகபட்சமாக 12 atm வரை தாங்கக்கூடியது என்பதால் தொட்டி முதலில் உருகத்தொடங்கும்.