11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
பின்வரும் வினாக்களுக்கு சுருக்கமாக விடையளி
II. பின்வரும் வினாக்களுக்கு சுருக்கமாக விடையளி
26. வெப்ப இயக்கவியலின் முதல் விதியை கூறு.
ஆற்றலை ஆக்கவோ அழிக்கவோ முடியாது. ஆனால் ஒரு வகையான ஆற்றலை மற்றொரு வகையான ஆற்றலாக மாற்றலாம்.
27. ஹெஸ்ஸின் வெப்பம் மாறா கூட்டல் விதியை வரையறு.
ஹெஸ்விதிப்படி, மாறா கனஅளவு அல்லது மாறாத அழுத்தத்தில் ஒரு வினை ஒரு படியில் நிகழ்ந்தாலோ அல்லது பலபடிகளில் நிகழ்ந்தாலோ, அதன் ஆரம்ப மற்றும் இறுதி நிலைகள் மாறாதிருப்பின், அவ்வினையின் மொத்த என்தால்பி மதிப்பு மாறாமல் இருக்கும்.
28. பொருண்மை சாரா பண்பை இரண்டு எடுத்துக் காட்டுகளுடன் விளக்குக.
ஒரு பண்பானது அமைப்பின் நிறை அல்லது அளவினைப் பொறுத்து அமைதியாதிருந்தால் அப்பண்பு பொருண்மை சாரா பண்பாகும்.
எடுத்துக்காட்டு: ஒளிவிலகல் எண் மற்றும் மோலார் கனஅளவு.
29. பின்வரும் சொற்களை வரையறுக்க:
அ. வெப்பநிலை மாறா செயல்முறை
ஆ. வெப்பம் மாறா செயல்முறை
இ. அழுத்தம் மாறா செயல்முறை
ஈ. கன அளவு மாறா செயல்முறை
அ. வெப்பநிலை மாறாச் செயல்முறை
ஒரு செயல்முறையில் அமைப்பானது ஆரம்ப நிலையிலிருந்து, இறுதி நிலைக்கு மாற்றமடையும் போது அதன் வெப்பநிலை மாறாமல் மாறிலியாக இருந்தால் அச்செயல்முறை வெப்பநிலை மாறாச் செயல்முறையாகும். dT = 0
ஆ. வெப்பம் மாறாச் செயல்முறை
ஒரு செயல்முறையின் போது அமைப்பு மற்றும் சூழலுக்கு இடையே எவ்வித வெப்ப பரிமாற்றமும் நிகழாதிருப்பின் அச்செயல்முறை வெப்பம் மாறாச் செயல்முறையாகும். q = 0
இ. அழுத்தம் மாறாச் செயல்முறை
ஒரு செயல்முறையில் அமைப்பானது ஆரம்ப நிலையிலிருந்து, இறுதி நிலைக்கு மாற்றமடையும் போது அதன் அழுத்தம் மாறாமல் மாறிலியாக இருந்தால் அச்செயல்முறை அழுத்தம் மாறாச் செயல் முறையாகும். dP = 0
ஈ. கனஅளவு மாறாச் செயல்முறை
ஒரு செயல்முறையில் அமைப்பானது ஆரம்ப நிலையிலிருந்து, இறுதி நிலைக்கு மாற்றமடையும் போது அதன் கனஅளவு மாறாமல் மாறிலியாக இருந்தால் அச்செயல்முறை கனஅளவு மாறாச் செயல் முறையாகும். dV = 0
30. என்ட்ரோபியின் வழக்கமான வரையறை என்ன? என்ட்ரோபியின் அலகு என்ன?
என்ட்ரோபி என்பது ஒரு அமைப்பின் மூலக்கூறுகளின் ஒழுங்கற்ற தன்மையை அளவிடும் வெப்ப இயக்கவியல் நிலைசார்பாகும்.
என்ட்ரோபி S = q/T என்ட்ரோபியின் SI அலகு = JK−1
31. பின்வரும் நிலைகளில் வினை நிகழ் தன்மையை நிர்ணயிக்கவும்.
i) ΔH மற்றும் ΔS இரண்டும் நேர்குறி மதிப்பை பெற்றிருக்கும்போது
ii) ΔH மற்றும் ΔS இரண்டும் எதிர்குறி மதிப்பை பெற்றிருக்கும்போது
iii) ΔH குறைகிறது ஆனால் ΔS அதிகரிக்கிறது
I) ∆H மற்றும் ∆S இரண்டும் நேர்குறி மதிப்பை பெற்றிருக்கும்போது அவ்வினை உயர் வெப்ப நிலையில் மட்டுமே ∆G மதிப்பு எதிர்குறி மதிப்பை பெற முடியும். அதாவது, T∆S > ∆H யாக இருப்பின் வினை நிகழ்கிறது.
II) ∆H மற்றும் ∆S இரண்டும் எதிர்குறி மதிப்பை பெற்றிருக்கும்போது அவ்வினை குறைந்த வெப்ப நிலையில் மட்டுமே ∆G மதிப்பு எதிர்குறி மதிப்பை பெற முடியும். அதாவது, T∆S> ∆H யாக இருப்பின் வினை நிகழ்கிறது.
III) ∆H குறைகிறது. ஆனால் ∆S அதிகரிப்பதால் அவ்வினை அனைத்து வெப்பநிலைகளிலும் ∆G மதிப்பு எதிர்குறி மதிப்பை பெற முடியும். அதாவது, அனைத்து வெப்பநிலைகளிலும் வினை நிகழ்கிறது.
32. கிப்ஸ் கட்டிலா ஆற்றலை வரையறு.
ஒரு அமைப்பில் வேலை செய்வதற்கு கிடைக்கக் கூடிய ஆற்றல் கிப்ஸ் கட்டிலா ஆற்றலாகும்.
கணிதவியல்படி கிப்ஸ்கட்டிலா ஆற்றல் G என்பது G = H − TS H − என்தால்பி, T − வெப்பநிலை, S − என்ட்ரோபி.
33. எரிதல் என்தால்பியை வரையறு.
ஒரு மோல் சேர்மமானது, அதிக அளவு காற்று அல்லது ஆக்சிஜனில் முழுமையாக எரிக்கப்படும் போது ஏற்படும் என்தால்பி மாற்றமே அச்சேர்மத்தின் எரிதல் வெப்பமாகும். இது ∆Hc என குறியிடப்படுகிறது.
34. மோலார் வெப்ப ஏற்புத்திறன் வரையறு. அதன் அலகு யாது?
ஒரு மோல் சேர்மத்தின் வெப்பநிலையை ஒரு கெல்வின் உயர்த்த அச்சேர்மத்தால் உறிஞ்சப்படும் வெப்ப ஆற்றலின் அளவு அதன் மோலார் வெப்ப ஏற்புத் திறனாகும். SI அலகு : JK−1 mol−1
35. உணவின் கலோரி மதிப்பு வரையறு. கலோரி மதிப்பீட்டின் அலகு யாது?
ஒரு கிராம் உணவை முழுமையாக எரிக்கும்போது வெளிப்படும் வெப்பத்தின் அளவு (கலோரிகளில் அல்லது ஜீல்களில்) அச்சேர்மத்தின் கலோரி மதிப்பு ஆகும்.
SI அலகில் : Jkg−1
CGS அலகில்: Calg−1
36. நடுநிலையாக்கல் என்தால்பியை வரையறு.
நீர்த்த கரைசலில், ஒரு கிராம் சமான நிறை கொண்ட ஒரு அமிலமானது, ஒரு கிராம் சமான நிறை கொண்ட ஒரு காரத்தால் முற்றிலும் நடுநிலையாக்கப்படும் போது ஏற்படும் என்தால்பி மாற்றமே நடுநிலையாக்கல் என்தால்பியாகும்.
37. படிகக்கூடு ஆற்றல் என்றால் என்ன?
ஒரு படிகத்தில் உள்ள அயனிகளை அதன் படிக அணிக்கோவை புள்ளிகளிலிருந்து முடிவிலா தொலைவிற்கு நீக்குவதற்கு தேவைப்படும் ஆற்றலின் அளவு அப்படிகத்தின் படிகக்கூடு ஆற்றலாகும்.
38. நிலைச்சார்புகள் மற்றும் வழிச்சார்புகள் என்றால் என்ன? இரு எடுத்துக்காட்டுகள் தருக.
நிலைச்சார்புகள் : ஒரு அமைப்பின் P,V,T மற்றும் n ஆகிய மாறிலிகளை கொண்டு ஓர் அமைப்பின் நிலைமையை விளக்க பயன்படுவது நிலைச் சார்பாகும்.
எடுத்துக்காட்டு: அழுத்தம் மற்றும் கனஅளவு
வழிச்சார்புகள் : வழிச்சார்பு என்பது ஒரு அமைப்பின் வெப்ப இயக்கவியலின் பண்பாகும். இது ஆரம்ப நிலையிலிருந்து இறுதிநிலைக்கு மாற்றமடையும் வழியினைப் பொறுத்து இதன் மதிப்பு அமையும்.
எடுத்துக்காட்டு: வெப்பம் (q) மற்றும் வேலை (w).
39. வெப்ப இயக்கவியலின் இரண்டாம் விதியின் கெல்வின் - பிளாங்க் கூற்றை கூறுக.
கெல்வின் பிளாங்க் கூற்று : ஒரு சுற்றுச் செயல் முறையில், சூடான வெப்ப மூலத்திலிருந்து வெப்பத்தை உறிஞ்சி அவ்வெப்பத்தின் ஒரு பகுதியை குளிர்ந்த நிலையிலுள்ள மூலத்திற்கு மாற்றாமல், முழுவதும் வேலையாக மாற்றக்கூடிய இயந்திரத்தை வடிவமைக்க இயலாது.
40. ஒரு வினையின் சமநிலை மாறிலி மதிப்பு 10 எனில் ΔG மதிப்பின் குறியீடு என்ன? அவ்வினை தன்னிச்சையாக நிகழுமா?
நாமறிந்தபடி, ∆G = − 2.303 RT log K
= − 2.303 RT log 10
∆G =−2.303 RT (∵ log 10 = 1)
∆G மதிப்பு எதிர்குறியீடு மதிப்புப் பெற்றிருப்பதால், இவ்வினை தன்னிச்சையாக செயல்படும்.
41. ஒரு வலிமைமிகு அமிலம் வலிமைமிகு காரத்தால் நடுநிலையாக்கப்படும்போது நடுநிலையாக்கல் வெப்பம் ஒரு மாறிலி: கூற்றுக்கு காரணம் தருக.
அர்ஹீனியஸ் மின்பகுளி அயனியாதல் கொள்கைப் படி, நீர்க்கரைசலில் வலிமைமிகு அமிலம் மற்றும் காரம் முற்றிலும் பிரிகை அடைந்து முறையே ஹைட்ராக்சில் அயனியும், ஹைட்ரஜன் அயனியும் தருவதுடன் நடுநிலையாக்கல் வினைக்கு உட்பட்டு நிகர வினை நீர் உருவாகின்றது.
H+(aq) + OH− (aq) → H2O(l) ∆H = − 57.32 KJ
42. வெப்ப இயக்கவியலின் மூன்றாம் விதியை கூறு.
வெப்ப இயக்கவியலின் மூன்றாம் விதிப்படி, தனி பூஜ்ஜிய வெப்பநிலையில் ஒரு தூய குறைபாடற்ற படிகத்தின் என்ட்ரோபி மதிப்பு பூஜ்ஜியமாகும்.
கணிதவியல்படி,
lim
T → O S = O
43. CaCl2 உருவாதல் செயல்முறைக்கு பார்ன் - ஹேபர் சுற்றை எழுதுக
CaCl2 உருவாதல், செயல்முறையின் பார்ன்−ஹேபர் சுற்று பின்வருமாறு;
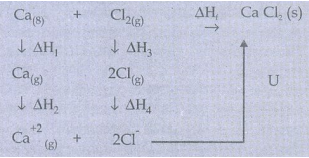
ஹெஸ்ஸியின் வெப்பம், மாறா கூட்டல் விதிப்படி.
∆Hf = ∆H1 + ∆H2 + ∆H3 + 2∆H4 + U
∆Hf = CaCl2 உருவாதல் என்தால்பி மாற்றம்
∆H1 = Ca(s)ன் பதங்கமாதல் வெப்பம்
∆H2 = Ca(g)ன் அயனியாக்கும் ஆற்றல்
∆H3 = Cl2(g) பிரிகை ஆற்றல்
2∆H4 = Cl(g) −ன் எலக்ட்ரான் நாட்டம்
U = CaCl2 − ன் படிகக்கூடு ஆற்றல்
44. பின்வருவனவற்றுள் நிலை மற்றும் வழிச்சார்புகளை கண்டறிக.
அ. என்தால்பி,
ஆ. என்ட்ரோபி,
இ. வெப்பம்,
ஈ. வெப்பநிலை,
உ. வேலை,
ஊ. கட்டிலா ஆற்றல்
நிலைச்சார்புகள்
1. என்தால்பி
2. என்ட்ரோபி
3. வெப்பநிலை
4. கட்டிலா ஆற்றல்
வழிச்ச்சார்புகள்
1. வெப்பம்
2. வேலை
45. வெப்ப இயக்கவியலின் இரண்டாம் விதியின் பல்வேறு கூற்றுகளை கூறு.
அ. என்ட்ரோபி கூற்று
ஒரு தன்னிச்சை செயல்முறை நிகழும்போது ஒரு தனித்த அமைப்பின் என்ட்ரோபி அதிகரிக்கிறது.
ஆ. கெல்வின் − விளாங்க் கூற்று
ஒரு சுற்றுச் செயல்முறையில், சூடான வெப்ப மூலத்திலிருந்து வெப்பத்தை உறிஞ்சி அவ்வெப்பத்தின் ஒரு பகுதியை குளிர்ந்த நிலையிலுள்ள மூலத்திற்கு மாற்றாமல், முழுவதும் வேலையாக, மாற்றக்கூடிய இயந்திரத்தினை வடிவமைக்க இயலாது.
இ. கிளாசியஸ் கூற்று
எந்த ஒரு வேலையும் செய்யாமல், குளிர்ந்த வெப்ப மூலத்திலிருந்து சூடான வெப்ப மூலத்திற்கு, வெப்பத்தை மாற்ற முடியாது.
46. தன்னிச்சை செயல்முறைகள் என்றால் என்ன? தன்னிச்சை செயல்முறைகளுக்கான நிபந்தனைகளை தருக.
தன்னிச்சை செயல்முறைகள் என்பவை வெளி உதவி எதுவுமின்றி தானாகவே நடைபெறும் செயல் முறையாகும். பொதுவாக இயற்கை செயல்முறை என்பது தன்னிச்சை செயல்முறையாகும்.
ஒரு வினை தன்னிச்சையாக நிகழ்வதற்கு தேவையான நிபந்தனை ∆H – T∆S < 0 என்பதாகும். அப்பொழுது தான் கட்டிலா ஆற்றல் கண்டிப்பாக எதிர்குறி மதிப்பை பெற்றிருக்கும்.
47. அகஆற்றலின் சிறப்பியல்புகளை விளக்குக.
அக ஆற்றலின் சிறப்பியல்புகள் :
1. ஒரு அமைப்பின் அக ஆற்றலானது ஒரு பொருண்மை சார்பண்பாகும்.
2. ஒரு அமைப்பின் அக ஆற்றல் ஒரு நிலைச்சார்பு ஆகும்.
3. அமைப்பின் அக ஆற்றல் மாற்றமானது ∆U = Uf − Ui என குறிப்பிடப்படுகிறது.
4. சுற்றுச் செயல்முறைகளில் அகஆற்றலில் எவ்வித மாற்றமும் நிகழ்வதில்லை. (∆Uசுற்று = 0)
5. Uf < Ui இருந்தால் ∆U ஆனது ∆U எதிர்குறி மதிப்பை பெறும்.
6. Uf < Ui இருந்தால் ∆U ஆனது நேர்குறி மதிப்பை பெறும்.
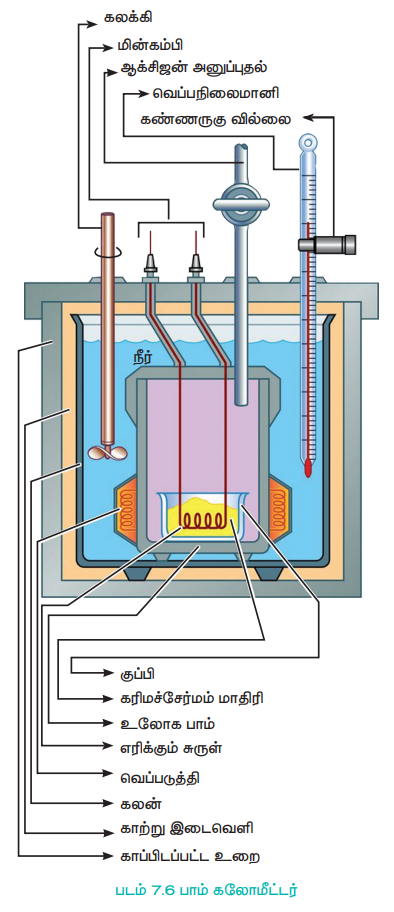
48. பாம் கலோரிமீட்டரில், மாறா கனஅளவில் வெப்பம் உட்கவரப்படுதலை தெளிவான படத்துடன் விளக்குக.
மாறாத கனஅளவில், வேதி வினைகளில் வெளிப்படும் வெப்பம் பாம் கலோரி மீட்டர் கொண்டு அளவிடப்படுகிறது.
பாம் கலோரி மீட்டரின் உள்கலன் (பாம்) மற்றும் மூடி ஆகியன வலிமையான எஃகினால் செய்யப்பட்டுள்ளது. உலோக மூடியானது திருகாணிகள் மூலம் இறுக்கமாக பொருத்தப்பட்டு உள்ளது.
எடையிடப்பட்ட (wகி) கரிம சேர்மமானது ஒரு பிளாட்டின தட்டில் எடுத்துக் கொள்ளப்படுகிறது. இத்தட்டானது மின்பாய்தல் மூலம் உடனடியாக எரிதலை தூண்டுவதற்காக மின்கம்பிகளுடன் பொருத்தப்பட்டுள்ளது. உள்கலனில் அதிகளவு ஆக்ஸிஜன் செலுத்தி அழுத்தப்பட்டு இறுக்கமாக மூடப்படுகிறது. உள்கலன் (பாம்) ஆனது கலோரி மீட்டரிலுள்ள நீரில் அமிழ்த்தி வைக்கப்பட்டுள்ளது. வினையில் உருவாகும் வெப்பம் நீர் முழுவதும் சீராக பரவச் செய்ய கலோரி மீட்டரின் சுவர்களுக்கும், உள்கலனிற்கும் (பாம்) இடையே ஒரு கலக்கி உள்ளது. மின்வில்லை உருவாக்கி சேர்மம் எரிக்கப்படுகிறது.
கலோரி மீட்டரின் உள்கலனில் (பாம்) எடையிடப்பட்ட, எரியக்கூடிய கரிம சேர்மம், ஆக்ஸிஜன் சேர்த்து எரிக்கப்படுகிறது. சேர்மம் எரிக்கப்படும் போது உருவாகும் வெப்பம், கலோரி மீட்டர் மற்றும் அதைச் சூழ்ந்துள்ள நீரினால் உறிஞ்சப்படுகிறது. வெப்பநிலை மாற்றத்தை அளவிட பெக்மென் வெப்ப நிலைமானி பொருத்தப்பட்டு உள்ளது. பாம் கலோரி மீட்டர் மூடப்பட்டுள்ளதால் அதன் கனஅளவில் மாற்றம் ஏற்படுவதில்லை. எனவே வெப்ப அளவீடுகளானது மாறாத கனஅளவில் எரிதல் வெப்பத்திற்குச் (∆U°c) சமம்.
இவ்வினையில் உருவான வெப்பத்தின் அளவானது (∆U°c), கலோரி மீட்டர் மற்றும் நீரால் உறிஞ்சப்பட்ட வெப்ப மதிப்புகளின் கூடுதலுக்குச் சமம்.
கலோரி மீட்டர் மற்றும் நீரால் உறிஞ்சப்பட்ட வெப்ப மதிப்புகளின் கூடுதலுக்குச் சமம்.
கலோரி மீட்டரால் உறிஞ்சப்பட்ட வெப்பம் q1 = k∆T
இங்கு k என்பது கலோரி மீட்டர் மாறிலி எனப்படுகிறது.
மேலும் k = mcCc
mc = கலோரி மீட்டரின் நிறை
Cc = கலோரி மீட்டரின் வெப்ப ஏற்புத்திறன்
நீரால் உறிஞ்சப்பட்ட வெப்பம் q2 = mwCw∆T
இங்கு mw என்பது நீரின் மோலார்நிறை
Cw நீரின் மோலார் வெப்ப ஏற்புத்திறன்
(4.184kJK−1mol−1)
எனவே
∆Uc = q1 + q2
= k∆T + mw Cw∆T
= (k + mwCw)∆T
ஒரு தெரிந்த அளவுடைய திட்ட பொருளை (பென்சாயிக் அமிலம்) எரிப்பதன் மூலம், கலோரி மீட்டர் மாறிலியின் (k) மதிப்பினை தீர்மானிக்க முடியும். பென்சாயிக் அமிலத்தின் எரிதல் வினை வெப்பம் 3227 kJ mol−1 என்ற தெரிந்த ஒரு மதிப்பாகும்.
மாறா அழுத்தத்தில் என்தால்பி மாற்றத்தை பின்வரும் சமன்பாட்டிலிருந்து கணக்கிடலாம்.
∆Hco (அழுத்தம்) = ∆Uco (கனஅளவு) + ∆ngRT
49. விரிவடைதல், மற்றும் சுருங்குதல் செயல்முறையின் போது செய்யப்படும் வேலையை கணக்கிடுக.
ஒரு மோல் நல்லியல்பு வாயுவை கொண்டுள்ள A என்ற குறுக்கு வெட்டுப்பரப்புடைய உராய்வற்ற அழுத்தியுடன் (piston) கூடிய கொள்கலனை நாம் கருதுவோம். அமைப்பினுள் உள்ள வாயுவின் கனஅளவு (Vi) மற்றும் அமைப்பினுள் உள்ள வாயுவின் அழுத்தம் (Pint)
வெளி அழுத்தம் (Pext) ஆனது உள் அழுத்தத்தை (Pint) விட அதிகமாக இருக்கும்போது, அழுத்தியானது உள் நோக்கி நகர்கிறது. (Pint) உள்ளழுத்தமானது Pext க்கு சமமாகும் வரையில் நடைபெறும் இந்நிகழ்வு ஒரேபடியில் நிகழ்வதாக கொள்க, மேலும் இறுதி கனஅளவு Vf என்க.
இந்நேர்வில் அமைப்பின் மீது வேலை செய்யப்படுகிறது (+w). இதனை பின்வருமாறு கணக்கிடலாம்.
w = − F ..........(1)
∆x என்பது சுருங்குதலின் போது அழுத்தியானது நகர்ந்த தூரம், மற்றும் F என்பது வாயுவின் மீது செயல்படும் விசை
F = Pext A ..........(2)
சமன்பாடு (2) ஐ (1)ல் பிரதியிட
W = −Pext A ∆x
ΑΔΧ = கன அளவில் ஏற்படும் மாற்றம்
= Vf − Vi
w = −Pext (Vf − Vi) ..........(3)
w = −Pext (-∆V) ..........(4)
= Pext.∆V
அமைப்பின் மீது வேலை செய்யப்படுவதால் W நேர்குறி மதிப்பினைப் பெறுகிறது. அழுத்தமானது (Pext) மாறிலியாக இருப்பதில்லை. ஆனால் செயல்முறையின் போது, எப்பொழுது வாயுவின் அழுத்தத்தை காட்டிலும் மிக நுண்ணிய அளவில் அதிகமாக இருக்கும் வகையில் மாற்றமடைகிறது. இந்த சுருங்குதலின் ஒவ்வொரு நிலையிலும், கனஅளவானது dV என்ற மிகநுண்ணிய அளவில் குறைகிறது. இத்தகைய நேர்வுகளில் வாயுவின் மீது செய்யப்பட்ட வேலையை பின்வரும் தொடர்பின் மூலம் நாம் கணக்கிட முடியும்.
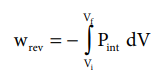
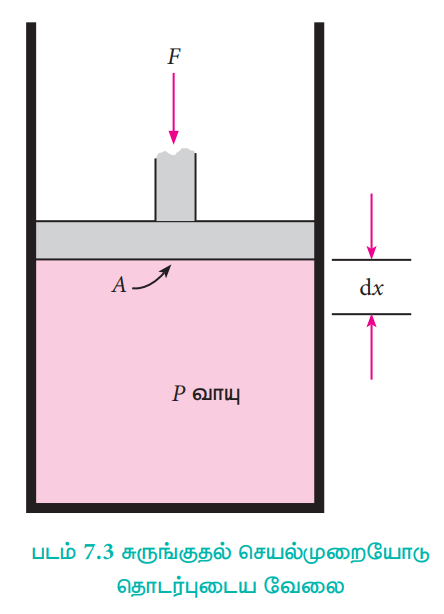
ஒரு சுருங்குதல் செயல்முறையில் வெளி அழுத்தம் Pext ஆனது அமைப்பின் அழுத்தத்தை காட்டிலும் எப்பொழுதும் அதிகமாக இருக்கும்.
அதாவது Pext = (Pint + dP).
ஒரு விரிவடைதல் செயல்முறையில் வெளி அழுத்தம்
Pext ஆனது அமைப்பின் அழுத்தத்தை விட எப்பொழுதும் குறைவு.
அதாவது Pext = (Pint − dP)
கனஅளவு Vi லிருந்து Vf க்கு சுருங்கும்போது, அழுத்தம் மாறிலியாக இல்லாமல் இருப்பதுடன், மாற்றங்கள் மிக நுண்ணியபடிகளில் (மீள் நிபந்தனைகளில்), இருக்குமாயின் P − V வரைபடமானது படத்தில் காட்டப்பட்டுள்ள வரைபடத்திற்கு ஒத்துள்ளது. இந்நிகழ்வில் வாயுவின் மீது செய்யப்பட்ட வேலையானது நிழலிடப்பட்ட பரப்பினால் குறிக்கப்படுகிறது.
ஒரு பொதுவான நேர்வில், மீள் செயல்முறைகளுக்கு நாம் பின்வருமாறு எழுத முடியும்.
Pext = (Pint ± dP)
மீள் நிபந்தனைகளில், ஒரு சுருங்குதல் செயல்முறை வேலையானது அமைப்பின் உள் அழுத்தத்துடன் பின்வரும் சமன்பாட்டின் மூலம் தொடர்புபடுத்த முடியும்.
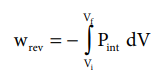
ஒரு நல்லியல்பு வாயுவைக் கொண்டுள்ள கொடுக்கப்பட்டுள்ள அமைப்பிற்கு.
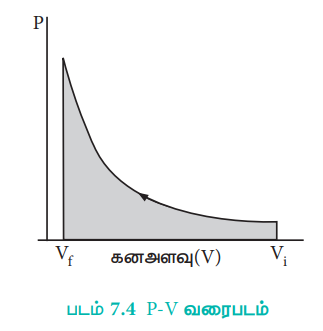
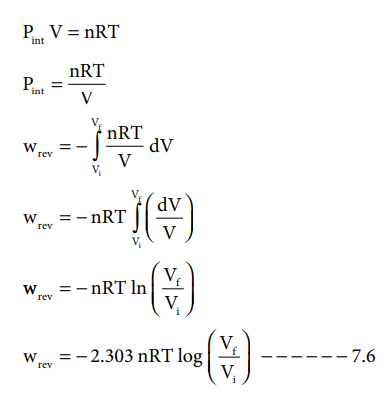
Vf > Vi (விரிவடைதல்) எனில் செயல்முறையால் செய்யப்பட்ட வேலையானது எதிர்குறி மதிப்புடையது.
Vf > Vi (சுருங்குதல்) எனில் செயல்முறையால் செய்யப்பட்ட வேலையானது நேர்குறி மதிப்புடையது.
50. ஒரு நல்லியல்பு வாயுவிற்கு ΔH க்கும் ΔU க்கும் இடையே உள்ள தொடர்பை வருவி. சமன்பாட்டிலுள்ள ஒவ்வொரு உறுப்பையும் விளக்குக.
∆Hக்கும் ∆Uக்கும் இடையே உள்ள தொடர்பு :
மாறாத வெப்ப அழுத்த நிலைகளில் ஒன்றுடன் ஒன்று வேதிவினை புரிந்து வாயு நிலையுள்ள விளை பொருட்களை தரும் வாயுக்கள் அடங்கிய மூடிய அமைப்பு ஒன்றைக் கருதுக. வினைபடு வாயுக்களின் ஆரம்ப கனஅளவு Vi எனவும் வனைவிளை வாயுக்களின் கனஅளவு Vf எனவும் அவற்றின் மோல் எண்ணிக்கை முறையே ni மற்றும் nf எனக் கொண்டால் விளைபடு பொருட்களுக்கு (ஆரம்ப நிலை)
PVi = ni RT …………….(1)
விளைபொருட்களுக்கு (இறுதி நிலை)
PVf = nf RT …………….(2)
சமன்பாடு (2) − (1) கிடைப்பது
P(Vf − Vi) = (nf – ni) RT
P∆V = ∆ng RT …………….(3)
நாமறிந்தபடி, ∆H = ∆U + P∆V …………….(4)
சமன்பாடு (3) ஐ சமன்பாடு (4) ல் பிரதியிட
∆H = ∆U + ∆ng RT …………….(5)
∆H = மாறா அழுத்தத்தில் என்தால்பி மாற்றம்
∆U = மாறா கனஅளவில் என்தால்பி மாற்றம்
∆ng = வாயு நிலையில் உள்ள வினைபடு மற்றும் வினைவிளை பொருட்களின் மோல்களின் எண்ணிக்கையின் வேறுபாடு
R = வாயு மாறிலி
T = வெப்பநிலை
51. சோடியம் குளோரைடு படிகத்தின் படிக்கூடு ஆற்றலை கணக்கிடும் மறைமுக முறையை விளக்குக.
பார்ன் − ஹேபர் சுற்றை பயன்படுத்தி சோடியம் குளோரைடு படிகத்தின் படிகக்கூடு ஆற்றலை கணக்கிடலாம்.
NaCl படிகத்தின் படிகக்கூடு ஆற்றலை கணக்கிடுவதற்கு பார்ன் − ஹேபர் சுற்றை பின்வருமாறு பயன்படுத்துவோம்.
வினையில் ஈடுபடும் வினைபடு பொருட்கள் தனிம நிலையிலும், விளைபொருட்கள் தங்களின் திட்ட நிலைகளிலும் உள்ளதால் 1bar அழுத்தத்தில் வினையில் ஏற்படும் மொத்த என்தால்பி மாற்றம் NaCl படிகத்தின் உருவாதல் என்தால்பி எனவும் அழைக்கப்படுகிறது. மேலும் NaCl உருவாகும் வினை ஐந்து படிகளில் நிகழ்வதாக கருதுவோம். ஒவ்வொரு படியிலும் நிகழும் என்தால்பி மாற்றங்களின் கூடுதல் வினையின் மொத்த என்தால்பி மாற்றத்திற்குச் சமம்.
இதிலிருந்து NaCl படிகத்தின் படிகக்கூடு ஆற்றலை கணக்கிடுக.
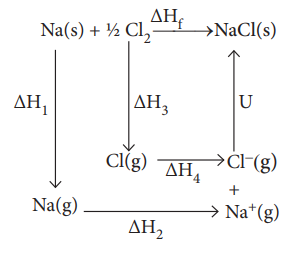
∆Hf = சோடியம் குளோரைடின் உருவாதல் வெப்பம் = −4113 kJ mol−1
∆H1 = Na(s)ன் பதங்கமாதல் வெப்பம் = 108.7 kJ mol−1
∆H2 = Na(g)ன் அயனியாக்கும் ஆற்றல் = 495.0kJmol−1
∆H3 = Cl2(g) ன் பிரிகை ஆற்றல் = 244 kJmol−1
∆H4 = Cl2 (g) ன் எலக்ட்ரான் நாட்டம் = −349.0 kJmol−1
U = NaCl ன் படிகக்கூடு ஆற்றல்
∆Hf = ∆H1 + ∆H2 + ½ ∆H3 +2 ∆H4 + U
U = (∆Hf) – (∆H1 + ∆H2 + ½ ∆H3 + ∆H4)
U = (−411.3) − (108.7 + 495.0 + 122 − 349)
U = (−411.3) − (376.7)
ஃ U = −788kJmol−1
படிகக்கூடு ஆற்றல் மதிப்பிலுள்ள இந்த எதிர்குறியானது வாயுநிலையிலுள்ள மற்றும் அயனிகளிலிருந்து உருவாகும்போது ஆற்றல் வெளிப்படுகிறது என்பதை குறிக்கிறது.
52. கிப்ஸ் கட்டிலா ஆற்றலின் சிறப்பியல்புகளை விளக்குக.
1. கிப்ஸ் கட்டிலா ஆற்றலை பின்வருமாறு வரையறுக்கலாம். G = H − TS
2. கிப்ஸ் கட்டிலா ஆற்றல் ஒரு பொருண்மை சார் பண்பாகும்.
3. G என்பது ஒற்றை மதிப்புடைய நிலைச்சார்பாகும்.
4. ∆G = ΔΗ − T∆S என்ற சமன்பாட்டின் மூலம் ஒரு செயல்முறை தன்னிச்சையானதா என நிர்ணயிக்க பயன்படுகிறது.
5. ∆G < 0 அல்லது எதிர்குறி − தன்னிச்சை செயல்முறை
∆G > 0 அல்லது நேர்குறி − தன்னிச்சையற்ற செயல்முறை
∆G = 0 − சமநிலைச் செயல்முறை
6. ∆G = −W − P∆V மொத்த வேலை
இச்சமன்பாட்டில் P∆V என்பது மாறா புற அழுத்தத்திற்கு எதிராக விரிவடைதலால் செய்யப்படும் வேலையை குறிக்கிறது. எனவே, மாறா வெப்ப அழுத்த நிலைகளில், ஒரு செயல்முறை நிகழும்போது ஏற்படும் கட்டிலா ஆற்றல் குறைவு (−∆G) என்பது அமைப்பு செய்யும் விரிவடைதல் வேலையை தவிர்த்து அமைப்பிலிருந்து பெறக்கூடிய அதிகபட்ச வேலைக்கு சமம்.
7. தனிமங்களின் உருவாகுதலின் திட்ட கட்டிலா ஆற்றலின் மதிப்புகள் பூஜ்ஜியமாகும்.
53. 25°C வெப்பநிலை மற்றும் சாதாரண அழுத்தத்தில், 2 மோல்கள் நல்லியல்பு வாயு, மீள்முறையில், மாறா வெப்பநிலையில் விரிவடையும்போது அதன் கனஅளவு 500 ml லிருந்து 2L ஆக மாறுகிறது எனில், செய்யப்பட்ட வேலையை கணக்கிடுக.
தீர்வு:
n = 2 moles
Vf = 2lit
Vi = 500ml = 0.5lit
T = 25°C = 298K
w = −2.303nRT log[Vf / Vi]
w = −2.303 × 2 × 8.314 × 298 × log[2 / 0.5]
w = −2.303 × 2 × 8.314 × 298 × log(4)
w = −2.303 × 2 × 8.314 × 298 × 0.6021
w = −6871 J
w = −6.871 kJ
54. கனஅளவு மாறா கலோரிமீட்டரில், மூலக்கூறுநிறை 28 கொண்ட, 3.5 g வாயு அதிகளவு ஆக்ஸிஜன் செலுத்தி, 298K வெப்பநிலையில் முற்றிலுமாக எரிக்கப்பட்டது. எரிதல் வினையின் காரணமாக கலோரி மீட்டரின் வெப்பநிலை 298K லிருந்து 298.45K க்கு உயர்ந்துள்ளது. கலோரி மீட்டர் மாறிலி மதிப்பு 2.5 kJ K-1 எனில், வாயுவின் எரிதல் என்தால்பி மதிப்பை kJ mol-1 அலகில் காண்க.
தீர்வு:
Ti = 298K
Tf = 298.45K
Mm = 28
k = 2.5 kJK−1
m = 3.5g
உமிழப்பட்ட வெப்பம் = K∆T
= k (Tf − Ti)
= 2.45 kJK−1 × (298.45 − 298)K
= 1.125 kJ
3.5 கி வாயு வெளியிடப்பட்ட வெப்பம் = 1.12 kJ
ஃஒரு மோல் (அ) 28 கி வாயு வெளியிடும் வெப்பம் = (1.125 × 28) / 3.5
∆Hc = 9KJ mol−1
55. 77°C வெப்பநிலையில் உள்ள ஒரு அமைப்பிலிருந்து 33°C. வெப்பநிலையில் உள்ள சுற்றுப்புறத்திற்கு, 245 J ஆற்றல் பாயும்போது, அமைப்பு, சுற்றுப்புறம் மற்றும் அண்டத்தில் ஏற்படும் என்ட்ரோபி மாற்றங்களை கணக்கிடு.
தீர்வு:
Tஅமைப்பு = 77°C = (77 + 273) = 350K
Tசூழல் = 33°C = (33 + 273) = 306K
q = 245 J

∆S = ∆Sஅமைப்பு + ∆Sசூழல்
∆S = −0.7 JK−1 + 0.8 JK−1 = −0.1 JK−1
56. 4.1 வளிமண்டல அழுத்தம், மற்றும் குறிப்பிட்ட வெப்பநிலையில் உள்ள 1 மோல் நல்லியல்பு வாயு, 3710J ஆற்றலை உறிஞ்சி, 2L விரிவடைகிறது. இந்த விரிவடைதலின்போது நிகழும் என்ட்ரோபி மாற்றத்தை கணக்கிடு.
தீர்வு:
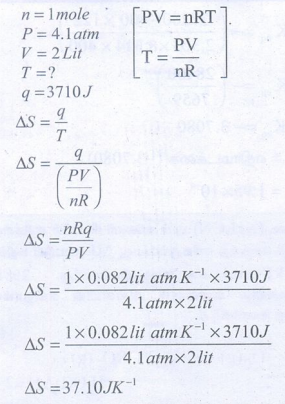
57. ஒரு மோல் சோடியம் குளோரைடை உருக்க 30.4 kJ அளவு ஆற்றல் தேவைப்படுகிறது. உருகுதலின் போது நிகழும் என்ட்ரோபி மாற்றம் 28.4 JK-1 mol-1 னில் சோடியம் குளோரைடின் உருகுநிலையை காண்க.
தீர்வு:
∆Hf (NaCl) = 30.4kJ = 30400 J mol−1
∆S f (NaCl) = 28.4JK−1 mol−1
Tf = ?
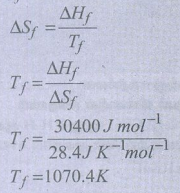
T f = 1070.4K
58. புரப்பேனின் திட்ட எரிதல் என்தால்பி மதிப்பு -2220.2 kJ mol-1 CO2 (g) மற்றும் H2O (l) ஆகியவற்றின் திட்ட உருவாதல் என்தால்பி மதிப்புகள் முறையே -393.5 மற்றும் -285.8 kJ mol-1 எனில், புரப்பேனின் திட்ட உருவாதல் என்தால்பி மதிப்பை காண்க.
தீர்வு:
∆H0f co2 = − 393.5 kJ mo1−1
∆H0f H2O = − 285.5 kJ mol−1
∆H0f C3H8 = −2220.2 kJ mol−1
புரோப்பேன் எரிதல் வெப்பம்
C3H8 + 5O2 → 3CO2 + 4H2O
∆H0c = ∑ ∆H0fp − ∑∆H0fr

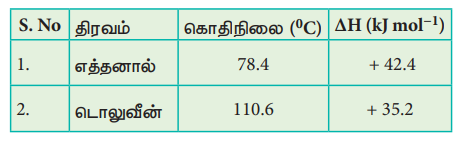
59. சாதாரண கொதிநிலை மற்றும் திட்ட ஆவியாதல் என்தால்பி மதிப்புகள் கொடுக்கப்பட்டுள்ளன. கீழ்காண் திரவங்களுக்கு ஆவியாதல் என்ட்ரோபி மதிப்புகளை காண்க.

60. 1 atm அழுத்தத்தில் கீழ்காணும் வினைக்கு
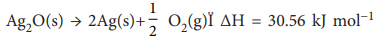 மற்றும் ΔS = 6.66 JK-1 mol-1 எனில் எந்த வெப்பநிலையில் ΔG மதிப்பு பூஜ்ஜியமாக இருக்கும் என்பதை கணக்கிடுக. (i) அந்த வெப்பநிலையில் மற்றும் (ii) அந்த வெப்பநிலைக்கு கீழ்வினை நிகழும் திசையை காண்க.
மற்றும் ΔS = 6.66 JK-1 mol-1 எனில் எந்த வெப்பநிலையில் ΔG மதிப்பு பூஜ்ஜியமாக இருக்கும் என்பதை கணக்கிடுக. (i) அந்த வெப்பநிலையில் மற்றும் (ii) அந்த வெப்பநிலைக்கு கீழ்வினை நிகழும் திசையை காண்க.
தீர்வு:
கொடுக்கப்பட்டவை
∆H = 30.56kJmol−1
= 30560Jmol−1
∆S = 6.66 × 10−3 kJK−1mol−1
T = ? இருக்கும்போது ∆G = 0
∆G = ∆H − T ∆S
0 = ∆H − T∆S
T = ∆H/ ∆S
T = 30.56kJmol−1/6.66 × 10−3 kJK−1mol−1
T = 4589K
(i) 4589K வெப்பநிலை ∆G = 0 வினை சமநிலையில் உள்ளது.
(ii) வெப்பநிலை 4589K க்கு கீழே உள்ள போது ∆H > T∆S மற்றும் ∆G = ∆H – T∆S > 0 எனவே முன்னோக்கி வினையானது தன்னிச்சையற்றது பின்னோக்கிய வினை நிகழும்.
61. 400K. வெப்பநிலையில் பின்வரும் வினையின் சமநிலை மாறிலி Keq மதிப்பை காண்க.
2 NOCl (g) ⇋ 2NO (g) + Cl2 (g),
ΔH0 = 77.2 kJ mol-1
மற்றும் ΔS0 = 122 JK-1 mol-1
தீர்வு :
T = 400 K
∆H°c = 77.2 KJmol−1
= 77200 Jmol−1
∆G° = −2.303 RT log Keq

log Keq = −3.7080
Keq = எதிர்மடக்கை (−3.7080)
Keq = 1.95 × 10−4
62. சயனமைடை (NH2 CN) பாம் கலோரி மீட்டரில், அதிகளவு ஆக்ஸிஜன் செலுத்தி எரிக்கும்போது ஏற்படும் ΔU மதிப்பு -742.4 kJ mol-1, என கண்டறியபட்டது. 298 K வெப்பநிலையில் பின்வரும் வினையின் என்தால்பி மாற்றத்தை கணக்கிடுக.
NH2CN (s) + 3/2 O2 (g) → N2 (g) + CO2 (g) + H2O (l) ΔH= ?
தீர்வு:
T = 298K; ∆U = −742.4kJmol−1
∆H = ?
∆H = ∆U + ∆ng RT
∆H = ∆U + (np − nr )RT
∆H = −742.4 + (2 – 3/2) × 8.314 × 10−3 × 298
= −742.4 + (0.5 × 8.314 × 10−3 × 298)
= −742.4 + 1.24
= −741.16kJmol−1
63. பின்வரும் தரவுகளிலிருந்து எத்திலீனை ஹைட்ரஜனேற்றம் செய்யும் வினையின் என்தால்பி மதிப்பை காண்க. C-H, C-C, C=C மற்றும் H-H ஆகிய பிணைப்புகளின் பிணைப்பு ஆற்றல்கள் முறையே 414, 347, 618 மற்றும் 435 kJ mol-1
தீர்வு:
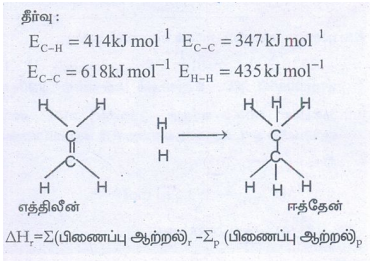
∆Hr = ∑(பிணைப்பு ஆற்றல்)r − ∑p (பிணைப்பு ஆற்றல்)p
∆Hr = (EC−C + 4 EC−H + EH−H) − (EC−C + 6 EC−H)
∆Hr = (618 + (4 × 414) = 435) − (347 + (6 × 414))
∆Hr = 2709−2831
∆Hr = −122 kJ mol−1
64. பின்வரும் தரவுகளிலிருந்து CaCl2 படிகத்தின் படிக கூடு ஆற்றலை கணக்கிடு.
Ca (s) + Cl2 (g) → CaCl2 (s) ΔH0f = -795 kJ mol-1
பதங்கமாதல் : Ca (s) → Ca (g) ΔH01 = + 121 kJ mol-1
அயனியாதல் : Ca (g) → Ca2+ (g) + 2e- ΔH02 = + 2422 kJ mol-1
பிளத்தல் : Cl2 (g) → 2Cl (g) ΔH03 = + 242.8 kJ mol-1
எலக்ட்ரான் நாட்டம் : Cl (g) + e- → Cl- (g) ΔH04 = -355 kJ mol-1
தீர்வு:
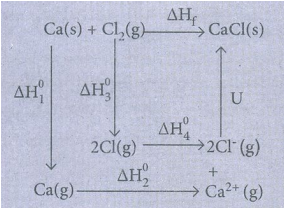
ΔΗf = ΔΗ1 + ΔΗ2 + ΔΗ3 + 2ΔΗ4 + u
−795 = 121 + 2422 + 242.8 + (2 × −355) + u
−795 = 2785.8 – 710 + u
−795 = 2075.8 + u
u = −795 − 2075.8
u = −2870.8 kJ mol−1
65. கொடுக்கப்பட்டுள்ள தரவுகளிலிருந்து Fe2O3 + 3CO → 2Fe + 3CO2 வினையின் என்தால்பி மாற்ற மதிப்பை கணக்கிடுக.
2 Fe + 3/2 O2 → Fe2O3 ΔH = -741 kJ
C + 1/2 O2 → CO ΔH = - 137 kJ
C + O2 → CO2 ΔH = - 394.5 kJ
தீர்வு:
∆Hf (Fe2O3) = −741kJmol−1
∆Hf (CO) = −137 kJ mol−1
Fe2O3 + 3CO → 2Fe + 3CO2 ∆Hr = ?
∆Hr = ∑(∆Hf) வினைவிளை பொருள் − ∑(∆Hf) வினைபடு பொருள்
∆Hr = [0 + 3(−394.5)] − [−741 + 3(−137)]
∆Hr = [−1183.5] − [−1152]
∆Hr = −1183.5 + 1152.
∆Hr = −31.5kJ mol−1
66. 175o C, வெப்பநிலையில் 1-பென்டைனை (A), ஆல்கஹால் கலந்த 4N KOH கரைசலுடன் வினைப்படுத்தும் போது, 1.3% 1-பென்டைன் (A), 95.2% 2- பென்டைன் (B) மற்றும் 3.5% 1, 2 பென்டாடையீன் (C) கலந்த சமநிலைக் கலவையை உண்டாக்குகிறது 175° C, வெப்பநிலையில் பின்வரும் சமநிலைகளின் ΔG0 மதிப்பை கணக்கிடுக.
B ⇋ A ΔG01 = ?
B ⇋ C ΔG02 = ?
T = 175°C = 175 + 273 = 448K
தீர்வு:
1− பென்டைனின் செறிவு [A] = 1.3%
2 − பென்டைனின் செறிவு [B] = 95.2%
1,2 பென்டாடையீனின் செறிவு [C] = 3.5% சமநிலையில்
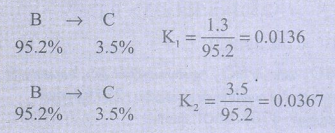
∆G01 = −2.303 RT logK1
∆G01 = −2.303 × 8.314 × 448 × log0.0136
∆G01 = −2.303 × 8.314 × 448 × −1.8664
∆G01 = +16010 J
∆G01 = +16 kJ
∆G02 = −2.303RTlogK2
∆G02 = −2.303 × 8.314 × 448 × log 0.0367
∆G02 = −2.303 × 8.314 × 448 × −1.4353
∆G02 = +12312J
∆G02 = +12.312kJ
67. 33K வெப்பநிலையில், ஐம்பது சதவீதம் N2O4 சிதைகிறது எனில், அந்த வெப்பநிலையில், 1 atm அழுத்தத்தில் ஏற்படும் திட்டகட்டிலா ஆற்றல் மாற்றத்தை கணக்கிடு.
தீர்வு:

சமநிலையில் மொத்த மோல்கள் 0.5 + 1 = 1.5
பகுதி அழுத்தம் = மோல் பின்னம் × மொத்த அழுத்தம்
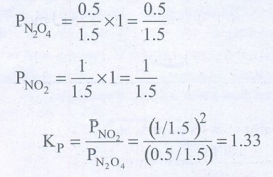
∆Go = −2.303RT log Keq
= −2.303 × 8.314 × 33 log 1.33
= −2.303 × 8.314 × 33 × 0.1239
∆Go = −78.29Jmol−1
68. SO2 மற்றும் SO3 ஆகியவற்றின் திட்ட உருவாதல் என்தால்பி மதிப்புகள் முறையே - 297 kJ mol-1 மற்றும் -396 kJ mol-1, எனில் SO2 + 1/2 O2 → SO3 வினையின் திட்ட என்தால்பி மதிப்பை காண்க.
தீர்வு:
கொடுக்கப்பட்டவை
∆H0f (SO2) = −297 kJ mol−1
∆H0f (SO3) = −396 kJ mol−1
SO2 + ½ O2 → SO3
∆H0f = ?
∆H0f = (∆H0f) compound − ∑ (∆Hf) elements
∆H0f = ∆H0f (SO3) − (∆H0f (SO2) + ½ ∆H0f (O2) )
∆H0f = −396kJ mol−1 = −(−297kJ mol−1 + 0)
∆H0f = −396kJ mol−1 + 297
∆H0f = −99kJ mol−1
69. 298 K வெப்பநிலையில் 2A + B → C வினையின் ΔH = 400 KJ mol-1, ΔS = 0.2 KJK-1 mol-1 எனில் வினை தன்னிச்சையாக நிகழ தேவையான வெப்பநிலையை கணக்கிடுக.
தீர்வு:
T = 298K
∆H = 400J mol−1 = 400 J mol−1
∆S = 0.2J K−1 mol−1
∆G = ∆H − T∆S
if T = 2000 K
∆G = 400 − (0.2 × 2000) = 0
if T > 2000K
∆G எதிர்குறியீட்டை பெற்றிருக்கும். எனவே 2000 K மேல் வினை தன்னிச்சையாக நிகழும்.
70. 298K வெப்பநிலையில் பின்வரும் வினைக்கு சமநிலை மாறிலி மதிப்பை கணக்கிடுக. 2NH3 (g) + CO2 (g) NH2CONH2 (aq) + H2O (l) கொடுக்கப்பட்ட வெப்ப நிலையில் வினையின் திட்ட கட்டிலா ஆற்றல் மாற்ற ΔG0r மதிப்பு, - 13.6 KJ mol-1
தீர்வு:
கொடுக்கப்பட்டவை T = 298 K
∆G0r = −13.6kJ mol–1
∆G0 = −2.303 RT log Keq
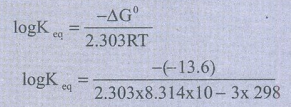
log Keq = 2.38
Keq = எதிர்மடக்கை (2.38)
Keq = 239.88
71. 3.67 லிட்டர் கொள்ளவு கொண்ட எத்திலீன் மற்றும் மீத்தேன் வாயுக்கலவையை, 25° C மற்றும் 1 வளிமண்டல அழுத்தத்தில் முழுமையாக எரிக்கும் போது 6.11 L கார்பன்டையாக்சைடு வாயுவை உருவாக்குகிறது. எரிதலின்போது வெளிப்படும் வெப்பத்தின் அளவை kJ, அலகில் கணக்கிடுக. ΔHC (CH4) = - 890 kJ mol-1 மற்றும் ΔHC (C2H4) = -1423 kJ mol-1
தீர்வு:
கொடுக்கப்பட்டவை
∆HC (CH4) = −890 kJ mol−1
∆HC (C2H4) = −1423 kJ mol−1
கொடுக்கப்பட்ட கலவை X லிட்டர்
மீத்தேனையும் (3.67 − X) லிட்டர் எத்திலீனையும் கொண்டுள்ளதாகக் கருதுக.
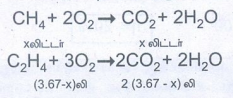
வினைப்பட்ட ஆக்சிஜனின் கனஅளவு
= X + 2(3.67 − X) = 6.11 லிட்டர்
X + 7.34 – 2X = 6.11
7.34 – X = 6.11
X = 1.23 லிட்டர்
கொடுக்கப்பட்டக் கலவையானது 1.23 லிட்டர் மீத்தேனையும் 2.44 லிட்டர் எத்திலீனையும் கொண்டுள்ளது. எனவே

∆HC = – 203.87 kJmol−1