வாயு விதிகள் - சார்லஸ் விதி (கனஅளவு - வெப்பநிலை தொடர்பு) | 11th Chemistry : UNIT 6 : Gaseous State
11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
சார்லஸ் விதி (கனஅளவு - வெப்பநிலை தொடர்பு)
சார்லஸ் விதி (கனஅளவு - வெப்பநிலை தொடர்பு)
J.A.C சார்லஸ் என்பவரால் வாயுவின் கனஅளவிற்கும், அதன் வெப்பநிலைக்கும் இடையேயான தொடர்பு குறித்து ஆய்வு மேற்கொள்ளப்பட்டது. ஒரு குறிப்பிட்ட நிறையுள்ள வாயுவிற்கு, அதன் அழுத்தம் மாறாதிருக்கும் போது, கன அளவானது அதன் வெப்பநிலையுடன் நேர்விகிதத் தொடர்புடையது என அவர் கண்டறிந்தார். இதனை கணித சமன்பாடாக பின்வருமாறு எழுதலாம் (P மற்றும் n மாறாதிருக்கும்போது)
V = kT -------- (6.5)
(அல்லது)
V / T = மாறிலி
வாயுவில் வெப்பநிலை அதிகரிக்கும் போது V/T மாறிலியாக அமையும் வகையில் அதன் கனஅளவு நேர்விகிதத்தில் அதிகரிக்கிறது. மாறாத அழுத்தத்தில் உள்ள ஒரு அமைப்பிற்கு,

உதாரணமாக, பனிக்கட்டி குளிர் நிலையில் உள்ள நீரில் உள்ள ஒரு பலூனை, கொதி நீருள்ள மற்றொரு தொட்டிக்கு மாற்றும்போது, பலூனில் உள்ள வாயுவின் வெப்பநிலை அதிகரிக்கிறது. இதன் விளைவாக, பலூனிலுள்ள வாயு மூலக்கூறுகள் வேகமாக நகர்கின்றன. எனவே வாயு விரிவடைந்து, கனஅளவு அதிகரிக்கின்றது.
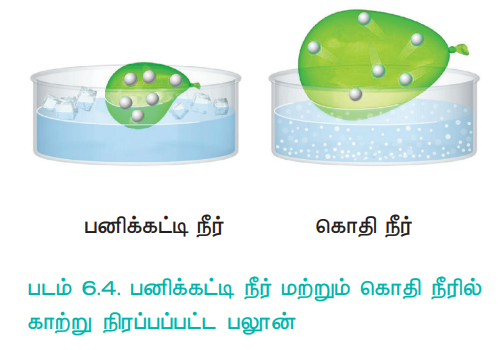
படம் 6.4. பனிக்கட்டி நீர் மற்றும் கொதி நீரில் காற்று நிரப்பப்பட்ட பலூன்
மாறாத அழுத்தத்தில், வெப்பநிலை, மாற்றத்தால், கனஅளவில் ஏற்படும் மாற்றம்.
ஒரு குறிப்பிட்ட அழுத்தத்தில், ஒரு வாயுவின் கனஅளவிற்கும், அதன் வெப்பநிலைக்கும் இடையேயான வரைபடம் 6.5ல் கொடுக்கப்பட்டுள்ளது. வரைபடத்திலிருந்து, குறிப்பிட்ட அழுத்தத்தில் வெப்பநிலை அதிகரிக்கும் போது வாயுவின் கனஅளவு நேர்விகிதத்தில் நேர்கோட்டில் அதிகரிக்கிறது என்பதை தெளிவாக அறிய முடிகிறது. இத்தகைய நேர்கோடுகள் ஐசோபார்கள் என்றழைக்கப்படுகின்றன. இதனை பின்வரும் நேர்கோட்டுச் சமன்பாட்டால் குறிப்பிடலாம்.
V = mT + C இங்கு T என்பது டிகிரி செல்சியஸில் வெப்பநிலை. m மற்றும் C ஆகியன மாறிலிகள்.
T = 0°C ஆக உள்ள போது கனஅளவு V0 ஆகிறது. எனவே, V0 = C மற்றும் நேர்கோட்டின் சாய்வு m = ΔV / ΔTக்குச் சமம். எனவே மேற்கண்டுள்ள சமன்பாட்டினை பின்வருமாறு எழுதலாம்.

V = (ΔV / ΔT) T + V0 ---------- (6.7)
மாறாத அழுத்தத்தில், சார்லஸ் மற்றும் கேலூசாக் ஆகிய அறிஞர்கள், ஒரு டிகிரி செல்சியஸ் வெப்பநிலை உயர்வினால், கனஅளவில் ஏற்படும் ஒப்பீட்டு அதிகரிப்பானது அனைத்து வாயுக்களுக்கும் ஒரேமாதிரியாக உள்ளன என கண்டறிந்தனர். ஒரு டிகிரி செல்சியஸ் வெப்பநிலை உயர்விற்கான கனஅளவில் ஏற்படும் ஒப்பீட்டு அதிகரிப்பு (α) என்பது (1 / V0) (ΔV / ΔT) க்குச் சமம்.
எனவே,
V / V0 = αT + 1
V = V0 (αT + 1) ---------- (6.9)
விரிவடைதல் குணகமானது தோராயமாக 1/273 என்ற மதிப்பிற்குச் சமம் என சார்லஸ் கண்டறிந்தார். அதாவது, மாறாத அழுத்தத்தில், ஒவ்வொரு டிகிரி வெப்பநிலை உயர்விற்கும், ஒரு குறிப்பிட்ட நிறையுள்ள, அனைத்து வாயுக்களும், 0°C ல் பெற்றுள்ள, அவைகளின் கன அளவைப் போல் 1/273 மடங்கு விரிவடைகின்றன.
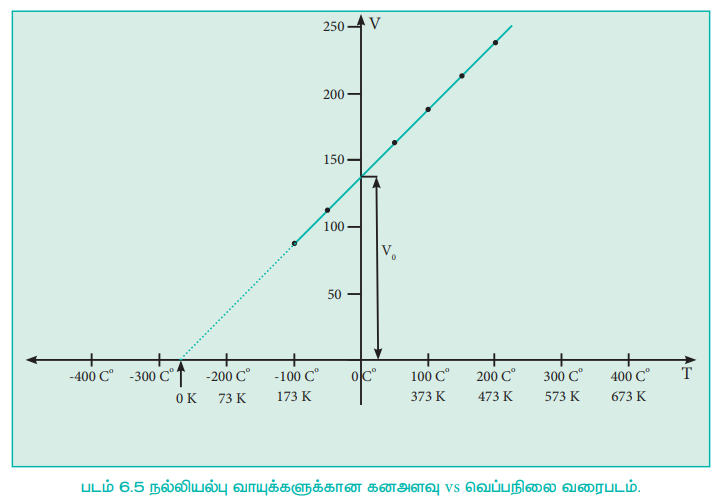
படம் 6.5 நல்லியல்பு வாயுக்களுக்கான கனஅளவு vs வெப்பநிலை வரைபடம்.
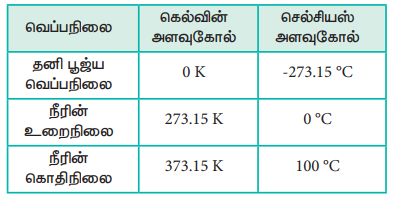
படம் 6.5ல் காட்டியுள்ளவாறு, சோதனை அளவீடுகளை விட குறைவான வெப்பநிலைகளுக்கு நேர்கோட்டினை நாம் நீட்டித்தால், அந்த நேர்கோடு x-அச்சினை -273°C ல் வெட்டுகிறது. இதிலிருந்து -273°C வெப்பநிலையில் (மிகத் துல்லியமாக -273.15°C ல்) வாயுவின் கனஅளவு பூஜ்ஜிய மதிப்பை பெறும், இவ்வெப்பநிலைக்குக் கீழ் வாயுவின் கனஅளவு எதிர்குறி மதிப்பினைப் பெற்றிருக்கவேண்டும். ஆனால் நடைமுறையில் இது சாத்தியமற்றதாகும். இதன் காரணமாக இந்த வெப்பநிலையை கெல்வின் தனிவெப்ப நிலை என வரையறுத்தார். மேலும் தனி பூஜ்ஜிய வெப்பநிலையை ஆரம்பப்புள்ளியாகக் கொண்டு, கெல்வின் புதிய வெப்பநிலை அளவுகோலினை உருவாக்கினார். தற்போது இந்த அளவுகோல் கெல்வின் அளவுகோல் என அழைக்கப்படுகிறது. கெல்வின் அளவுகோலின் பூஜ்யத்தின் நிலை மாற்றப்பட்டதே செல்சியஸ் வெப்பநிலை அளவுகோலுக்கும், கெல்வின் வெப்பநிலை அளவுகோலுக்கும் இடையே உள்ள ஒரே வேறுபாடாகும்.
எடுத்துக்காட்டு:
படம் (6.6)ல் விடுபட்ட அளவீடுகளை (6.6(b)ல் கனஅளவு 6.6(c)ல் வெப்பநிலை) நாம் கண்டறிவோம்.
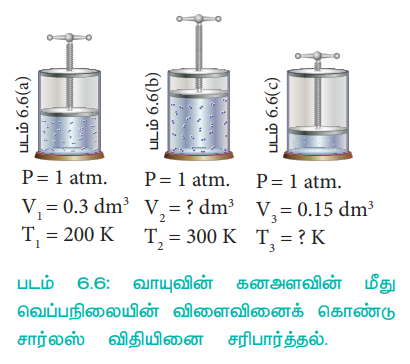
படம் 6.6: வாயுவின் கனஅளவின் மீது வெப்பநிலையின் விளைவினைக் கொண்டு சார்லஸ் விதியினை சரிபார்த்தல்,
தீர்வு:
சார்லஸ் விதிப்படி

T3 = 100 K
தன்மதிப்பீடு
3. ஒரு வாயு மாதிரியானது, ஒரு குறிப்பிட்ட வெப்பநிலையில் 3.8 dm3 கனஅளவினை பெற்றுள்ளது. இம்மாதிரியானது 0°Cல் உள்ள பனிகட்டி நீரில் அழுத்தப்படும்போது, அதன் கனஅளவு 2.27 dm3 ஆக குறைகிறது. அதன் ஆரம்ப வெப்பநிலை எவ்வளவு?
தீர்வு:
