வாயு நிலைமை | வேதியியல் - அமுக்கத்திறன் காரணி (Z) | 11th Chemistry : UNIT 6 : Gaseous State
11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
அமுக்கத்திறன் காரணி (Z)
அமுக்கத்திறன் காரணி (Z)
இயல்பு வாயுக்கள், நல்லியல்புத் தன்மையிலிருந்து விலகலடைதலை PV மற்றும் nRTக்கு இடையேயான விகிதத்தின் அடிப்படையில், அளவிட இயலும். இக்காரணி அமுக்கத்திறன் காரணி எனப்படுகிறது. கணிதவியலின் அடிப்படையில்,
Z = PV / nRT
நல்லியில்பு வாயுக்களுக்கு PV = nRT எனவே, அனைத்து வெப்ப அழுத்த நிலைகளிலும் அமுக்கத்திறன் காரணி, Z = 1, இவ்வாயுக்களுக்கான Z Vs P வரைபடமானது அழுத்த அச்சிற்கு இணையான நேர்கோடாக அமையும். வாயுக்கள் நல்லியல்புத் தன்மையிலிருந்து விலகலடையும் போது, Zன் மதிப்பானது ஒன்றிலிருந்து விலகலடைகிறது. அனைத்து வாயுக்களுக்கும், மிகக்குறைந்த அழுத்தம் மற்றும் மிக அதிக வெப்பநிலைகளில் அமுக்கத்திறன் காரணியின் மதிப்பு 1க்கு அருகில் அமைந்துள்ளது. மேலும் வாயுக்கள் நல்லியல்புத் தன்மையுடையதாக செயல்படுகின்றன. குறிப்பிட்ட சிலவாயுக்களுக்கான அமுக்கத்திறன் காரணி Vs அழுத்த வரைபடமானது வரைபடம் 6.8ல் காட்டப்பட்டுள்ளது.
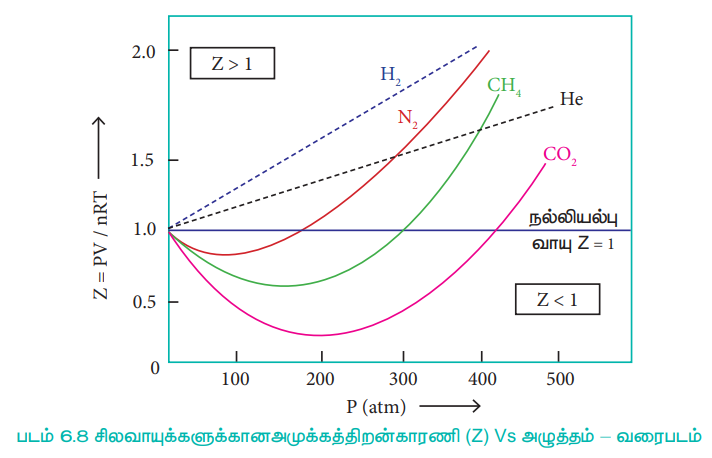
அழுத்தம் குறைவாக உள்ள போது, வாயுமூலக்கூறுகளின் கனஅளவோடு ஒப்பிடும் போது, கொள்கலனின் கனஅளவு மிக அதிகமாகும். எனவே தனித்த வாயு மூலக்கூறின் கனஅளவானது புறக்கணிக்கத்தக்கது. மேலும், வாயு மூலக்கூறுகள் ஒன்றுக்கொன்று தொலைவில் அமைவதால், அவற்றிற்கிடையேயான கவர்ச்சி விசையும் புறக்கணிக்கத்தக்கது. அழுத்தம் அதிகரிக்கப்படும் போது வாயுக்களின் அடர்த்தி அதிகரிப்பதுடன், வாயுமூலக்கூறுகள் ஒன்றுக்கொன்று நெருக்கமாகவும் அமைகின்றன. எனவே வாயுமூலக்கூறுகளின் இயக்கத்தினை பாதிக்கும் வகையில் அவைகளுக்கிடையேயான கவர்ச்சி விசை குறிப்பிடத்தக்க அளவு போதுமானதாக உள்ளது. மேலும் வாயுக்கள் நல்லியல்புத் தன்மை உடையதாக இருப்பதில்லை.
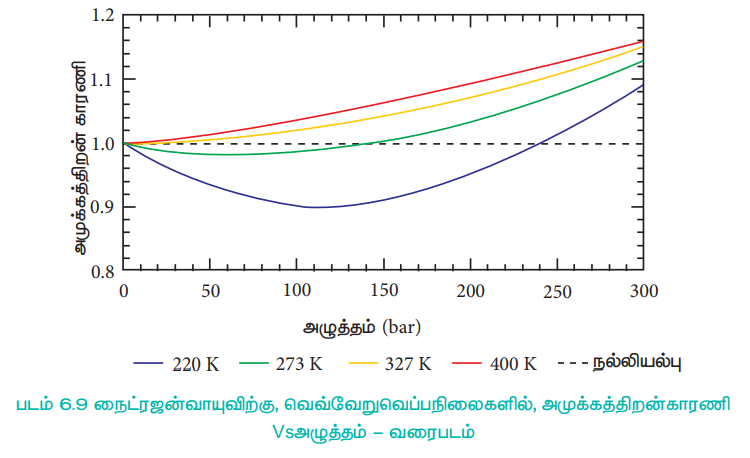
அதிக வெப்ப நிலையில், வாயு மூலக்கூறுகளின் சராசரி இயக்க ஆற்றல் மிகஅதிகம் எனவே அவைகளுக்கிடையேயான கவர்ச்சி விசை புறக்கணிக்கத்தக்கது. வெப்பநிலையை குறைக்கும் போது வாயு மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலும் குறையும். எனவே மூலக்கூறுகளுக்கிடையேயான கவர்ச்சி விசை அதிகரிக்கின்றது. எந்த ஒரு வெப்ப நிலையில் இயல்பு வாயுக்கள், நல்லியல்புச் சமன்பாட்டிற்கு, உட்பட்டு செயல்படுகிறதோ அவ்வெப்பநிலை பாயில் வெப்பநிலை அல்லது பாயில் புள்ளி எனப்படும். பாயில் வெப்பநிலைக்கு மேலே, இயல்பு வாயுக்களுக்கு Z > 1 அதாவது இயல்பு வாயுக்கள் நேர்மறை விலகலை காட்டுகின்றன. பாயில் வெப்பநிலைக்கு கீழே, அழுத்தம் அதிகரிக்கப்படும் போது, இயல்பு வாயுக்களுக்கான Z மதிப்பு முதலில் குறைந்து, சிறும மதிப்பினை அடைந்து பின்னர் அதிகரிக்கத் துவங்குகிறது. எனவே, குறைவான அழுத்தம் மற்றும் அதிக வெப்பநிலையில், இயல்பு வாயுக்கள், நல்லியல்புத் தன்மையினை பெறுகின்றன என தெளிவாகிறது.