11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
நல்லியல்புத் தன்மையிலிருந்து விலகலடைதல்
நல்லியல்புத் தன்மையிலிருந்து விலகலடைதல்
PV = nRT என்ற வாயுச் சமன்பாடு உருவாவதற்கு அடிப்படையாக அமைந்துள்ள வாயுக்களின் இயக்கவியற் கொள்கையின்படி (வாயுக்களின் இயக்கவியற் கொள்கையின் கோட்பாடுகள் இயற்பியல் பாடப் பகுதியில் விரிவாக விளக்கப்பட்டுள்ளது). வாயுவின் ஒட்டு மொத்த கனஅளவோடு ஒப்பிடும் போது, தனிப்பட்ட ஒரு வாயு மூலக்கூறு அடைத்துக் கொள்ளும் கனஅளவு என்பது புறக்கணிக்கத்தக்கது. மேலும் வாயு மூலக்கூறுகளுக்கிடையே கவர்ச்சிவிசை ஏதுமில்லை. அனைத்து வெப்ப அழுத்த நிலைகளிலும் மேற்கண்டுள்ள இவ்விரு ஊகத்தின் அடிப்படையிலான கோட்பாடுகளுக்கு உட்பட்டு செயல்படும் வாயுக்கள் நல்லியல்பு வாயுக்கள் எனப்படும். ஆனால் நடைமுறையில் அனைத்து வெப்ப அழுத்த நிலைகளிலும் ஊகத்தின் அடிப்படையிலான இவ்விரு கருதுகோள்களும் சரியானவை அல்ல. எடுத்துக்காட்டாக வாயுக்களை திரவமாக்குதல் நிகழ்வானது, வாயு மூலக்கூறுகளுக்கிடையே கவர்ச்சி விசை உள்ளது என்பதைக் காட்டுவதாக உள்ளது. எனவே அனைத்து வெப்ப அழுத்த நிலைகளிலும் எந்த ஒரு வாயுவும் நல்லியல்பு வாயுவின் தன்மையினை பெற்றிருக்க இயலாது. அவ்வாறான நல்லியல்பு தன்மையற்ற வாயுக்கள் இயல்பு வாயுக்கள் என அழைக்கப்படுகின்றன. இயல்பு வாயுக்கள் சில நிபந்தனைகளில் (வெப்ப அழுத்த நிலைகளில்) நல்லியல்புத் தன்மையை நெருங்குகின்றன.
1. அமுக்கத்திறன் காரணி (Z)
இயல்பு வாயுக்கள், நல்லியல்புத் தன்மையிலிருந்து விலகலடைதலை PV மற்றும் nRTக்கு இடையேயான விகிதத்தின் அடிப்படையில், அளவிட இயலும். இக்காரணி அமுக்கத்திறன் காரணி எனப்படுகிறது. கணிதவியலின் அடிப்படையில்,
Z = PV / nRT
நல்லியில்பு வாயுக்களுக்கு PV = nRT எனவே, அனைத்து வெப்ப அழுத்த நிலைகளிலும் அமுக்கத்திறன் காரணி, Z = 1, இவ்வாயுக்களுக்கான Z Vs P வரைபடமானது அழுத்த அச்சிற்கு இணையான நேர்கோடாக அமையும். வாயுக்கள் நல்லியல்புத் தன்மையிலிருந்து விலகலடையும் போது, Zன் மதிப்பானது ஒன்றிலிருந்து விலகலடைகிறது. அனைத்து வாயுக்களுக்கும், மிகக்குறைந்த அழுத்தம் மற்றும் மிக அதிக வெப்பநிலைகளில் அமுக்கத்திறன் காரணியின் மதிப்பு 1க்கு அருகில் அமைந்துள்ளது. மேலும் வாயுக்கள் நல்லியல்புத் தன்மையுடையதாக செயல்படுகின்றன. குறிப்பிட்ட சிலவாயுக்களுக்கான அமுக்கத்திறன் காரணி Vs அழுத்த வரைபடமானது வரைபடம் 6.8ல் காட்டப்பட்டுள்ளது.
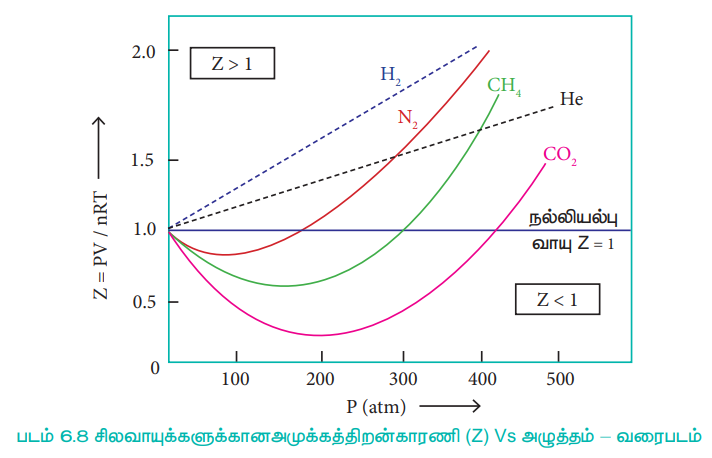
அழுத்தம் குறைவாக உள்ள போது, வாயுமூலக்கூறுகளின் கனஅளவோடு ஒப்பிடும் போது, கொள்கலனின் கனஅளவு மிக அதிகமாகும். எனவே தனித்த வாயு மூலக்கூறின் கனஅளவானது புறக்கணிக்கத்தக்கது. மேலும், வாயு மூலக்கூறுகள் ஒன்றுக்கொன்று தொலைவில் அமைவதால், அவற்றிற்கிடையேயான கவர்ச்சி விசையும் புறக்கணிக்கத்தக்கது. அழுத்தம் அதிகரிக்கப்படும் போது வாயுக்களின் அடர்த்தி அதிகரிப்பதுடன், வாயுமூலக்கூறுகள் ஒன்றுக்கொன்று நெருக்கமாகவும் அமைகின்றன. எனவே வாயுமூலக்கூறுகளின் இயக்கத்தினை பாதிக்கும் வகையில் அவைகளுக்கிடையேயான கவர்ச்சி விசை குறிப்பிடத்தக்க அளவு போதுமானதாக உள்ளது. மேலும் வாயுக்கள் நல்லியல்புத் தன்மை உடையதாக இருப்பதில்லை.
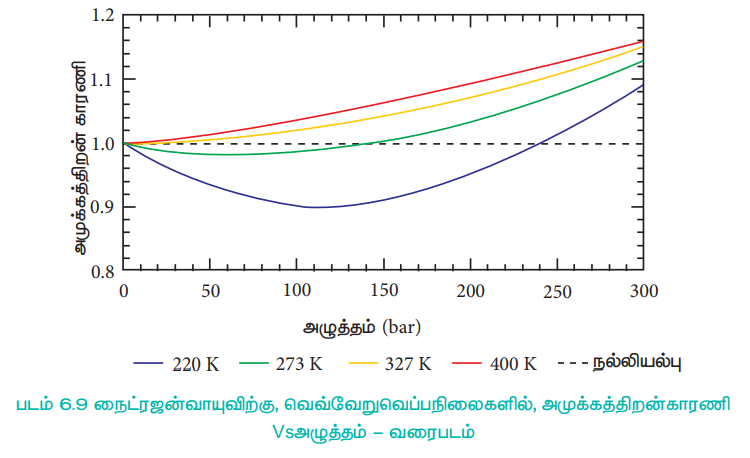
அதிக வெப்ப நிலையில், வாயு மூலக்கூறுகளின் சராசரி இயக்க ஆற்றல் மிகஅதிகம் எனவே அவைகளுக்கிடையேயான கவர்ச்சி விசை புறக்கணிக்கத்தக்கது. வெப்பநிலையை குறைக்கும் போது வாயு மூலக்கூறுகளின் சராசரி இயக்க ஆற்றலும் குறையும். எனவே மூலக்கூறுகளுக்கிடையேயான கவர்ச்சி விசை அதிகரிக்கின்றது. எந்த ஒரு வெப்ப நிலையில் இயல்பு வாயுக்கள், நல்லியல்புச் சமன்பாட்டிற்கு, உட்பட்டு செயல்படுகிறதோ அவ்வெப்பநிலை பாயில் வெப்பநிலை அல்லது பாயில் புள்ளி எனப்படும். பாயில் வெப்பநிலைக்கு மேலே, இயல்பு வாயுக்களுக்கு Z > 1 அதாவது இயல்பு வாயுக்கள் நேர்மறை விலகலை காட்டுகின்றன. பாயில் வெப்பநிலைக்கு கீழே, அழுத்தம் அதிகரிக்கப்படும் போது, இயல்பு வாயுக்களுக்கான Z மதிப்பு முதலில் குறைந்து, சிறும மதிப்பினை அடைந்து பின்னர் அதிகரிக்கத் துவங்குகிறது. எனவே, குறைவான அழுத்தம் மற்றும் அதிக வெப்பநிலையில், இயல்பு வாயுக்கள், நல்லியல்புத் தன்மையினை பெறுகின்றன என தெளிவாகிறது.
2. இயல்பு வாயுக்களுக்கான அமுக்கத்திறன் காரணி
இயல்புவாயுக்களுக்கான அமுக்கத்திறன் காரணியினை பின்வருமாறு எழுதலாம்.
Z = PVஇயல்பு / nRT ---------- (6.17)
Vநல்லியல்பு = nRT / P ---------- (6.18)
(6.18) ஐ (6.17) ல் பிரதியிட
Z = Vஇயல்பு / Vநல்லியல்பு ---------- (6.19)
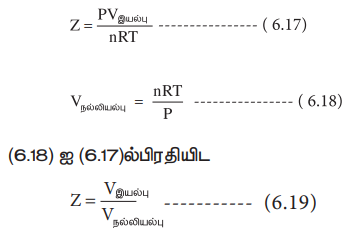
இங்கு, Vஇயல்பு என்பது இயல்பு வாயுக்களின் மோலார் கனஅளவு மற்றும் Vநல்லியல்பு என்பது அவ்வாயு நல்லியல்பு வாயுவாக செயல்படும் போது அதன் மோலார் கனஅளவு மதிப்பாகும்.
3. வாண்டர் வால்ஸ் சமன்பாடு
இயல்பு வாயுக்களைப் பற்றிய கணிதவியல் ரீதியான ஆய்வுகள் முதன்முதலில் J.D வாண்டர் வால்ஸ் என்பவரால் மேற்கொள்ளப்பட்டது. இவரது சமன்பாட்டின் மூலம் நம்மால் மூலக்கூறு அளவில், இயல்பு வாயுக்களின் தன்மையினை விளக்க இயலும். இவர் அழுத்தத்திற்கான திருத்தம் மற்றும் கனஅளவிற்கான திருத்தம் என இரு திருத்தங்களை PV = nRT என்ற நல்லியல்பு வாயுச்சமன்பாட்டில், அறிமுகப்படுத்தி அச்சமன்பாட்டினை மாற்றியமைத்தார்.
அழுத்தத்திற்கான திருத்தம்
வாயுவின் அழுத்தமானது, அவ்வாயு மூலக்கூறுகள் கொள்கலனின் சுவற்றின் மீது மோதுவதால் ஏற்படும் விசைக்கு நேர்விகிதத் தொடர்புடையது. கொள்கலனின் சுவற்றினை நோக்கிச் செல்லும் ஒருவாயு மூலக்கூறின் வேகமானது, அம்மூலக்கூறினை சூழ்ந்துள்ள பிறவாயு மூலக்கூறுகளின் கவர்ச்சி விசையினால் குறைக்கப்படுகிறது. எனவே அளந்தறியப்பட்ட அழுத்தமானது, வாயுவின் நல்லியல்பு அழுத்தத்தை விட குறைவானதாகும். எனவே இவ்விளைவிற்கான ஒரு திருத்தத்தினை வாண்டர் வால்ஸ் அறிமுகப்படுத்தினார்.
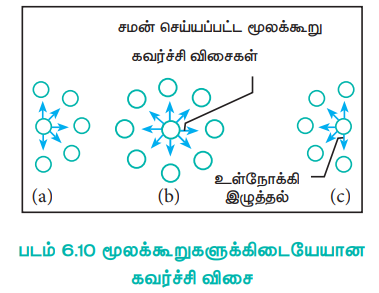
படம் 6.10 மூலக்கூறுகளுக்கிடையேயான கவர்ச்சி விசை
கொள்கலனின் சுவற்றிற்கு அருகே உள்ளே ஒரு மூலக்கூறு உணரும் கவர்ச்சி விசையானது வாயுவின் அடர்த்தியின் வர்க்கத்திற்கு நேர்விகிதத்தில் இருக்கும் என வாண்டர் வால்ஸ் கண்டறிந்தார்.
P α ρ2
ρ = n / V
இங்கு n என்பது வாயுக்களின் மோல்களின் எண்ணிக்கை 'V' என்பது கொள்கலனின் கனஅளவு
⇒ P’ α n2 / V2
⇒ P’ = a (n2 / V2)
இங்கு a என்பது விகிதமாறிலி. இது வாயுவின் இயல்பினைப் பொருத்து அமையும்.
எனவே,
Pநல்லியல்பு = P + (an2 / V2) ---------- (6.20)
கனஅளவிற்கான திருத்தம்
ஒவ்வொரு தனித்த வாயு மூலக்கூறும் ஒரு குறிப்பிடத்தக்க கனஅளவை அடைத்துக் கொள்வதால், வாயு அடங்கிய கொள்கலனின் கன அளவினை (V)க்காட்டிலும், வாயுவின் உண்மையான கனஅளவு குறைவானதாகும். இவ்விளைவிற்கான வாண்டர் வால்ஸ் திருத்தக்காரணி V’ ஐ அறிமுகப்படுத்தினார். வாயு மூலக்கூறுகளை கோளவடிவில் இருப்பதாக கருத்திற் கொண்டு, திருத்தக் காரணியை நாம் கணக்கிடலாம்.
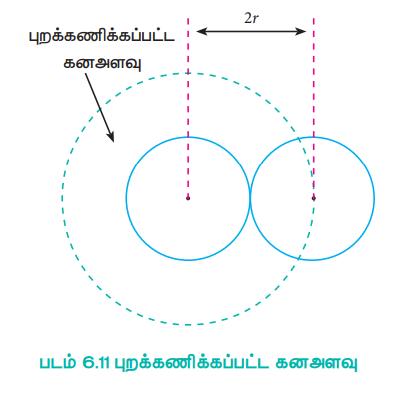
படம் 6.11 புறக்கணிக்கப்பட்ட கனஅளவு
V' = புறக்கணிக்கப்பட்ட கனகளவு
இரு மூலக்கூறுகளுக்கான புறக்கணிக்கப்பட்ட கனஅளவு
= (4 / 3) π (2r)3
= 8 [ (4 / 3) πr3] = 8 Vm
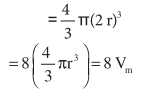
இங்கு Vm ஒரு தனித்த வாயு மூலக்கூறின் கனஅளவு
ஒரு தனித்த மூலக்கூறுக்கான புறக்கணிக்கப்பட்ட கனஅளவு
= (8Vm) / 2 = 4Vm
n மூலக்கூறுகளுக்கான புறக்கணிக்கப்பட்ட கனஅளவு
= n(4Vm) = nb
இங்கு b என்பது வாண்டர் வால்ஸ் மாறிலி
இது 4Vm ற்குச் சமம்
⇒ V’ = nb
Vநல்லியல்பு = V – nb ---------- (6.21)
PV = nRT என்ற நல்லியல்பு வாயுச் சமன்பாட்டினை, திருத்தம் செய்யப்பட்ட அழுத்தம் மற்றும் கனஅளவு மதிப்புகளைக் கொண்டு மாற்றியமைக்க, இயல்பு வாயுக்களுக்கான வாண்டர் வால்ஸ் சமன்பாடு பின்வருமாறு பெறப்படுகிறது.
[ P + (an2 / V2) ] (V - nb) = nRT ---------- (6.22)
a மற்றும் b ஆகியன வாண்டர் வால்ஸ் மாறிலிகள். வாயுக்களின் தன்மையினைப் பொறுத்து இம்மாறிலிகளின் மதிப்பு அமையும். இச்சமன்பாடு நல்லியல்புத் தன்மையற்ற வாயுக்களுக்கான, தோராயமான ஒரு சமன்பாடாகும்.