11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
கிரஹாமின் வாயு விரவுதல் விதி
கிரஹாமின் வாயு விரவுதல் விதி
வாயுக்கள், தங்களுக்கு கிடைக்கும் அனைத்து வெளியினையும் அடைத்துக் கொள்ளும் தன்மையினை பெற்றுள்ளன. இரு வினை புரியாத வாயுக்களை ஒன்றோடொன்று கலந்திட அனுமதிக்கும் போது, வாயு மூலக்கூறுகள் அதிக செறிவுள்ள பகுதியிலிருந்து, குறைவான செறிவுள்ள பகுதிக்கு நகர்கின்றன. ஒருவாயுவின் மூலக்கூறுகள் மற்றொரு வாயுவின் வழியே நகரும் இப்பண்பானது விரவுதல் (diffusion) என்றழைக்கப்படுகிறது. ஒருகலனில் உள்ள வாயுவானது, ஒரு மிகச்சிறிய துளையின் வழியே வெளியேறும் மற்றொரு நிகழ்வானது பாய்தல் (effusion) என அழைக்கப்படுகிறது.
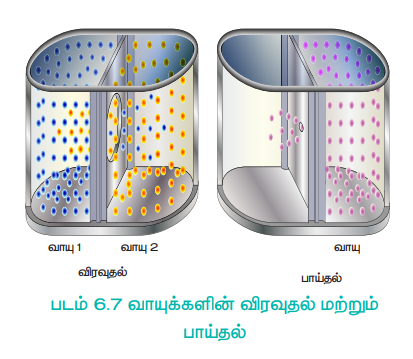
படம் 6.7 வாயுக்களின் விரவுதல் மற்றும் பாய்தல்
ஒரு வாயுவின் விரவுதல் அல்லது பாய்தலின் வீதமானது, அதன் மோலார் நிறையின் வர்க்கமூலத்திற்கு எதிர்விகிதத்தில் அமையும். இக்கூற்று கிரஹாமின் வாயுவிரவுதல் / பாய்தல் விதி என அழைக்கப்படுகிறது.
கணிதவியல்படி, விரவுதல் வீதம் α 1 / √M
மாறாக
rA / rB = √ (MB / MA) ---------- (6.15)
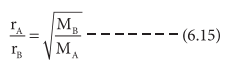
விரவும் வாயுக்கள் வெவ்வேறு அழுத்தநிலைகளில் (PA, PB), இருக்குமாயின்
rA / rB = (PA / PB ) √ MB / MA ---------- (6.16)
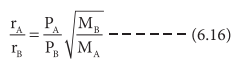
இங்கு rA மற்றும் rB என்பன முறையே MA மற்றும் MB ஆகியவற்றை மூலக்கூறு நிறைகளாகக் கொண்ட A மற்றும் B ஆகிய வாயுக்களின் விரவுதல் வீதங்களாகும்.
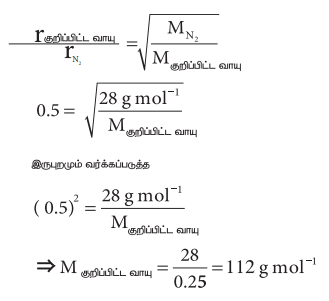
1. சமவெப்ப அழுத்த நிலையில், ஒரு குறிப்பிட்ட வாயுவின் விரவுதல் வீதம், நைட்ரஜனைக் காட்டிலும் 0.5 மடங்கு அதிகம். அக்குறிப்பிட்ட வாயுவின் மோலார் நிறையினைக் கணக்கிடுக.
தீர்வு:
உங்களுக்குத் தெரியுமா?
U235 வை பிற ஐசோடோப்புகளிலிருந்து, செறிவூட்டும் செயல்முறைக்கு கிரஹாமின் வாயுவிரவல் விதி அடிப்படையாக அமைகிறது.
தன்மதிப்பீடு
எளிதில் தீப்பற்றும், ஒரு குறிப்பிட்ட கனஅளவுடைய வாயு நிலையில் உள்ள ஹைட்ரோகார்பன், ஒரு சிறு துளையின் வழியே 1.5 நிமிடங்களில் (minutes) விரவுகின்றது. இதே வெப்ப அழுத்த நிலைகளில், சம கனஅளவு உடைய புரோமின் ஆவியானது அதே துளையின் வழியே விரவுவதற்கு 4.73 நிமிடங்கள் (minutes) எடுத்துக் கொள்கிறது. அந்த வாயுவின் மோலார் நிறையினை கண்டறிக மேலும் அந்த ஹைட்ரோ கார்பன் என்னவாக இருக்கலாம் எனக் கூறு. (புரோமினின் மோலார் நிறை 159.8 gmol-1 என கொடுக்கப்பட்டுள்ளது]
t1 = 1.5 minutes (வாயு) ஹைட்ரோகார்பன்
t2 = 4.73 minutes (வாயு) புரோமின்

n(12) + (2n + 2) = 116
12n + 2n + 2 = 16
14n = 16 − 2
14n = 14
n = 1
ஃ ஹைட்ரோகார்பனின் பொது வாய்ப்பாடு CnH2n+2
ஃஹைட்ரோகார்பனானது, C1H2(1)+2 = CH4