11 வது வேதியியல் : அலகு 6 : வாயு நிலைமை
கார்பன்டை ஆக்ஸைடின் அழுத்தம் - கனஅளவு, சமவெப்ப நிலைக்கோடுகள் ஆண்ட்ரூஸின் சமவெப்பநிலைக் கோடுகள் (Andrew's isotherm)
கார்பன்டை ஆக்ஸைடின் அழுத்தம் - கனஅளவு, சமவெப்ப நிலைக்கோடுகள் ஆண்ட்ரூஸின் சமவெப்பநிலைக் கோடுகள் (Andrew's isotherm)
தாமஸ் ஆண்ட்ரூஸ் என்பவரால் வாயு மற்றும் திரவநிலைகளில் உள்ள ஒரு பொருளின் அழுத்தம், கனஅளவு மற்றும் வெப்பநிலை ஆகியவற்றிற்கு இடையேயான முழுமையான தரவுகள் முதன்முதலில் தரப்பட்டது. வெவ்வேறு வெப்பநிலைகளில், கார்பன்டை ஆக்ஸைடின் சமவெப்பநிலைக் கோடுகளை அவர் வரைந்தார். வரைபடம் 6.12ல் தரப்பட்டுள்ளது. இவ்வரை படத்திலிருந்து நாம் பின்வரும் விவரங்களைப் பெறமுடிகிறது.
குறைவான வெப்பநிலையில் வரையப்பட்ட வெப்ப சமநிலைக் கோடுகளில், உதாரணமாக 13°Cல், அழுத்தம் அதிகரிக்கப்படும் போது, ABன் வழியே 'B'யை அடையும் வரை கனஅளவு குறைகிறது. 'B'ல் அழுத்தம் மாறாதிருக்கும் போது, BCன் வழியே திரவமாதல் நிகழ்கிறது. மேலும் வாயு மற்றும் திரவ நிலைமைகள் இரண்டும் ஒருசேர காணப்படுகின்றன. 'C'ல் வாயுவானது முழுவதும் திரவமாக மாறுகிறது. C ல் உள்ள அழுத்தத்தை விட, அதிக அழுத்தம் தரப்படும் போது திரவம் மட்டுமே அமுக்கத்திற்கு உட்படுகிறது. எனவே அதன் கனஅளவில் குறிப்பிடத் தகுந்த மாற்றம் ஏற்படுவதில்லை.
அடுத்தடுத்த வெப்பநிலைகளில் வரையப்பட்ட சமநிலைக் கோடுகளும் இதே தன்மையினைப் பெற்றுள்ளதுடன் தட்டையான பகுதியின் அளவு குறைந்து கொண்டே வருகிறது. அதாவது, திரவமும் வாயுவும் ஒருசேர காணப்படும் கனஅளவு வீச்சு குறைகிறது. 31.1°Cல் வெப்பநிலையில், குறைந்து கொண்டே வரும் தட்டையானபகுதி ‘P' என்ற புள்ளியில் பூஜ்யமாகிறது. அதாவது இப்புள்ளியில் CO2 வாயுவானது முற்றிலும் திரவமாகிறது. இந்த வெப்ப நிலையானது, CO2ன் திரவமாகும் வெப்பநிலை அல்லது நிலைமாறும் வெப்பநிலை என அழைக்கப்படுகிறது. இப்புள்ளியில், அழுத்தம் 73 atm ஆகும். இந்த வெப்ப நிலைக்கு மேல் உள்ள அனைத்து அழுத்த நிலைகளிலும் CO2 வாயு நிலையிலேயே உள்ளது. கார்பன்டை ஆக்ஸைடைப் போன்றே பல இயல்பு வாயுக்களும் செயல்படுகின்றன என பின்னர் கண்டறியப்பட்டது.

படம் 6.12 வெவ்வேறு வெப்பநிலைகளில் CO2ன் சமவெப்பநிலைக்கோடுகள்
சமவெப்பநிலைக் கோடுகளின் இயல்பானது ஒரே மாதிரியாக இருந்த போதிலும், நிலைமாறு வெப்பநிலை மற்றும் அவ்வெப்ப நிலையில் நிலைமாறு அழுத்தம் மற்றும் நிலை மாறு கனஅளவு ஆகியவை ஒரு குறிப்பிட்ட வாயுவிற்கு அதன் தன்மையைப் பொறுத்து அமையும் பண்பாகும்.
நிலை மாறு மாறிலிகளை நாம் பின்வருமாறு வரையறுக்கலாம். எந்த ஒரு வெப்பநிலைக்கு மேலே அதிக அழுத்தம் அளிக்கப்படினும் ஒரு வாயுவினை, திரவமாக்க இயலாதோ அவ்வெப்பநிலை நிலைமாறு வெப்பநிலை (Tc) என வரையறுக்கப்படுகிறது. 1 மோல் வாயுவினை, அதன் நிலைமாறு வெப்ப நிலையில், திரவமாக்கத் தேவைப்படும் குறைந்த பட்ச அழுத்தம், நிலைமாறு அழுத்தம் (P0) என வரையறுக்கப்படுகிறது.
1 மோல் வாயுவானது, அதன் நிலை மாறு அழுத்தம் (Pc) மற்றும் நிலை மாறு வெப்பநிலையில் (Tc), அடைத்துக் கொள்ளும் கனஅளவு, நிலைமாறு கனஅளவு (Vc) என வரையறுக்கப்படுகிறது. சில பொதுவான வாயுக்களின் நிலைமாறு மாறிலிகளின் மதிப்பு அட்டவணை 6.2ல் கொடுக்கப்பட்டுள்ளது.
அட்டவணை 6.2 சில வாயுக்களுக்கான நிலைமாறு மாறிலிகள்

தன்மதிப்பீடு
8. H2O, NH3, மற்றும் CO2ன் நிலைமாறு வெப்பநிலைகள் முறையே 647.4K, 405.5K மற்றும் 304.2K ஆகும். நாம், 700K வெப்ப நிலையிலிருந்து குளிர்வித்தலை நிகழ்த்தும் போது, முதலில் திரவமாக மாறுவது மற்றும் இறுதியாக திரவமாக மாறுவது எது என கண்டறிக.
தீர்வு
• எந்த ஒரு வெப்பநிலைக்கு மேலே அதிக அழுத்தம் அளிக்கப்படினும் ஒரு வாயுவினை திரவமாக்க இயலாதோ அவ்வெப்பநிலை நிலைமாறு வெப்பநிலை எனப்படும்.
• 700K வெப்ப நிலையிலிருந்து குளிர்விக்கும் போது நீர் முதலில் திரவமாகிறது. அதனைத் தொடர்ந்து அம்மோனியாவும் இறுதியாக கார்பன் டை ஆக்ஸைடும் திரவமாகின்றன.
1. வாண்டர் வால்ஸ் மாறிலிகளிலிருந்து நிலைமாறு மாறிலிகளை தருவித்தல்
'n' மோல் வாயுவிற்கான வாண்டர் வால்ஸ் சமன்பாடு,
[ P + (an2 / V2) ] (V - nb) = nRT ---------- (6.22)
1 மோல் வாயுவிற்கு,
[ P + (a / V2) ] (V - b) = RT ---------- (6.23)
மேற்கண்டுள்ள சமன்பாட்டிலிருந்து, நிலைமாறு மாறிலிகள் PC, VC மற்றும் TCன் மதிப்புகளை வாண்டர் வால்ஸ் மாறிலிகள் a மற்றும் b ன் வாயிலாக தருவிக்கலாம். மேற்கண்டுள்ள சமன்பாட்டினை விரிவாக்க,
PV + (a / V) – Pb – (ab / V2) – RT = 0 ---------- (6.24)
சமன்பாடு (6.24) ஐ V2 / Pஆல்பெருக்குக

இச்சமன்பாடானது (6.26) Vல் அமைந்த முப்படிச் சமன்பாடாகும். இச்சமன்பாட்டினைத் தீர்க்கும் போது நாம் மூன்று தீர்வுகளைப் பெறலாம். நிலைமாறு நிலையில் Vன் இம்மூன்று மதிப்புகளும் நிலைமாறு கனஅளவு VCக்குச் சமம். மேலும் அழுத்தம் மற்றும் வெப்பநிலைகள் PC மற்றும் TC.க்குச் சமம்.
i.e., V = VC
V - VC = 0
(V - VC)3 = 0
V2 - 3VCV2 + 3VC2 V - VC3 = 0 ---------- (6.27)
(6.26) ஆனது (6.27) ஆகிய இருசமன்பாடுகளும் ஒன்றே என்பதால், (6.26) மற்றும் (6.27)ல் உள்ள V2, V ஆகியவற்றின் குணகங்கள் மற்றும் மாறிலி மதிப்புகளை நாம் சமப்படுத்தலாம்.
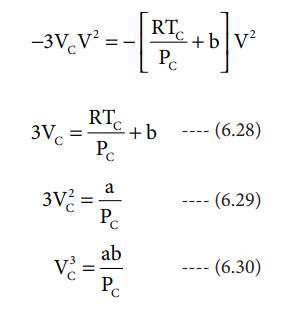
−3VCV2 = - [ (RTC / PC) + b ] V2
3VC = (RTC / PC) + b ---------- (6.28)
3VC2 = a / PC ---------- (6.29)
VC3 = ab / PC ---------- (6.30)
சமன்பாடு (6.30) ஐ சமன்பாடு (6.29) ஆல்வகுக்க
VC3 / 3VC2 = (ab / PC) / (a / PC)
VC / 3 = b
i.e. VC = 3b ---------- (6.31)
VC ன் மதிப்பினை (6.2ல் பிரதியிட)
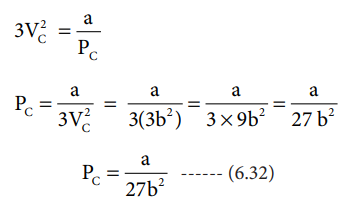
VC மற்றும் PC ன் மதிப்புகளைச் சமன்பாடு (6.28)ல் பிரதியிட
3VC = b + (RTC / PC)
3 (3b) = b + [ (RTC) / (a / 27b2) ]
9b – b = (RTC / a) 27b2
8b = (TCR 27b2) / a
∴ TC = 8ab / 27Rb2 = 8a / 27Rb
TC = 8a / 27Rb ---------- (6.33)
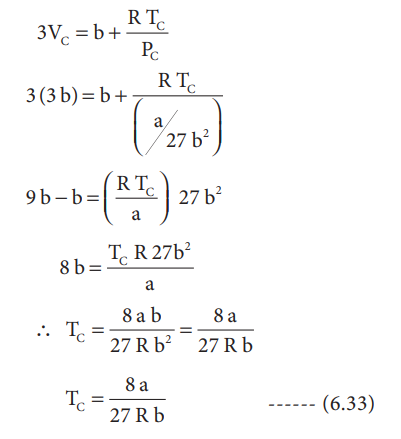
நிலைமாறு மாறிலிகளின் மதிப்பினைப் பயன்படுத்தி வாண்டர் வால்ஸ் மாறிலிகளையும், வாண்டர் வால்ஸ் மாறிலிகளைப் பயன்படுத்தி நிலைமாறு மாறிலிகளின் மதிப்புகளையும் கண்டறியலாம்.
a = 3V2C PC மற்றும் b = VC / 3