11 வது வேதியியல் : அலகு 7 : வெப்ப இயக்கவியல்
கிப்ஸ் கட்டிலா ஆற்றல் (G)
கிப்ஸ் கட்டிலா ஆற்றல் (G)
வெப்ப இயக்கவியல் இரண்டாம் விதியின் ஒரு முக்கியப் பயனானது, குறிப்பிட்ட நிபந்தனைகளின் கீழ் ஒரு வினையின் தன்னிச்சைத் தன்மையினைக் கண்டறிதல் ஆகும். குறிப்பிட்ட நிபந்தனையில், எந்தவித புறத்தூண்டு விசையின் உதவியும் இல்லாமல் ஒரு செயல்முறை நிகழுமாயின் அச்செயல்முறை தன்னிச்சை செயல்முறை எனவும், அவ்வாறு இல்லையெனில் தன்னிச்சையற்றது எனவும் அழைக்கப்படுகிறது. நம் அன்றாட வாழ்வில் பின்வரும் எடுத்துக்காட்டுகள் உள்ளிட்ட பல தன்னிச்சையான இயற் மற்றும் வேதிச் செயல்முறைகளை நாம் காண்கிறோம்.
1. அருவி கீழாக கொட்டுகிறது. ஆனால் எப்போதும் தன்னிச்சையாக மேலெழும்புவதில்லை.
2. ஒரு கப் குளம்பியில் (coffee) இடப்பட்ட சர்க்கரை தன்னிச்சையாக கரைகிறது. ஆனால், கரைந்த சர்க்கரை தன்னிச்சையாக மீண்டும் படிகங்களாக உருவாவதில்லை.
3. வெப்பம் சூடான பொருளிலிருந்து குளிர்ந்த பொருளுக்கு பாய்கிறது ஆனால், குளிர்ந்த பொருளிலிருந்து சூடான பொருளுக்கு வெப்பம் தன்னிச்சையாக பாய்வதில்லை.
4. கீழ்க்கண்டுள்ள படத்தில் காட்டியுள்ளவாறு, இரு குமிழிகளுக்கு இடைப்பட்ட அடைப்பு நீக்கப்படும்போது, வாயு நிரம்பிய ஒரு குமிழிலிருந்து, வெற்றிடமாக்கப்பட்ட மற்றொரு குமிழிக்கு தன்னிச்சையாக வாயு விரிவடைகிறது. ஆனால், அதன் மறுதலை செயல்முறையான அனைத்து வாயு மூலக்கூறுகளும் ஒரே குமிழில் மீளவும் ஒன்றாக திரள்வது தன்னிச்சையாக நிகழ்வதில்லை.
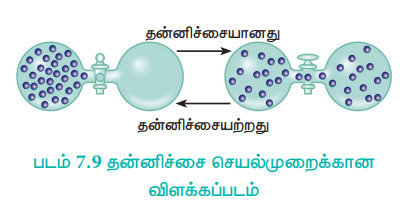
படம் 7.9 தன்னிச்சை செயல்முறைக்கான விளக்கப்படம்
இந்த எடுத்துக்காட்டுகளிலிருந்து ஒரு திசையில் தன்னிச்சையாக நிகழும் செயல்முறைகள் அதற்கெதிரான திசையில் தன்னிச்சையாக நிகழ முடியாது என்பதை அறிகிறோம்.
இதைப்போலவே பெரும்பாலான வெப்பம் உமிழ்வினைகள் தன்னிச்சையாக நிகழ்கின்றன. எடுத்துக்காட்டாக மீத்தேனின் எரிதல் வினை.
CH4 + 2 O2 → CO2 + 2 H2O ΔH° = - 890.4 kJ mol-1
மற்றொரு எடுத்துக்காட்டு அமில-கார நடுநிலையாக்கல் வினை
H+ + OH- → H2O ΔH° = - 57.32 kJ mol-1
இருந்தபோதிலும், சில வெப்பம் கொள் வினைகளும் தன்னிச்சையாக நிகழ்கின்றன. எடுத்துக்காட்டாக, அம்மோனியம் நைட்ரேட் நீரில் கரைதல் வெப்பக் கொள்வினையாக இருந்த போதிலும் தன்னிச்சையானது.
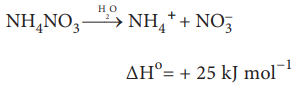
மேற்கண்ட எடுத்துக்காட்டுகளிலிருந்து நாம் பின்வரும் முடிவிற்கு வர முடியும். வெப்பம் உமிழ்தல் என்பது தன்னிச்சை நிகழ்விற்கான சாதகமான காரணி மட்டுமே அன்றி, உத்திரவாதமான காரணி அல்ல ஒரு அமைப்பில் ஏற்படும் ஆற்றல் மாற்றங்களை மட்டுமே அடிப்படையாக கொண்டு ஒரு வேதிவினை நிகழுமா? அல்லது நிகழாதா? என்பதை நாம் தீர்மானிக்க முடியாது. ஆனால் வெப்ப இயக்கவியல் இரண்டாம் விதிப்படி தன்னிச்சையான ஒரு செயல் முறையில் என்ட்ரோபி அதிகரிக்கிறது. ஆனால் என்ட்ரோபி அதிகரிக்கும் அனைத்து செயல்முறைகளும் தன்னிச்சையாக நிகழ்வதில்லை. ஒரு வினையின் தன்னிச்சைத் தன்மையை தீர்மானிக்க நமக்கு மற்றொரு வெப்ப இயக்கவியல் சார்பு தேவைப்படுகிறது.
வெப்ப இயக்கவியலின் இரண்டாம் விதியானது. வினையின் தன்னிச்சைத் தன்மையை கண்டறிய பயன்படும் வகையில் "கிப்ஸ் கட்டிலா ஆற்றல்" என்ற வெப்ப இயக்கவியல் சார்பை, அறிமுகப்படுத்துகிறது. 1870களில் "ஜோஸைய் வில்லார்டுகிப்ஸ்" என்பவர் கிப்ஸ் கட்டிலா ஆற்றலை (G) வரையறுத்தார். அவர் இந்த ஆற்றலை ஒரு அமைப்பில் வேலை செய்வதற்கு "கிடைக்கக்கூடிய ஆற்றல்" என அழைத்தார். இவ்வாற்றல் ஒரு வேதிவினையோடு தொடர்புடைய வேலை செய்வதற்கு பயன்படுத்ததக்க ஆற்றல் ஆகும்.
கிப்ஸ் கட்டிலா ஆற்றலை பின்வருமாறு வரையறுக்கலாம்.
G = H – TS ---------- (7.35)
கிப்ஸ் கட்டிலா ஆற்றல் (G) ஒரு பொருண்மை சார் பண்பாகும். மேலும் G என்பது ஒற்றை மதிப்புடைய நிலைச்சார்பாகும்.
மாறாத வெப்பநிலையில் ஒரு அமைப்பானது நிலை 1 லிருந்து நிலை 2க்கு மாற்றமடையும் செயல்முறையைக் கருதுவோம்.
G2 – G1 = (H2 – H1) – T (S2 – S1)
ΔG = ΔH - TΔS ---------- (7.36)
ΔG -ன் மதிப்பு எவ்வாறு வினையின் தன்னிச்சை தன்மையுடன் தொடர்புபடுத்தப்படுகிறது என்பதை நாம் காண்போம்.
நாம் அறிந்தபடி,
ΔSமொத்தம் = ΔSஅமைப்பு + ΔSசூழல்
ஒரு மீள்செயல்முறையில் (சமநிலை), அண்டத்தின் என்ட்ரோபி மாற்றம் பூஜ்ஜியம்.
ΔS = 0 [∵ ΔSஅமைப்பு = - ΔSசூழல்]
மேலும் ஒரு சமநிலை செயல்முறைக்கு ΔG = 0
ஒரு தன்னிச்சை செயல்முறைக்கு ΔSமொத்தம் > 0, எனவே

எனவே ஒரு தன்னிச்சை செயல்முறைக்கு
ΔG < 0
i.e. ΔH - T ΔS < 0 ---------- (7.37)
ΔH (அமைப்பு) என்பது வினையின் என்தால்பி மாற்றம், (TΔS (அமைப்பு)) என்பது பயனுள்ள வேலையை செய்வதற்கு கிடைக்காத ஆற்றல் எனப்படுகிறது. எனவே, ΔG என்பது பயணுள்ள வேலை செய்வதற்கு கிடைக்கக் கூடிய நிகர ஆற்றல் ஆகும். இக்காரணத்தினால் இது ஒரு வினையின் கட்டிலா ஆற்றல் எனவும் அறியப்படுகிறது.
ஒரு தன்னிச்சையற்ற செயல்முறைக்கு ΔG > 0.
கிப்ஸ் கட்டிலா ஆற்றல் மற்றும் அமைப்பினால் செய்யப்பட்ட நிகரவேலை
மாறாத வெப்ப அழுத்த நிலையில், எந்த ஒரு அமைப்பிற்கும்
ΔG = ΔH - T ΔS ---------- (7.36)
நாமறிந்தபடி,
ΔH = ΔU + PΔV
∴ ΔG = ΔU + PΔV - TΔS
வெப்ப இயக்கவியல் முதல் விதிப்படி, அமைப்பு வேலை செய்யும் பொழுது
ΔU = q - w
வெப்ப இயக்கவியல் இரண்டாம் விதிப்படி
ΔS = q / T
ΔG = q – w + PΔV – T (q / T)
ΔG = -w + PΔV
-ΔG = -w - PΔV ---------- (7.38)
PΔV என்பது மாறாத புற அழுத்தத்திற்கு எதிராக விரிவடைதலால் செய்யப்படும் வேலையை குறிக்கிறது. எனவே, மாறாத வெப்ப அழுத்த நிலைகளில், ஒரு செயல்முறை நிகழும்போது ஏற்படும் கட்டிலா ஆற்றல் குறைவு (-ΔG) என்பது அமைப்பு செய்யும் விரிவடைதல் வேலையை தவிர்த்து அமைப்பிலிருந்து பெறக்கூடிய அதிகபட்ச வேலைக்குச் சமம்.
1. தன்னிச்சை செயல்முறைகளுக்கான அடிப்படை விதிமுறைகள்:
எந்த ஒரு செயல் முறையின் தன்னிச்சை தன்மையும் மூன்று வெவ்வேறு காரணிகளை பொறுத்து அமைகிறது.
● ஒரு செயல்முறையின் என்தால்பி மாற்றம் எதிர்குறி மதிப்பை பெற்றிருந்தால், அச்செயல் முறையானது வெப்பம் உமிழ் செயல்முறையாகும், மேலும் தன்னிச்சையாக நிகழலாம். (ΔH எதிர்குறி உடையது)
● ஒரு செயல்முறையின் என்ட்ரோபி மாற்றம் நேர்குறி மதிப்பை பெற்றிருந்தால், அச்செயல் முறையானது தன்னிச்சையாக நிகழலாம் (ΔS நேர்குறி உடையது)
● ஒரு வினை தன்னிச்சையாக நிகழ மேற்கூறிய இரண்டின் தொகுப்பான கட்டிலா ஆற்றல் மதிப்பு கண்டிப்பாக எதிர்குறியை பெற்றிருக்க வேண்டும். அதாவது ஒரு வினை தன்னிச்சையாக நிகழ்வதற்கு தேவையான நிபந்தனை ΔH - TΔS < 0 என்பதாகும்.
அட்டவணை 7.5 வினைகளின் தன்னிச்சை தன்மைமீது வெப்ப நிலையின் விளைவு
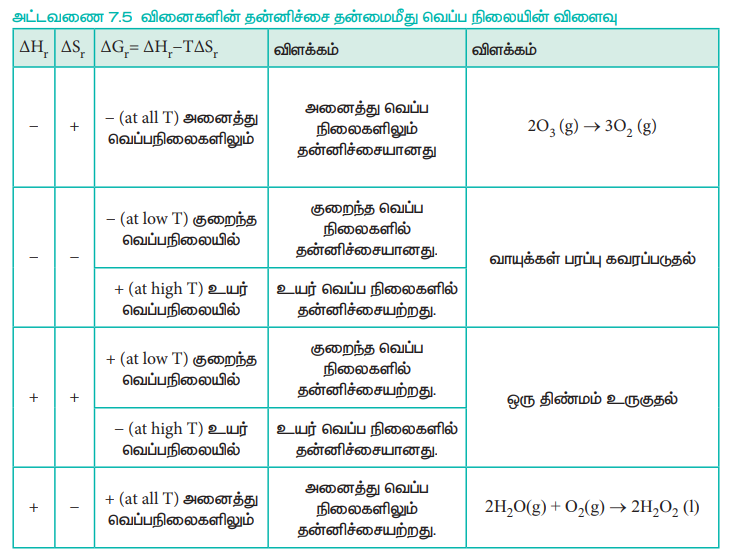
இந்த அட்டவணையானது ΔH மற்றும் ΔS ஆகியவை அனைத்து வெப்ப நிலைகளிலும், மேற் குறிப்பிட்டுள்ளவாறு இருப்பதாக கருத்திற் கொண்டுள்ளது. அவ்வாறாகவே இருக்க வேண்டும் என அவசியமில்லை. ஒரு வேதி வினையின் தன்னிச்சை தன்மையானது, மேலே குறிப்பிட்டுள்ளவாறு வினை நிகழ்வதற்கான வாய்ப்பினை மட்டும் தருகிறது. இத்தகைய செயல்முறைகளின் வேகமானது வெப்ப இயக்கவியல் கணிப்புகளுக்கு அப்பாற்பட்ட, வினை வேகவியல் காரணிகளால் (kinetic factors) தீர்மானிக்கப்படுகிறது.
கணக்கு 7.8
300K வெப்ப நிலையில், CO + (1/2) O2 → CO2 என்ற வினை தன்னிச்சையானது எனக்காட்டுக. CO2 மற்றும் CO ஆகியன உருவாவதற்கான திட்ட கட்டிலா ஆற்றல் மாற்றங்கள் முறையே -394.4 மற்றும் -137.2 kJ mole-1.
CO + (1/2) O2 → CO2
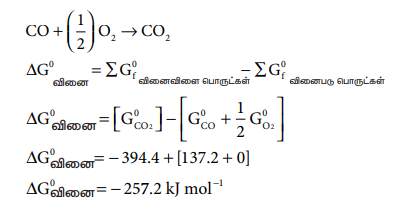
ΔG0வினை = - 394.4 + [137.2 + 0]
ΔG0வினை = - 257.2 kJ mol-1
கொடுக்கப்பட்ட வெப்பநிலையில் ΔG0வினை மதிப்பு எதிர்குறியை பெறுகிறது, எனவே வினை தன்னிச்சையாக நிகழும்.
தன்மதிப்பீடு
8) 300K வெப்ப நிலையில் ஒரு வேதி வினையின் ΔH மற்றும் ΔS மதிப்புகள் முறையே -10 kJ mole-1 மற்றும் -20 J deg-1 mole-1 எனில், வினையின் ΔG மதிப்புயாது? ΔH மற்றும் ΔS மதிப்புகள் மாறிலிகள் என கருதி 600 K வெப்ப நிலையில் வினையின் ΔG மதிப்பை கணக்கிடுக. வினையின் தன்மையை கண்டறிக.
தீர்வு:
∆H = −10kJ mol–1 = −10000 Jmol–1
∆S = 20JK–1mol–1
T = 300K
∆G = ?
∆G = ∆H − T∆S
∆G = −10kJmol–1 − 300K × (−20 × 10) –3 kJ K–1mol–1
∆G = − 4kJmol–1
At 600K
∆G = −10 – 600 × (–20 × 10−3).
∆G = − 10 + 12
∆G = +2KJmol−1
∆G எதிர்குறி மதிப்பு இருப்பதால் 300K−ல் வினை தன்னிச்சையானது.
∆G நேர்குறி மதிப்பு இருப்பதால், 600K−ல் வினை தன்னிச்சையற்றது.
2. திட்ட கட்டிலா ஆற்றல் மாற்றத்திற்கும் ΔG0, சமநிலை மாறிலிக்கும் K(eq) இடையே உள்ள தொடர்பு:
மீள் செயல் முறைகளில், அமைப்பானது எப்பொழுதும் சுற்றுப்புறத்துடன் தொடர்ந்து சமநிலையில் இருக்கும் ஒரு மீள் வேதி வினையானது நேரத்தில், இரு திசைகளில் நிகழ முடியும். இதனால் இயங்கு சமநிலை ஏற்படுகிறது. அதாவது, வினையானது ஒரே நேரத்தில் இரு திசைகளிலும் கண்டிப்பாக கட்டிலா ஆற்றல் குறையும் வகையில் நிகழ வேண்டும் என்ற பொருளை இது தருகிறது. இந்நிலை சாத்தியமற்ற ஒன்றாகும். சமநிலையில், ஒரு அமைப்பின் கட்டிலா ஆற்றல் குறைந்தபட்ச மதிப்பினை பெற்றிருந்தால் மட்டுமே சாத்தியமான ஒன்றாகும். ஒரு பொதுவான சமநிலை வினையைக் கருதுவோம்.
A + B ⇋ C + D
எந்த நிலையிலும், மேற்காண் வினையின் கட்டிலா ஆற்றல் மாற்றமானது (ΔG) அவ்வினையின் திட்ட கட்டிலா ஆற்றல் மாற்றத்துடன் (ΔG0) பின்வரும் சமன்பாட்டின்படி தொடர்பு படுத்தப்படுகிறது.
ΔG = ΔG0 + RT ln Q ---------- (7.39)
இங்கு Q என்பது வினை குணகம். வினை குணகம் என்பது "சமநிலையற்ற நிலையில், வினைவிளை பொருட்களின் செறிவுகளின் பெருக்கற்பலனிற்கும், வினைபடு பொருட்களின் செறிவுகளின் பெருக்கற்பலனிற்கும் இடையே உள்ள விகிதம்" என வரையறுக்கப்படுகிறது.
சமநிலையை அடையும்போது, கட்டிலா ஆற்றலில் மேற்கொண்டு மாற்றம் ஏதும் நிகழாது. அதாவது ΔG = 0, மேலும் வினை குணகம் Q என்பது சமநிலை மாறிலிக்கு சமமாகிறது. எனவே மேற்கண்ட சமன்பாடு பின்வருமாறு மாறுகிறது.
ΔG0 = -RT ln Keq
இச்சமன்பாடு வாண்ட் - ஹாஃப் சமன்பாடு எனப்படுகிறது.
ΔG0 = - 2.303 RT log Keq ---------- (7.40)
மேலும் நாம் அறிந்தபடி,
ΔG0 = ΔH0 - TΔS0 = - RT ln Keq
கணக்கு 7.9
298 K வெப்பநிலையில் ஆக்ஸிஜனை ஓசோனாக மாறும் 3/2 O2 → O3 (g) வினைக்கு ΔG0 காண்க, திட்டஅழுத்த அலகுகளில் இவ்வினையின் Kp மதிப்பு 2.47 × 10-29
தீர்வு:
ΔG0 = - 2.303 RT log Kp
இங்கு
R = 8.314 JK-1 mol-1
Kp = 2.47 × 10-29
T = 298K
ΔG0 = -2.303 (8.314) (298) log (2.47 × 10-29)
ΔG0 = 163229 Jmol-1
ΔG0 = 163.229 KJ mol-1