எலக்ட்ரான் அமைப்பு, ஆக்டினாய்டுகளின் ஆக்சிஜனேற்ற நிலை - ஆக்டினாய்டுகள் | 12th Chemistry : UNIT 4 : Transition and Inner Transition Elements
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 4 : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
ஆக்டினாய்டுகள்
ஆக்டினாய்டுகள்
ஆக்டினியத்தினைத் தொடர்ந்து வரும் 14 தனிமங்கள். அதாவது தோரியம் (90Th) முதல் லாரன்சீயம் (105Lr) வரையிலான தனிமங்கள் ஆக்டினாய்டுகள் என அழைக்கப்படுகின்றன. லாந்தனாய்டுகளைப் போலன்றி அனைத்து ஆக்டினாய்டுகளும் கதிரியக்கத் தன்மையுடையவை. மேலும் பெரும்பாலானவை குறைவான அரை வாழ் காலங்களைப் பெற்றுள்ளன. இயற்கையில் யூரேனியம் மற்றும் தோரியம் ஆகியன மட்டும் குறிப்பிட்ட தகுந்த அளவு கிடைக்கின்றன. மேலும் யூரேனியத் தாதுக்களில் மிகச் சிறிதளவு புளுட்டோனியம் காணப்படுகிறது.
நெப்ட்யூனியம் மற்றும் அதனைத் தொடர்ந்து வரும் உயர் தனிமங்கள் அனைத்தும், இயற்கையில் கிடைக்கும் தனிமங்களிலிருந்து அவைகளின் செயற்கை கதிரியக்க பரிமாற்ற வினைகளின் மூலம் தொகுப்பு முறையில் தயாரிக்கப்படுகின்றன. லாந்தனாய்டுகளை போலவே இவைகளும் தனிம வரிசை அட்டவணையில் கீழ்புறத்தில் தனியே வைக்கப்பட்டுள்ளன.
எலக்ட்ரான் அமைப்பு
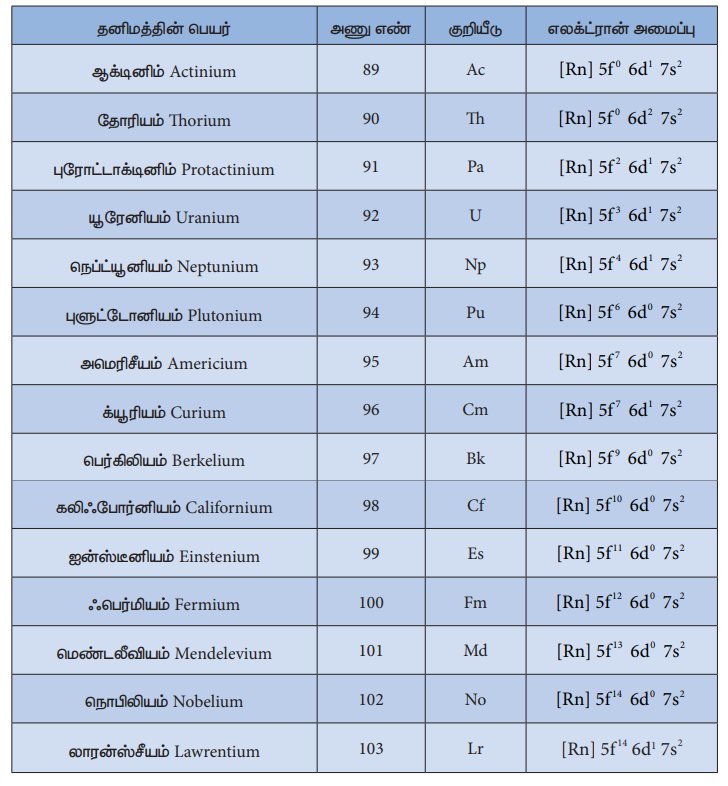
ஆக்டினாய்டுகள் வரையறுக்கப்பட்ட எலக்ட்ரான் அமைப்பினைப் பெற்றிருப்பதில்லை. இவற்றின் (5f தொகுதித் தனிமங்களின்) பொதுவான இணைதிற கூட்டு எலக்ட்ரான் அமைப்பினை [Rn]5f0-146d0-27s2 எனக் குறிப்பிடலாம். ஆக்டினாய்டு தனிமங்களின் எலக்ட்ரான் அமைப்பு பின்வரும் அட்டவணையில் தரப்பட்டுள்ளது.
ஆக்டினாய்டுகளின் எலக்ட்ரான் அமைப்பு
ஆக்டினாய்டுகளின் ஆக்சிஜனேற்ற நிலை
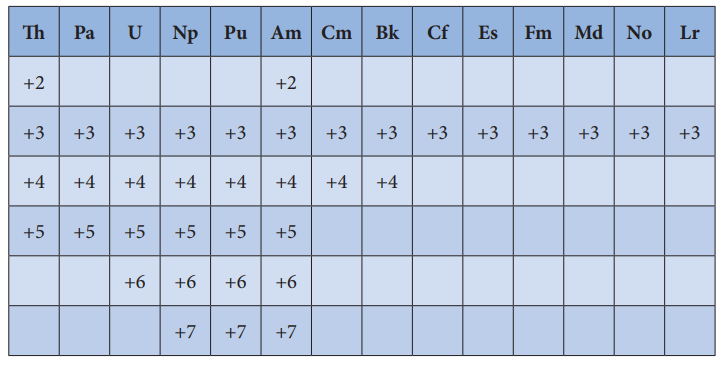
லாந்தனாய்டுகளைப் போலவே ஆக்டினாய்டுகளிலும் பொதுவான ஆக்சிஜனேற்ற நிலையாக +3 காணப்படுகிறது. இதனுடன் +2, +3, +4,+5, +6, மற்றும் +7 ஆகிய மாறுபடும் ஆக்சிஜனேற்ற நிலைகளையும் ஆக்டினாய்டுகள் பெற்றுள்ளன.
அமெரிசீயம் (Am) மற்றும் தோரியம் (Th) ஆகியன அவற்றின் சில சேர்மங்களில் +2 ஆக்சிஜனேற்ற நிலையைப் பெற்றுள்ளன. எடுத்துக்காட்டு தோரியம் அயோடைடு (ThI2). Th , Pa, U ,Np , Pu மற்றும் Am ஆகிய தனிமங்கள் +5 ஆக்சிஜனேற்ற நிலையைப் பெற்றுள்ளன. Np மற்றும் Pu ஆகியன +7 ஆக்சிஜனேற்ற நிலையைப் பெற்றுள்ளன.
லாந்தனாய்டுகள் மற்றும் ஆக்டினாய்டுகளுக்கிடையேயான வேறுபாடுகள்
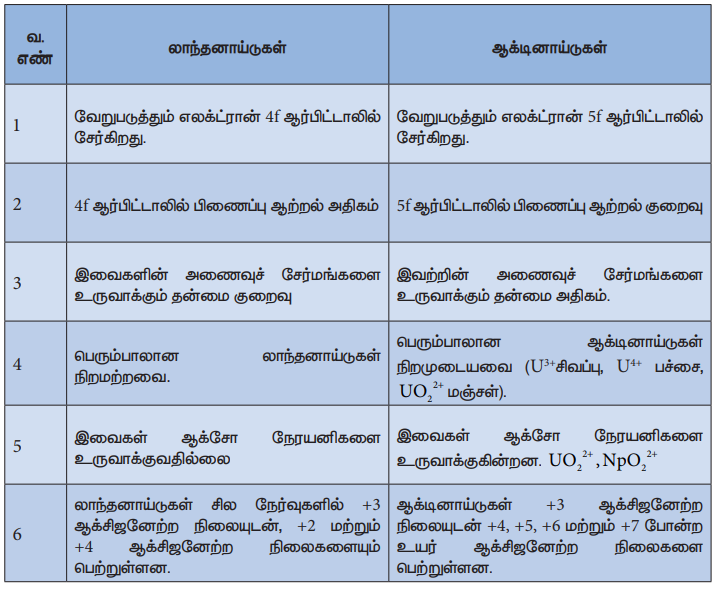
லாந்தனாய்டுகள்
1. வேறுபடுத்தும் எலக்ட்ரான் 4f ஆர்பிட்டாலில் சேர்கிறது.
2. 4f ஆர்பிட்டாலில் பிணைப்பு ஆற்றல் அதிகம்
3. இவைகளின் அணைவுச் சேர்மங்களை உருவாக்கும் தன்மை குறைவு
4. பெரும்பாலான லாந்தனாய்டுகள் நிறமற்றவை.
5. இவைகள் ஆக்சோ நேரயனிகளை உருவாக்குவதில்லை
6. லாந்தனாய்டுகள் சில நேர்வுகளில் +3 ஆக்சிஜனேற்ற நிலையுடன், +2 மற்றும் +4 ஆக்சிஜனேற்ற நிலைகளையும் பெற்றுள்ளன.
ஆக்டினாய்டுகள்
1. வேறுபடுத்தும் எலக்ட்ரான் 5f ஆர்பிட்டாலில் சேர்கிறது.
2. 5f ஆர்பிட்டாலில் பிணைப்பு ஆற்றல் குறைவு
3. இவற்றின் அணைவுச் சேர்மங்களை உருவாக்கும் தன்மை அதிகம்.
4. பெரும்பாலான ஆக்டினாய்டுகள் நிறமுடையவை (U3+சிவப்பு, U4+ பச்சை, UO2 2+ மஞ்சள்).
5. இவைகள் ஆக்சோ நேரயனிகளை உருவாக்குகின்றன. UO2 NpO 2 2 + +2 ,
6. ஆக்டினாய்டுகள் +3 ஆக்சிஜனேற்ற நிலையுடன் +4, +5, +6 மற்றும் +7 போன்ற உயர் ஆக்சிஜனேற்ற நிலைகளை பெற்றுள்ளன.