12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 4 : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
லாந்தனாய்டுகளின் எலக்ட்ரான் அமைப்பு
லாந்தனாய்டுகளின் எலக்ட்ரான் அமைப்பு
ஆஃபா தத்துவத்தின்படி எலக்ட்ரான்கள் வெவ்வேறு ஆர்பிட்டால்களில் நிரப்பப்படும் போது, அவைகளின் ஆற்றலின் ஏறுவரிசையில் நிரப்பப்படுகின்றன என நாம் அறிவோம். இவ்விதியின் படி 5s, 5p மற்றும் 63 ஆகிய ஆர்பிட்டால்கள் நிரப்பப்பட்ட பின்லாந்தனத்திலிருந்து 4f ஆர்பிட்டாலில் எலக்ட்ரான் நிரப்பப்படுதல் துவங்க வேண்டும். எனவே லாந்தனத்தின் எதிர்ப்பார்க்கப்படும் எலக்ட்ரான் அமைப்பு [Xe] 4f1 5d° 6S2 ஆனால் லாந்தனத்தின் உண்மையான எலக்ட்ரான் அமைப்பு [Xe] 4f° 5d1 6s2 எனவே இது d தொகுதி தனிமத்தைச் சார்ந்தது. 4f ஆர்பிட்டால் நிரப்பப்படுதல் சீரியத்தில் (Ce) துவங்குகிறது. இதன் எலக்ட்ரான் அமைப்பு (Xe] 4f1 5d1 6s2 சீரியத்திலிருந்து மற்ற தனிமங்களை நோக்கிச் செல்லும் போது கூடுதல் எலக்ட்ரான்கள் 4f ஆர்பிட்டால்களில் தொடர்ச்சியாகச் சேர்கின்றன. இதனை பின்வரும் அட்டவணையிலிருந்து அறியலாம்.
அட்டவணை லாந்தனம் மற்றும் லாந்தனாய்டுகளின் எலக்ட்ரான் அமைப்பு
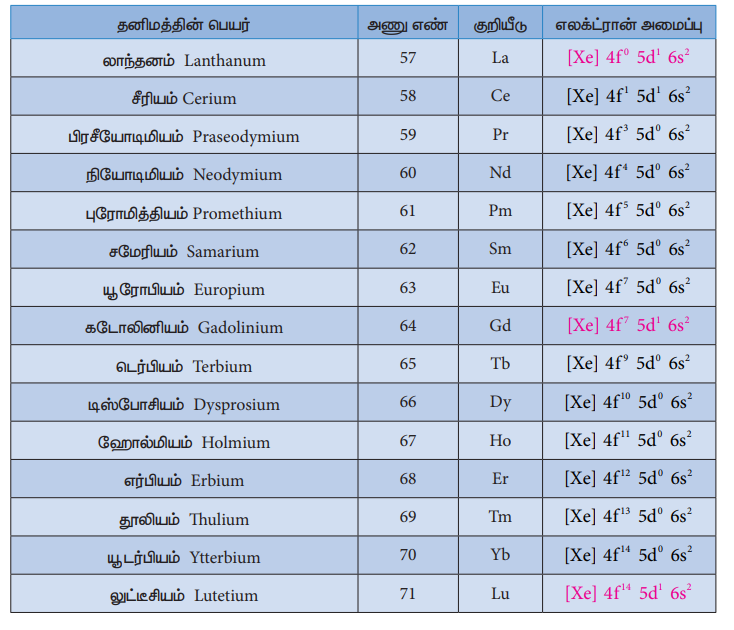
கடோலினியம் (Gd) மற்றும் லுட்டீசியம் (Lu) ஆகியனவற்றில் முறையே அவற்றின் 4f ஆர்பிட்டால்கள் சரிபாதி மற்றும் முழுமையாக நிரப்பப்பட்டுள்ளன. மேலும் அவைகளின் 5d ஆர்பிட்டாலில் ஒரு எலக்ட்ரான் காணப்படுகிறது. எனவே 4f வரிசைத் தொடர்த் தனிமங்களின் பொதுவான எலக்ட்ரான் அமைப்பினை நாம் [Xe] 4f1-14 5d0-1 6s2 என எழுதலாம்.