இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள் | வேதியியல் - தனிம வரிசை அட்டவணையில் d தொகுதி தனிமங்களின் இடம் | 12th Chemistry : UNIT 4 : Transition and Inner Transition Elements
12 ஆம் வகுப்பு வேதியியல் : அத்தியாயம் 4 : இடைநிலை மற்றும் உள் இடைநிலைத் தனிமங்கள்
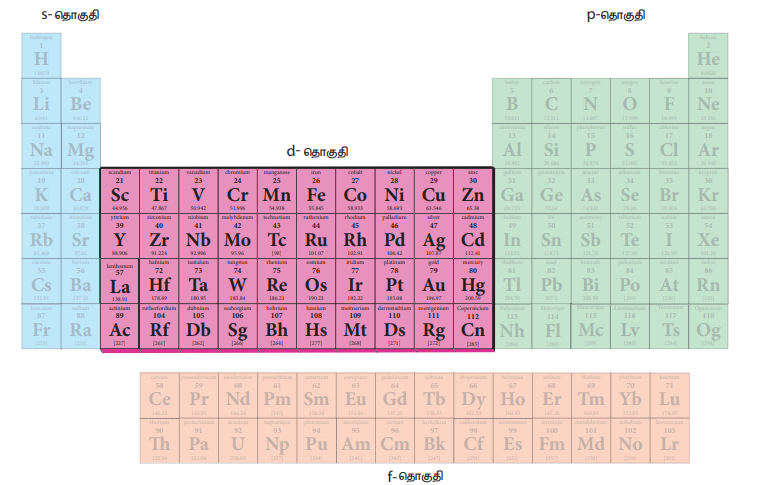
தனிம வரிசை அட்டவணையில் d தொகுதி தனிமங்களின் இடம்
தனிம வரிசை அட்டவணையில் d தொகுதி தனிமங்களின் இடம்
தனிமங்களின் ஆவர்த்தன வகைபாட்டினை நாம் ஏற்கனவே பதினொன்றாம் வகுப்பில் கற்றுள்ளோம். அவ்வகைப்பாட்டின்படி, நவீன தனிம வரிசை அட்டவணையில் மூன்றாம் தொகுதி முதல் பன்னிரெண்டாம் தொகுதி வரை இடைநிலை உலோகங்கள் இடம் பெற்றுள்ளன.
d தொகுதித் தனிமங்கள் பின்வரும் வரிசைகளை உள்ளடக்கி உள்ளன.
(i) 3d தொடர் (4 வது வரிசை) - ஸ்காண்டியம் முதல் துத்தநாகம் (Zinc) வரை (10 தனிமங்கள்)
(ii) 4d தொடர் (5 வது வரிசை ) - இட்ரியம் முதல் காட்மியம் வரை (10 தனிமங்கள் )
(iii) 5d தொடர் (6 வது வரிசை) - லாந்தனம் மற்றும் ஹாப்னியம் முதல் மெர்குரி வரை (10 தனிமங்கள்)
பன்னிரெண்டாம் தொகுதி தனிமங்களான துத்தநாகம், காட்மியம் மற்றும் மெர்குரி ஆகியன அவைகளின் தனிம நிலையிலோ அல்லது அவற்றின் வழக்கமான ஆக்சிஜனேற்ற நிலையில் காணப்படும் அயனிகளிலோ, பகுதியளவு நிரப்பட்டப்பட்ட d ஆர்பிட்டால்களை பெற்றிருப்பதில்லை என நாம் அறிவோம். எனினும், அவைகளின் பண்புகள் தொடர்புடைய இடைநிலை தனிம வரிசை தனிமங்களின் தொடர்ச்சியாக ஒத்திருப்பதால் அவைகளும் இடைநிலை தனிமங்களாகக் கருதப்படுகின்றன. IUPAC வரையறையின்படி, ஏழாவது வரிசை தனிமங்களான ஆக்டீனியம் மற்றும் ரூதர்போர்டீயம் முதல் கோபர்னீசியம் வரையிலான பத்து தனிமங்களும் இடைநிலை தனிமங்களாகும். இவ்வரிசை தனிமங்கள் அனைத்தும் கதிரியக்கத்தன்மை உடையவை. இத்தொடரில், ஆக்டீனியத்தை தவிர, பிற அனைத்து தனிமங்களும் செயற்கை தொகுப்பு முறையில் தயாரிக்கப்படுகின்றன. மேலும், இத்தனிமங்கள் மிகக் குறைவான அரை வாழ் காலங்களைப் பெற்றுள்ளன.
படம் 4.1 தனிம வரிசை அட்டவணையில் d தொகுதித் தனிமங்களின் இடம்